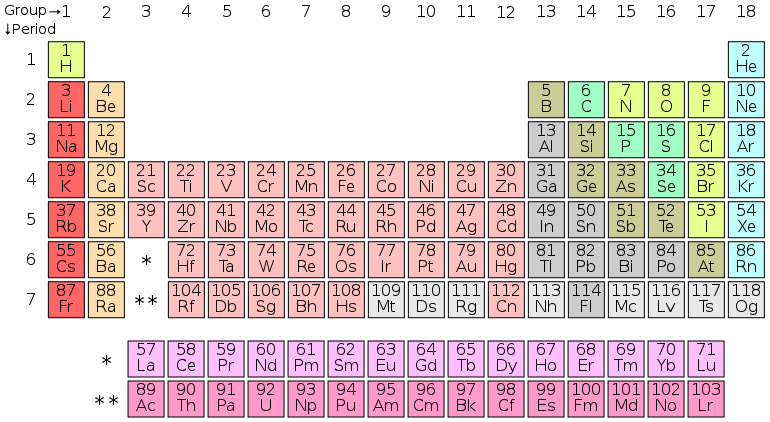
八年級科學/第一節:元素
元素週期表中的元素都是構成物質宇宙結構基礎的不同型別的原子。目前已知有超過 100 種元素。元素根據其質子數進行編號,因為這是賦予每個原子其獨特性質的原因。每個原子都包含一個原子核,原子核周圍環繞著帶負電的電子雲。原子核由帶正電的質子和不帶電的中子組成。對於每個質子,都存在一個相互作用的電子,這意味著所有元素都不帶電。例如,宇宙中最常見的元素是氫。氫有 1 個質子、1 個電子和 1 或 2 箇中子。由於它有 1 個質子,所以在元素週期表中它被賦予了數字 1。
每個元素周圍軌道的電子不僅決定了它在週期表中的位置,還決定了它如何與其他元素相互作用。每個元素都有一組圍繞其執行的電子軌道,根據電子的數量和它們佔據的軌道,決定了它與什麼共享它的電子。元素週期表按這種方式劃分是為了區分電子不足的元素(左側;鹼金屬和鹼土金屬),也電子不足但都有不完整的 d 軌道(中間;過渡金屬),電子豐富的元素(右側;非金屬)。還有一個特殊的族被稱為惰性元素。這些元素形成了一個完整的外部電子層,這使得它們除了在特殊情況下無法與任何東西發生反應。
如前所述,每個元素都有一團電子圍繞它,根據該數量決定了它的行為方式以及它如何與其他元素相互作用。每個原子的第一個環在填充了兩個電子時是穩定的。此後每個環通常必須有八個電子才能穩定。自然界試圖以最小的努力獲得平衡。具有少於四個電子的原子將嘗試將除了第一個環之外的任何環都清空。另一方面,具有超過四個電子的原子將嘗試填滿最外層的環。這被稱為八面體規則或八隅體規則。氫的原子序數為 1,這意味著它有一個質子,因此有一個電子。這個電子填充了 s 軌道的一半。每個圍繞元素執行的電子對都需要一個“自旋向上”而另一個電子“自旋向下”來為原子創造穩定性。化學的一個重要規則是,一切都想找到最穩定的狀態。當原子的外層電子層(稱為價層)充滿時,原子是穩定的。由於氫只有一個電子,氫原子通常與其他氫原子結合。像這樣自然地與自身結合的元素被稱為雙原子元素,來自希臘語“Di”,意思是兩個。
氫之後的下一個元素是氦。氦的原子序數為 2,有兩個電子填充 s 軌道。因為第一個環只需要兩個電子,所以氦非常穩定。氦不僅非常穩定,而且與它共享一個列的所有元素也都共享這種完整的軌道構型,因此也很穩定。這些元素是惰性元素,如上所述。當您沿著元素週期表向下移動(原子序數增加)時,p 和 d 軌道等更多軌道被填充。電子按如下方式分佈(以引導數字表示軌道數,以最後一個數字表示電子數):1S2 2S2 2P6 3S2 3P6 4S2 3D10 4P6 4D10 4F14 沿途偶爾會有例外,關於偶爾元素的電子分佈方式,否則元素週期表是一個很好的方法,可以根據表格中的趨勢快速確定元素的軌道。