- 另請參閱:關於烯烴和繪製烯烴的資訊
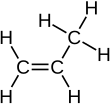
烯烴分子是不飽和的烴,因為它們比具有相同碳原子數的烷烴少2個氫原子,並且也具有碳雙鍵而不是全部單鍵。烷烴是飽和的烴。您可以透過溴試驗來區分飽和和不飽和烴。
在空氣中,氧氣不足以使烯烴完全燃燒,完全燃燒只會產生二氧化碳和水(與烷烴的完全燃燒相同)。與其他燃燒反應一樣,這是一個放熱反應;會釋放能量。相反,它們在空氣中燃燒會產生冒煙的黃色火焰

形成的精確產物取決於氧氣的含量,因此您可能會有沒有碳產生的反應。以下是在存在少量氧氣的情況下戊烯(5個碳)的不完全燃燒的示例

或者您也可以使用相同的反應

但是碳允許您更容易地平衡它,因此是首選選擇。
烯烴與氫氣、水和鹵素反應,透過在  處新增原子,使雙鍵變為單鍵。
處新增原子,使雙鍵變為單鍵。
烯烴與氫氣反應時可以轉化回烷烴。以下是以丙烯為例

請記住,烷烴和烯烴的通式之差是2個氫原子。您還需要能夠繪製顯示式
如我們所見,烯烴的官能團(同系物系列的特徵結構,賦予其所有特殊性質)碳雙鍵被轉化為與氫氣的單鍵。但是,這種反應只能在催化劑的存在下進行。
鹵素也會去除烯烴官能團。以下是以乙烯和溴為例的化學式

文字方程式有助於理解發生了什麼

“二”指的是化合物中存在兩個溴原子,而“-烷”則表示不再存在碳雙鍵;它具有與烷烴相同的官能團(所有單鍵)。結構式如下:
 + Br—Br → + Br—Br →  |
| 乙烯 + 溴 → 二溴乙烷 |
正如我們所見,這與氫化幾乎相同,只是我們使用的是鹵素。這也解釋了為什麼溴試劑有效,因為溴水中溴原子會發生反應形成新化合物,而它們不會與烷烴反應。
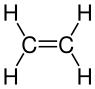
醇是具有羥基官能團(-OH)的飽和烴同系物。當烯烴與水反應(需要催化劑的存在)時,我們可以形成醇。例如:
我們可以很容易地算出醇的化學式,因為我們知道末端的官能團(必須存在-OH),並且所有碳和氫必須平衡。產物稱為丁醇,其中“-醇”表示它是醇。上面顯示了結構式:與烷烴結構相比,醇結構唯一的區別是氧原子,正如我們所見。
有時,醇的寫法略有不同,以反映其結構。例如
 是乙醇的化學式,也可以寫成
是乙醇的化學式,也可以寫成  。
。 指的是化合物的其中一端,
指的是化合物的其中一端, 指的是中間的碳鏈,而
指的是中間的碳鏈,而 表示官能團。醇的一般式為
表示官能團。醇的一般式為

所有醇類都可溶於水,其溶液呈中性 pH 值。由於其溶解性,它們常被用作工業溶劑。較小的醇類也被用作燃料,例如乙醇被用作酒精燈燃料。然而,它(乙醇)最常見的用途是在酒精飲料中。
醇類是易燃的,在空氣中燃燒時會發生完全燃燒



醇類可以被氧化(新增氧氣)形成羧酸,這些反應發生在與燃燒不同的條件下。
當糖溶液在酵母酶的作用下發酵時,會產生乙醇的水溶液。
![{\displaystyle {\ce {C6H12O6 ->[yeast] 2C2H5OH + 2CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9523e86482fc03cf80f0892d303b94d66ece4598)
這表明葡萄糖,一種簡單的糖,被轉化為乙醇和二氧化碳。該反應需要厭氧(無氧)條件,相當高的溫度(37 攝氏度)和略微酸性的 pH 值。
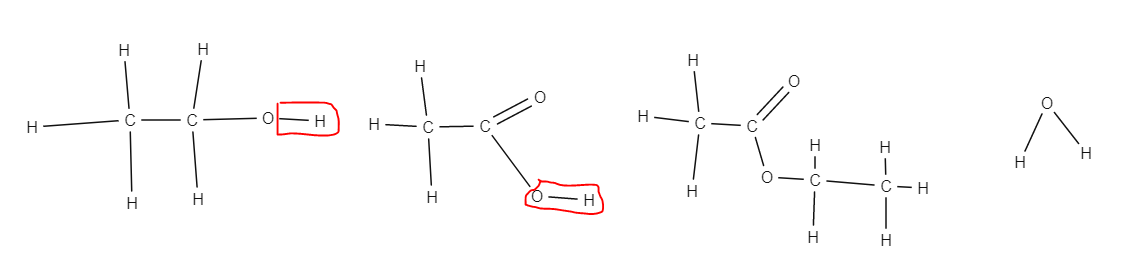
羧酸具有  的官能團,其名稱以“-酸”結尾。它們的結構圖類似於醇類,不過添加了一個碳氧雙鍵。以下是丁醇和丁酸的比較
的官能團,其名稱以“-酸”結尾。它們的結構圖類似於醇類,不過添加了一個碳氧雙鍵。以下是丁醇和丁酸的比較
正如我們所看到的,2 個氫原子被移除並被一個氧雙鍵取代。羧酸的一般式為

重要的是要注意,對於第 n 項,我們使用不包含在官能團中的碳原子,因此,雖然丁酸有 4 個碳原子,但它有 3 個碳原子不屬於官能團,從而得到以下公式

另一種寫法是

像任何其他酸一樣,羧酸與碳酸鹽反應生成鹽、水和二氧化碳
羧酸能夠溶於水。但是,當它們溶解時,它們會電離,釋放 H+ 離子,從而形成弱酸性溶液,因為它們不會完全電離。
羧酸與酸性催化劑反應生成酯(一種新的同系物)和水。


從化學方程式中可以看出,酯在一端具有相同的  ,以及
,以及  ,就像羧酸一樣。但是,氫被移除並被醇的烴鏈
,就像羧酸一樣。但是,氫被移除並被醇的烴鏈  取代。因此,酯被稱為乙酸乙酯(醇是 -yl,羧酸是 -anoate)並不奇怪。但是,繪製酯可能會很棘手
取代。因此,酯被稱為乙酸乙酯(醇是 -yl,羧酸是 -anoate)並不奇怪。但是,繪製酯可能會很棘手
繪製酯的最簡單方法是首先繪製沒有 OH 的羧酸。然後,您將醇新增到與碳連線的碳上,並完成醇的結構,除了氫。這些原子結合產生由反應生成的的水。
| 能量的定義是什麼?
|
| 系統(物體或物體組)可能發生的能量變化的最大值 |
| 能量儲存的兩種主要型別是什麼?它們之間有什麼區別?
|
| 與運動相關的能量儲存(動能)和與物體在空間中的位置相關的勢能儲存。 |
| 比熱容是什麼?
|
| 使 1 公斤物質升溫 1 攝氏度所需的能量。 |
 +
+ 
 + Br—Br →
+ Br—Br → 
 +
+ 


















![{\displaystyle {\ce {C6H12O6 ->[yeast] 2C2H5OH + 2CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9523e86482fc03cf80f0892d303b94d66ece4598)










