A-level 應用科學/顏色化學/顏色
有色化學物質吸收光譜可見部分的電磁波。吸收的能量
導致分子電子能量的變化。電子從“基態”
變為“激發態”。
大多數躍遷不是由可見光引起的。許多吸收紫外線
輻射。吸收紫外線輻射的化學物質是無色的(除非它們發出熒光)。
有色化合物和無色化合物的分子在能量變化方面如下圖所示
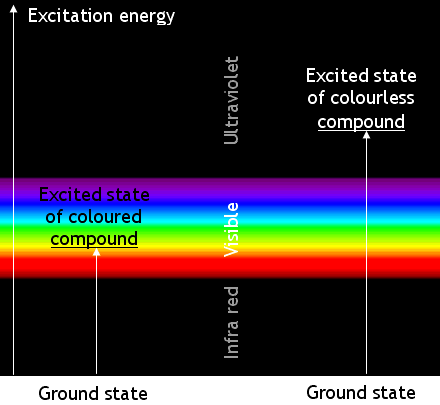
請記住,表觀顏色是由吸收互補色光子引起的。A
藍色化合物是藍色的,因為它吸收黃光。

具有與可見光相對應的激發態的化學結構稱為
生色團。主要有兩種型別
1. 過渡金屬配合物。
過渡金屬形成複雜離子——金屬與小分子結合
或稱為配體的陰離子。配體使金屬離子的電子進入激發態
如果電子吸收可見光光子。
例如四氯合銅(II)離子和六水合銅(II)離子
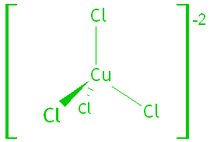
過渡金屬化合物的部分填充的 d 軌道在賦予顏色方面很重要
過渡金屬配合物。見圖(可以表示 V+2,Cr+3,
Mn+4 等)

①. 在未絡合的離子中,所有 d 軌道具有相同的能量。
②. 當配體包圍離子時,配體的負電荷使 d 軌道
不穩定(能量更高)。
③. 關鍵是,配體將比其他配體更靠近某些 d 軌道。通常,
兩個或三個軌道比其餘軌道更不穩定。
一個處於較低 d 軌道的電子可以獲得能量激發到較高
d 軌道

這種機制使過渡金屬配合物能夠吸收可見光光子。
2. 共軛/離域電子體系。
當單鍵和雙鍵交替出現時,雙鍵中的電子可以進入激發態
如果它們吸收可見光光子。例如 β-胡蘿蔔素(上圖)有十個共軛 C=C 鍵
上圖顯示了共軛醛的激發能。n 是 C=C 的數量
共軛的雙鍵。最簡單的(n=1)是 CH3-CH=CH-CH=O。
注意,激發能隨著共軛鍵數的增加而降低。
| n | 波長(nm) | 能量 (kJ mol−1) |
| 1 | 220 | 544 |
| 2 | 270 | 443 |
| 3 | 312 | 384 |
| 4 | 343 | 349 |
| 5 | 370 | 324 |
| 6 | 393 | 305 |
| 7 | 415 | 289 |
染料分子的生色團通常包含 >C=O 和 -N=N- 等不飽和基團,它們是
共軛鍵體系的一部分,通常涉及芳香環。金黃色素,一種
鹼性染料,如下所示

注意 -N=N- 基團只是共軛體系的中心,該體系延伸到所有
十二個碳原子,包括七個雙鍵。所有
偶氮染料都包含 -N=N- 排列。
助色團:連線到生色團的是兩個 -NH2 基團,它們與
生色團相互作用以改變橙色。連線到生色團的一組原子,
修改該生色團吸收光的能力稱為助色團。它們可以修改
或增強染料的顏色。示例:-OH,- NH2,醛。
新增的官能團也可以
- 改變染料在水或其他溶劑中的溶解度。
- 將染料分子結合到布料、紙張或其他基材上。

- ↑ Streitwieser, A & Heathcock, CH (1985) 有機化學導論(第 3 版)第 628 頁,Macmillan,紐約



