A-level 應用科學/物質探究/燃燒
甲烷燃燒生成二氧化碳和水的示意圖。
計算反應焓變的一種簡單方法是測量反應引起的溫度變化。溫度下降,ΔT 取決於
- ΔH,反應的焓變。
- m,發生溫度變化的樣品的質量。
- cp,發生溫度變化的物質的熱容。
熱容衡量改變 1 g 物質的溫度 1 oC 所需的能量。
ΔH = m cp ΔT
這將給出反應釋放的能量,即 kJ。要計算摩爾焓變,kJ mol−1,我們必須除以反應中使用的摩爾數。
考慮斷開分子中特定鍵時發生的反應所伴隨的焓變:例如,在甲烷分子中,有四個碳 - 氫鍵,每個鍵可以依次斷裂。每個階段所需的能量都不同,因為 C-H 鍵處於不同的分子物種中,即不同的原子環境。
- CH4(g) → CH3(g) + H(g) ΔH = 435 kJ mol-1
- CH3(g) → CH2(g) + H(g) ΔH = 444 kJ mol-1
- CH2(g) → CH(g) + H(g) ΔH = 440 kJ mol-1
- CH(g) → C(g) + H(g) ΔH = 343 kJ mol-1
由於鍵焓定義為斷開鍵所需的焓變,所有值都將為正。
現在,C-H 鍵焓在特定分子中會略有不同,例如甲烷、乙烷、苯、乙醇等。但是,這些差異並不大,我們可以使用鍵能項來進行有用的預測。
平均鍵焓是在各種“代表性”分子中測量的特定鍵的鍵焓的平均值。它也稱為鍵能項。(見下表)。
| 鍵型別 | 能量 | 鍵型別 | 能量 | 鍵型別 | 能量 | 鍵型別 | 能量 | 鍵型別 | 能量 |
| H–H | 436 | D–D | 442 | C–C | 348 | C=C | 612 | C≡C | 837 |
| C–C(苯) | 518 | Si–Si | 226 | Ge–Ge | 188 | Sn–Sn | 151 | N–N | 163 |
| N=N | 409 | N≡N | 944 | P–P | 172 | O–O | 146 | O=O | 496 |
| S–S | 264 | F–F | 158 | Cl–Cl | 242 | Br–Br | 193 | I–I | 151 |
| C–H | 412 | Si–H | 318 | N–H | 388 | P–H | 322 | O–H | 463 |
| S–H | 338 | F–H | 562 | Cl–H | 431 | Br–H | 366 | I–H | 299 |
| C–O | 360 | C=O | 743 | C–N | 305 | C=N | 613 | C≡N | 890 |
| C–F | 484 | C–Cl | 338 | C–Br | 276 | C–I | 238 | Si–O | 374 |
為了根據鍵焓估計反應焓:i) 將斷裂反應物中所有鍵所需的能量加起來。這是一個吸熱過程。ii) 減去生成物鍵形成時釋放的能量。鍵形成是放熱的。
例如 2 H2 (g) + O2 (g) → 2 H2O (l)
- 斷裂 2 個 H-H 鍵和 1 個 O=O 鍵
- 2 x 436 + 496 = + 1368 kJ mol−1
- 形成 4 個 O-H 鍵
- 4 x –463 = -1858 kJ mol−1
將這兩個過程加起來:1368-1858 = -490 kJ mol−1
這是對兩摩爾水的形成焓的良好估計。水的實驗形成焓為 –285.9 kJ mol−1,即兩摩爾水的形成焓為 -571.8 kJ mol−1。
- 估計過氧化氫的形成焓。O-O 鍵能為 146 kJ mol−1。
HI 形成的鍵焓如下
- H-H 436 kJ mol-1
- I-I 151 kJ mol-1
- H-I 299 kJ mol-1
H2 + I2 → 2 HI
- 斷裂鍵:436 + 151 = 587 kJ mol−1
- 形成鍵:-2 x 299 = 598 kJ mol−1
- 根據這個計算,該反應的總焓變為 –11 kJ mol−1。這與實驗值 +26.5 kJ mol−1 相吻合(由於反應中生成了 2 摩爾 HI,因此該值必須乘以 2)。在實驗值中還包括昇華能:I2(g) -> I2(v) -63 kJmol−1。考慮到這一點,將顯示計算值與實驗值之間的差異很小。但預計會存在幾十 kJ mol−1 的誤差,因為鍵焓是平均值。
一個鍵由兩個分子組成,例如碳或氫,整個反應的焓變為 11。
1. (i) 使用平均鍵焓值,計算下列反應的焓變值。[5]
CH3OH + HBr → CH3Br + H2O
(ii) 實驗測定了該反應的值。發現它與你在 (i) 中計算的值存在顯著差異。顯著差異是指差異大於實驗誤差(精度/容差)。提出導致這種情況的兩個不同原因。[2] (iii) 你認為哪個值是正確的 - (i) 中計算的值還是 (ii) 中給出的值?[1] 2. 丙烷 C3H8 的燃燒:(i)描述該反應過程中發生的鍵合變化。[4] (ii) 寫出該反應的平衡方程式,並使用以下鍵焓計算焓變。[6]
燃燒反應一直是人類歷史上熱量和光源。火也用於戰爭,清理森林地區,冶金和作為煙霧來源。自從工業革命以來,燃燒反應也被用於為機器和車輛提供動力。電力是透過燃燒天然氣、石油和煤炭等燃料產生的。[1]
在高爐反應中,燃燒會產生一氧化碳和熱量。CO 是還原劑,它將鐵礦石轉化為鐵。[2]
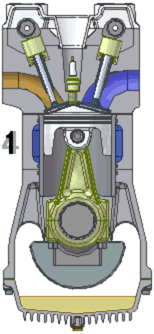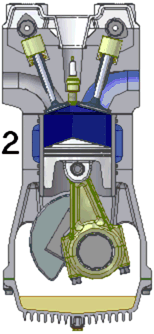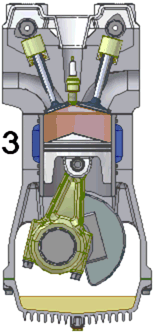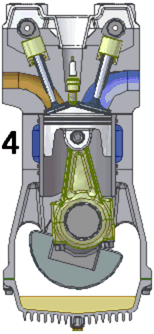
四衝程汽油發動機的動畫。1. 進氣 2. 壓縮 3. 點火/膨脹 4. 排氣
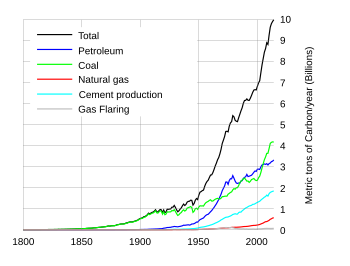
1800-2004 年期間,按各種燃料型別劃分的二氧化碳排放量年度變化。顯示了消耗化石燃料的速度不斷增加。