A-level 應用科學/合成有機化合物/實踐
| 在嘗試本頁中的任何內容之前,請閱讀華夏公益教科書:風險免責宣告。本頁中的部分資訊可能不正確、未經驗證且存在危險。華夏公益教科書、WMF 和貢獻者 對本頁內容不承擔任何責任。 |
此處提供的實驗細節是出於善意,並且被認為是安全且可行的。但是,作者對執行這些實驗的後果不承擔任何責任。
這些實驗是為經驗豐富的科學教學人員編寫的,作為受監督的學生班級的指導。這些實驗不是為沒有監督的學生或公眾中沒有經驗的人設計的。如果您想嘗試這些實驗,請確保您事先完成了法律上充分的風險評估,並且在風險評估的限制範圍內工作。
您的作品集要求您提供兩份實踐報告。一份是固體,另一份是液體。這兩種化合物應使用不同的反應制備。以下四種製備方法涵蓋了這些標準,並且旨在使前兩種製備方法提供經驗,這些經驗將幫助您熟練地完成最後兩種實驗。
| 氧化 | 縮合 | |
| 固體 | 苯甲酸 | 阿司匹林 |
| 液體 | 乙醛 | 乙酸乙酯 |
如何使用此模板:文字包含提示、清單和建議。根據提示,用您自己的實驗說明替換此文字。
解釋這份報告的主題,以及您是如何在報告中包含有關有機化合物和一般反應的資訊,以及對紅外光譜的討論。
涉及的有機化合物
- 命名
- 結構
- 元素的電負性和分子的極性。
- 官能團
- 物理性質,如沸點/熔點、在水中的溶解度、健康和安全資料。
- 形狀
- 反應型別 - 對反應型別進行分類
- 給出平衡方程式,並描述反應所需的試劑和條件。
- 光譜 - 光譜告訴我們有關分子哪些資訊。
詳細說明有機反應物和產物的結構和性質(如熔點/沸點、紅外光譜)。
包括透過研究發現的方法的副本。
註解描述方法的主要特徵 - 正在進行哪些型別的反應?淨化方法是如何工作的?
根據文獻方法和可用資源,建議一種方法。
包括您程式的風險評估。
計算預期產物的最大產率。
討論如何使用光譜來評估程式(例如,反應物汙染產物)。
您的老師將必須寫一份宣告,評估您執行製備的安全性和熟練程度。
應記錄完整的觀察結果和大量資料,並且測量值應儘可能精確。
資料應清晰、邏輯地呈現 - 如果合適,請考慮使用表格、圖表和圖形。
根據產物的質量,計算產率。
根據產物的熔點/沸點,推斷其純度。
總結您的工作的主要要點。
提出建議,以改進實驗以獲得更多/更純的產物。
包括您所使用過的每個資訊來源的參考資料。
在使用來自該來源的資訊時,請記下該來源(例如,在光譜出現在您的報告中的位置旁邊簡要顯示光譜的來源,然後在參考文獻中完整地引用該來源)。
乙醇可以在酸性溶液中被重鉻酸根(VI)離子氧化。氧化反應的第一個產物是乙醛,它可以被進一步氧化形成乙酸。透過小心地改變反應方法,可以得到其中的一種或另一種產物。
乙醛的製備應在通風櫥中進行。
- 重鉻酸鈉 (VI)
- 乙醇
- 乙醛(產物)
- 濃硫酸
- 防暴沸顆粒
- 去離子水
佩戴護目鏡和實驗服。
製備乙醛時,在通風櫥中操作。
取用濃硫酸時,戴手套。
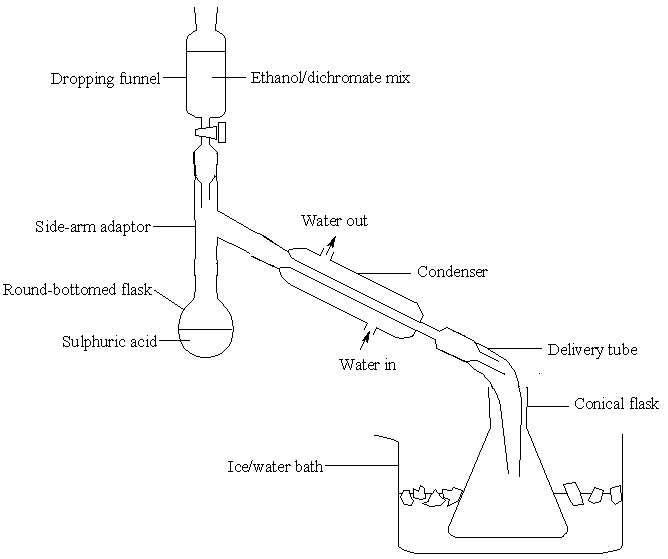
在圓底燒瓶中,先加入 50 cm³ 去離子水,然後緩慢加入 17 cm³ 濃硫酸,邊加邊搖動。最後,在燒瓶中加入一些防暴沸顆粒,並按如下所示裝置設定裝置。
冷凝管周圍應有快速的水流。如果你不確定,請向你的講師諮詢如何調節水流 - 在橡膠管中很容易產生過大的壓力。將 50 g 重鉻酸鈉 (VI) 溶解在 50 cm³ 去離子水中,然後加入 40 cm³ 乙醇。充分混合,將混合物加入上述裝置中的滴液漏斗中。確保滴液漏斗的活塞先關閉。
加熱燒瓶中的酸,直到它輕輕地沸騰,然後關閉熱源。
緩慢加入乙醇/重鉻酸鹽混合物:用 20 分鐘時間加入整個樣品。反應劇烈,一開始會使混合物沸騰。在反應的後期階段,你需要加熱混合物以保持它輕輕沸騰。
當反應在圓底燒瓶中進行時,乙醛溶液將在錐形瓶中收集。
小心地注意其特徵氣味。塞住錐形瓶,並將其儲存在冰水中。如果有時間,取樣並使用銀鏡、2,4-DNPH 或碘仿測試進行測試。
2-羥基苯甲酸(“水楊酸”)與乙酸及其衍生物反應生成 2-乙醯氧基苯甲酸(“阿司匹林”)。
- 圓底“快速連線”燒瓶
- 真空過濾裝置
- 迴流冷凝器
- 冰浴
- 燒杯,100 cm³
- 加熱套
- 天平
- 表面皿
- 2.0 g 2-羥基苯甲酸(“水楊酸”)
- 3.0 cm³ 乙酸酐
- 85% 磷酸 (V) 5 滴
- 始終佩戴護目鏡和實驗服。
- 使用本生燈時,將長髮紮起來。
- 稱取約 2.0 g(準確稱量)2-羥基苯甲酸(“水楊酸”),加入圓底“快速連線”燒瓶中。
- 小心地向燒瓶中加入 3.0 cm³ 乙酸酐。
- 再次小心地加入 85% 磷酸 (V) 5 滴,輕輕旋轉以混合燒瓶內容物。
- 使用加熱套,將混合物輕輕迴流 5 分鐘。
- 5 分鐘後,立即小心地將 2.0 cm³ 水沿著垂直冷凝管加入。注意:這將產生劇烈反應。
- 反應結束後,小心地將燒瓶內容物倒入一個小燒杯中 40 cm³ 冷水中。
- 讓燒杯內容物冷卻,如果結晶沒有立即發生,用玻璃棒刮擦燒杯的內壁。
- 結晶開始後,將燒杯及其內容物放在冰浴中冷卻。
- 使用抽濾(真空)過濾固體產物,並用少量冷水洗滌固體。
- 從少量熱水中重結晶產物,按上述方法過濾和洗滌。
- 將材料在空氣中乾燥,將其刮到一個預先稱重的表面皿上,並測定產物的質量。
- 測定產率。
- 進行熔點測定。
- 發生了什麼型別的反應?形成了什麼型別的鍵?
- 磷酸的作用是什麼?
- 乙酸酐和乙酸之間的關係是什麼?
- 查詢並寫一個簡短的關於阿司匹林如何製造的說明。2-羥基苯甲酸是如何製成的?
- 快速連線:圓底燒瓶(2x100 cm³)
- 冷凝器
- 接收器介面卡
- 滴液漏斗
- 蒸餾頭
- 溫度計套管
- 4x 防暴沸顆粒
- 錐形瓶(50 cm³)和橡膠塞
- 量筒(10,100 cm³)
- 溫度計(110oC)
- 漏斗和摺疊濾紙
- 加熱套
- 稱量秤
- 碳酸鈉 12.2cm3(30% 溶液)
- 氯化鈣(顆粒狀)12.5cm3
- 硫酸(濃)5cm3
- 乙酸(濃)25cm3
- 乙醇 25cm3
- 乙酸乙酯(產物)
1. 在一個圓底燒瓶中,加入乙醇 (25 cm³) 和冰乙酸 (25 cm³)。緩慢加入濃硫酸 (5 cm³),邊加邊冷卻和搖動。確保每次新增後混合物均質。加入一些防暴沸顆粒,並將混合物在迴流狀態下煮沸約 10 分鐘。
2. 重新排列裝置,蒸餾掉約三分之二的混合物。將餾出液轉移到分液漏斗中。
3. 加入碳酸鈉溶液 (25 cm³) 並小心搖動。(參見問題 2)。
4. 定期倒置漏斗並開啟活塞以釋放壓力。讓液體沉澱並分離兩層。丟棄水層(問題 3 - 確保保留正確的層!)。
5. 向漏斗中的有機層中加入氯化鈣溶液(12.5 g 無水 CaCl2 在 12.5 cm³ 水中)並劇烈搖動(問題 4)。讓液體分離並流出,丟棄下層水層。將乙酸乙酯流入一個小錐形瓶中,並加入少量顆粒狀氯化鈣。靜置約 10-20 分鐘,偶爾搖動(問題 5)。
6. 將液體透過摺疊濾紙過濾到燒瓶 (100 cm³) 中,加入一些防暴沸顆粒,並安裝蒸餾裝置。
7. 丟棄在 35-40oC 範圍內蒸餾出的餾分(問題 6)。
8. 收集在 74 - 79 oC 範圍內蒸餾出的餾分。
9. 記錄最終產物的顏色和氣味。
- 為什麼要將混合物煮沸,為什麼要在迴流狀態下煮沸?
- 說明加入碳酸鈉時觀察到的現象,並解釋為什麼使用它。
- 你如何判斷哪一層是水層?
- 氯化鈣在此階段的作用是什麼?
- 氯化鈣在此階段的作用是什麼?
- 在該溫度範圍內可能會蒸餾出什麼?
- 記錄你的產率並計算你的產率百分比。
氧化反應是有機化學中非常重要的一類反應。大多數氧化反應需要處於還原狀態的雜原子(O in -OH、N in -NH2 等)或碳-碳 π 鍵。
芳香環側鏈的氧化不需要這些因素。只需要一個苄基碳,該碳至少與一個氫原子相連。可用於氧化的試劑有重鉻酸(在硫酸和水中使用 Na2Cr2O7 或 CrO3)或高錳酸鉀 (KMnO4)。每種情況下產物都是苯甲酸或苯甲酸衍生物。高錳酸鉀反應需要用酸進行後處理,因為高錳酸鉀反應會生成鹼性溶液作為副產物)。
- C6H5CH3 + 2 KMnO4 → C6H5COOK + 2 MnO2 + H2O + KOH
我們將使用高錳酸鉀將甲苯 (甲苯) 氧化成苯甲酸。與含鉻化合物相比,高錳酸鉀溶液危害較小,鉻化合物通常具有致癌性。[2]
- 高錳酸鉀 (高錳酸鹽) 是一種強氧化劑,具有腐蝕性,操作時請戴手套(它也會染汙皮膚和衣物)。
- 亞硫酸氫鈉 (亞硫酸氫鈉) 是一種刺激物——操作時請戴手套。
- 濃鹽酸具有腐蝕性和毒性——操作時請戴手套,並確保在操作後清洗手套和雙手。
- 甲苯 (甲苯) 是一種易燃液體,有毒,其蒸氣具有麻醉性——實驗室不允許明火,操作時請戴手套,避免吸入其蒸氣。[2]
[2] 第一天:製備苯甲酸。
在 100 cm³ 圓底燒瓶中(這樣液體量將不到反應容器容量的一半),混合以下物質:
- 3.0 g KMnO4(注意不要接觸皮膚)
- 約 0.7 g 甲苯(約 0.8 cm³ 液體)
- 35 g(cm³)水。
將反應混合物迴流(新增一些防爆沸顆粒)最多 4 小時。
迴流時間少於此時間可能會導致高錳酸鹽 (VII) 殘留。由於甲苯的揮發性,需要對迴流冷凝器進行有效的冷卻。
- C6H5CH3 + 2 KMnO4 → C6H5OOK + 2 MnO2 + H2O + KOH [3]
停止,並將您的儀器留至下一節實驗課,以便進行純化。
第二天:分離苯甲酸
使用布氏漏斗進行抽濾(過濾熱的溶液,但不要用冷水或熱水洗滌)。收集濾液(透過濾紙的液體)。
不溶性的 MnO2 將被濾紙保留,而濾液被收集在抽濾瓶中。可以將其丟棄。
如果濾液仍然呈紫色(表明仍然存在 MnO4- 離子),將濾液轉移到一個新的燒瓶中,如果仍然很熱,則在冰浴中冷卻。
緩慢加入少量固體亞硫酸氫鈉 (NaHSO3) 以還原任何剩餘的高錳酸鹽離子。
小心操作,因為亞硫酸氫鈉與高錳酸鉀的反應是強放熱的(釋放熱量)。
當不再出現紫色時(混合物將呈棕色懸浮液),表示您已添加了足夠的亞硫酸氫鈉。
當紫色不再出現時,將懸浮液在 3-4000 rpm 下離心 5 分鐘。(在這個階段形成的 MnO2 太細,無法有效過濾)。離心會使沉澱形成沉澱物,其餘的溶液可以小心地傾倒。
如果溶液不是無色的(仍然呈紫色),則需要新增更多亞硫酸氫鈉,並重復離心,以生成澄清溶液(輕微的棕色色調是可以接受的,但不能是紫色)。
將澄清無色的溶液(輕微的棕色色調是可以接受的)放入冰浴中。加入約 2.5 cm³ 濃鹽酸使混合物酸化。逐滴新增酸,直到形成白色苯甲酸沉澱。(如果沒有新增足夠的酸,它可能會重新溶解)。只需 4-5 滴就足以使溶液酸化,並啟動固體材料的形成。新增更多酸不會影響您的結果,因為您無法新增過量的酸。
- C6H5COOK + KOH + 2 HCl → C6H5COOH + H2O + 2 KCl [3]
使用真空過濾和布氏漏斗收集沉澱的有機產物。您可以在乾燥前使用少量冷水洗滌固體材料並將固體從結晶容器中取出,放在表面皿上。
固體產物將被儲存在乾燥箱中,直到下一節實驗課進行重結晶。
停止,並將您的固體材料儲存在乾燥箱中,直到下一節實驗課進行純化。如果您在本節實驗課中無法生成固體材料,您可以將樣品儲存到下一節實驗課。
第三天:重結晶和苯甲酸分析
純化方法包括重結晶。有必要選擇一種合適的溶劑,在該溶劑中
- 苯甲酸在高溫下非常易溶,但在低溫下難溶,並且...
- 雜質在任何溫度下都不溶,或者....
- 雜質在任何溫度下都可溶
滿足本實驗這些標準的溶劑是水。
這是一個如何記錄工作的示例。重複此實驗——或者如果你覺得能夠改進,就改進它。請注意,並非所有資料都是為您記錄的(例如,使用的熱水量)。
苯甲酸收集在一個燒杯中(250 cm³)。
向燒杯中倒入少量水,並將混合物在本生燈上加熱至沸騰。攪拌混合物以促進溶解。
並非所有的苯甲酸都溶解。加入更多水,保持混合物攪拌並微沸。重複此過程,直到所有苯甲酸似乎都溶解。
然後將混合物快速透過預熱的布氏漏斗過濾。任何不溶性雜質將作為殘留物留在濾紙上。
將濾液在冰浴中冷卻,這會導致大部分苯甲酸結晶。可溶性雜質留在溶液中。
將混合物再次在泵上過濾,這次在冷的情況下進行。濾紙上的殘留物是純化的苯甲酸。
透過在殘留物上澆少量去離子水以去除鹽溶液來洗滌該殘留物。在過濾後執行泵一小段時間,有助於乾燥殘留物。
然後小心地將殘留物從濾紙上刮到表面皿上,並在 60 oC 的烘箱中乾燥。乾燥後,稱量最終產品。
結果
苯甲酸的起始質量為 4.00 g
苯甲酸產品的質量為 3.50 g
透過確定熔點來分析苯甲酸。將您觀察到的值與文獻值進行比較。根據限制性試劑(甲苯)確定百分比產率。
顯示甲苯中甲基碳、酸的羰基碳以及高錳酸根離子中的 Mn 和 MnO2 中的 Mn 的氧化態。
您可能希望記錄實驗的其他細節,這些細節不自然地屬於任何其他類別,例如可能發生的錯誤;一些對您來說是新理論的理論;您可能希望記錄以供將來參考的一些有趣的應用或細節等。