A-level 化學/AQA/模組 1/原子結構
希臘哲學家德謨克利特認為,所有物質都是由小的不可分割的粒子組成的,他稱之為原子。原子這個詞來源於希臘語 a,意思是“不”或“沒有”,以及 tom,意思是“切割”。因此,原子這個詞的意思是:不可切割。他理論化,如果一個人把一塊乳酪切成兩半,然後再次切成兩半,再切成兩半,等等,那麼最終就會得到一塊無法再分割的乳酪。這就是他的單個原子。
我們現在知道,原子是物質的最小部分,它保持自身的特性,儘管原子本身可以被細分。換句話說,一旦我們開始觀察原子的內部,我們就不再能確定這個原子屬於哪種元素。
原子本身包含一箇中心的原子核,大部分質量集中在這裡,電子圍繞著這個原子核的外部執行。這個中心的原子核由質子和中子組成。這三種粒子的性質如下表所示。
| 粒子 | 相對電荷 | 相對質量 | 絕對電荷 | 絕對質量 |
|---|---|---|---|---|
| 質子 | +1 | 1 | ||
| 中子 | 0 | 1 | 0 | |
| 電子 | -1 | 0(可忽略,或約為 ) |
在中性原子或元素原子中,質子和電子的數量相等。這使得原子沒有淨電荷。
我們可以從原子的原子核中獲得兩條有用的資訊。第一個是原子序數。這使我們能夠識別原子是哪種元素。原子序數通常用字母 Z 表示,是原子核中質子的數量。正是它將元素放在元素週期表中。
第二個是質量數。它等於質子的數量加上中子的數量(記住,電子的質量可以忽略不計)。它用符號 A 表示。因此,原子中中子的數量等於質量數(A)減去原子序數(Z)。
有時,原子的質子數表明它是一種特定元素,但它的質量數與該元素的其他原子不同。具有相同質子數但質量數不同的原子被稱為該元素的同位素。質量數的差異是由原子核中存在額外或更少的中子造成的。
由於質子(因此電子)的數量相同,這些物質的化學性質與標準元素的化學性質相同。物理性質(熔點/沸點等)確實會發生變化。
我們通常用元素名稱後跟質量數來指代同位素。例如,質量數為 12(6 個質子和 6 箇中子)的碳原子被稱為碳-12。它用以下方式表示:
碳-14 是最有用的同位素之一。它是原子。它是放射性的,可以用來確定有機物質的年代,可以追溯到 60,000 年前!其他同位素在醫學上用作示蹤劑,以確定體內任何阻塞的位置。
質譜法是一種用來確定樣品中各種同位素的相對丰度的技術。它可以分為四個階段。
1. **汽化和電離** 將待分析的樣品引入真空室。樣品被汽化。如果接下來的步驟要成功,這一點至關重要。真空非常重要,因為要發射到樣品上的電子必須有一個“暢通無阻”的路徑。如果不在真空狀態下,它們就會與空氣分子發生碰撞。
現在對樣品進行電離。為此,使用電子槍。本質上,它是一種向樣品發射高能電子的裝置。這些電子將樣品中的電子撞出軌道,使其電離。樣品中的粒子現在帶正電,如下所示。
這兩個方程展示了第一次電離階段。然而,離子也有可能被第二個電子電離。這不太可能,因為第二次電離比第一次電離高得多,不太可能達到。這個罕見的事件由這個方程表示
2. **加速**
由於相反的電荷相互吸引,我們可以使用電場來移動粒子。這些粒子帶正電(電子已被移除),因此我們使用帶負電的電極板來加速粒子穿過機器。
3. **偏轉**
我們現在使用電磁鐵來偏轉粒子。當粒子加速穿過磁場時,它們會改變方向。質荷比(m/z)大的粒子偏轉量小,而質荷比小的粒子偏轉量大。這將不同質荷比的離子分離。
4. **檢測**
樣品中的各種物質現在已經分離。粒子加速進入檢測板。由於它們帶電,在撞擊檢測板時會產生微弱的電流。記錄下這種電流。檢測時磁場的相對強度可以用來計算檢測到的離子的 m/z 值。這使我們能夠確定樣品的組成離子。然而,無法區分具有相同 m/z 值的離子,因為它們將被相同地偏轉!
此頁面提供有關質譜的更多資訊:http://www.chemguide.co.uk/analysis/masspec/howitworks.html#top.
相對質量
[edit | edit source]以下兩個定義需要在模組一中學習,儘管它們一開始可能看起來很深奧。
相對原子質量 ()
[edit | edit source]
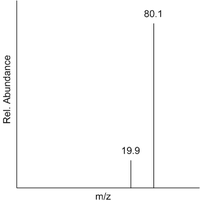
這可以透過將每個峰的 m/z 值乘以其相對丰度來從樣品的質譜中計算出來。然後將此總和除以總相對丰度。以下是硼的質譜示例,其中兩個峰分別代表 和 。
這也可以從表格中的資料計算出來,如鉛的例子所示。
| m/z | 相對丰度 |
|---|---|
| 204 | 1.55 |
| 206 | 23.6 |
| 207 | 22.6 |
| 208 | 52.3 |
(這裡需要注意的是,相對丰度加起來是 100.05,而不是 100。)
相對分子質量 ()
[edit | edit source]
這可以透過從質譜中獲取最右側峰的 m/z 值來計算,例如,氨的例子如下所示。
電子構型
[edit | edit source]在 GCSE 水平上,電子被呈現為圍繞原子核執行的點狀實體,第一個軌道可以容納兩個電子,第二個可以容納八個電子,第三個可以容納十八個電子。我們現在知道這並不完全準確,在 A 級需要一個更復雜的模型。
我們認為電子軌道位於主能級內的亞能級。每個亞能級能夠容納一個形狀的軌道,用字母 s、p、d 和 f 表示。亞能級本身通常用它們可以容納的軌道型別的字母來表示。例如,你不會說第四主能級的第三個亞能級,而是會說第四能級的 d 亞能級。
在下表中,你可以看到第三主能級的第三個亞能級 (d) 可以包含 5 個 d 型軌道。由於每個軌道最多可以容納 2 個電子,這意味著這個亞能級可以容納 10 個電子。
| 主能級 | 亞能級 | 電子 |
|---|---|---|
| n=1 | → 1 個 s 型軌道 | 2 |
| 能級中的最大電子數 | 2 | |
| n=2 | → 1 個 s 型軌道 | 2 |
| → 3 個 p 型軌道 | 6 | |
| 能級中的最大電子數 | 8 | |
| n=3 | → 1 個 s 型軌道 | 2 |
| → 3 個 p 型軌道 | 6 | |
| → 5 個 d 型軌道 | 10 | |
| 能級中的最大電子數 | 18 | |
| n=4 | → 1 個 s 型軌道 | 2 |
| → 3 個 p 型軌道 | 6 | |
| → 5 個 d 型軌道 | 10 | |
| → 7 個 f 型軌道 | 14 | |
| 能級中的最大電子數 | 32 | |
如表所示,每種型別的亞能級中的最大軌道數與其型別有關。一個 “s” 亞能級只能包含一個軌道 (2 個電子),一個 “p” 亞能級最多可以包含 3 個軌道 (6 個電子);一個 “d” 最多可以包含 5 個軌道 (10 個電子);一個 “f” 最多可以包含 7 個 (14 個電子)。
每個主能級的容量是其亞能級容量的總和。你可以看到,主能級的容量等同於 GCSE 電子殼層模型的更簡單模型。
有一些規則需要了解這些軌道的填充方式。
- 軌道按表格的順序從上到下填充。這是按能量升序排列的;也就是說,每個連續的能級(表格中越往下)比前一個能級具有更高的能量。
- 每個軌道必須在電子被放入下一個軌道之前被填滿。例如,一個原子必須 *始終* 在其 1s 亞能級中有兩個電子,然後才能將任何電子放入 2s 軌道。
對於 AQA A 級化學,你需要能夠填充到 4s 能級的能級圖。