A-level 化學/OCR (Salters)/分子幾何
外觀
分子的形狀 是 化學理念 中第 3.3 節的標題,它涵蓋了分子幾何結構 的主題。
-
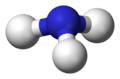
點交叉圖 -
鍵線圖 -
球棍模型
-
點交叉圖 -
鍵線圖 -
顯示孤對電子的球棍模型 -
不顯示孤對電子的球棍模型
-
點交叉圖 -
鍵線圖 -
顯示孤對電子的球棍模型 -
不顯示孤對電子的球棍模型
-
點交叉圖 -
鍵線圖 -
顯示孤對電子的球棍模型 -
不顯示孤對電子的球棍模型
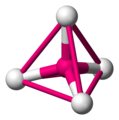
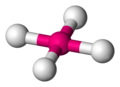
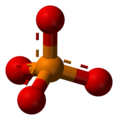
你可能之前在數學中遇到過四面體,儘管你很可能稱它們為三角形基金字塔。四面體有四個頂點(角)、四個面和六條邊。每個面都是一個等邊三角形。
四面體是化學中最重要的形狀之一,因為許多分子都包含它們。四面體分子實際上不包含小金字塔。它們包含的是一箇中心原子與四個其他原子鍵合。圍繞中心原子的四個原子佔據的位置可以想象成四面體的頂點。
在下面的圖片庫中,中心原子用品紅色著色,周圍原子用白色著色。
-
一個四面體分子 -
要看到四面體,用直線連線周圍原子 -
這些直線形成了四面體的邊 -
四面體角≈ 109.5° -
化學家使用虛線和楔形鍵來表示四面體 -
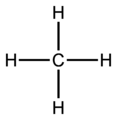
這就是化學家如何表示甲烷 -
這種“扁平”表示 - GCSE 風格 - 更簡單,但不太現實
四面體分子中任意兩個鍵之間的角度約為 109.5°。四面體角可以根據需要計算得儘可能精確,因為它等於 cos−1(–⅓)。
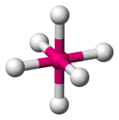
你可能之前遇到過或沒有遇到過八面體。八面體有六個頂點(角)、八個面和十二條邊。每個面都是一個等邊三角形。
八面體在化學中非常重要,因為許多過渡金屬基分子 是八面體的。
-
一個八面體分子 -
要看到八面體,用直線連線周圍原子 -
這些直線形成了八面體的邊 -
八面體角 = 90° 正好 -
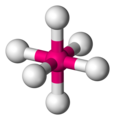
化學家使用虛線和楔形鍵來表示八面體 -
這就是化學家如何表示六氟化硫,SF6 -
SF6 的球棍模型
-
線性的 -
彎曲的 -
三角形的平面 -
錐形的 -
方形平面 -
四面體的 -
三角雙錐形的 -
八面體的
你可以使用所謂的AXE 方法來計算分子的形狀。它是基於具有中心原子的分子,我們將其標記為 A。與 A 鍵合的原子或基團標記為 X。孤對電子標記為 E。具有三個孤對電子和兩個與之鍵合的原子/基團的分子將表示為 AX2E3。下表顯示了 X 和 E 以及分子形狀之間的關係。
價層電子對互斥理論 (VSEPR) 用於在已知 X 和 E 的情況下預測分子的形狀。這聽起來比實際更復雜。你認為任何 X 和 E 都是電荷區域,它們相互儘可能遠離地定位,以最大限度地減少它們之間靜電排斥力的作用。
| AXE 標籤 | X (取代基) |
E (孤對電子) |
形狀 | 2D 圖 顯示孤對電子 |
2D 圖 不顯示孤對電子 |
3D 模型 顯示孤對電子 |
3D 模型 不顯示孤對電子 |
示例 |
|---|---|---|---|---|---|---|---|---|
| AX1E0 | 線性的 | H2 | ||||||
| AX1E1 | 線性的 | CN− | ||||||
| AX1E2 | 線性的 | 
|

|
O2 | ||||
| AX1E3 | 線性的 | 
|

|
HCl | ||||
| AX2E0 | 線性的 | BeCl2 HgCl2 CO2 | ||||||
| AX2E1 | 彎曲的 | 
|

|

|
NO2− SO2 O3 | |||
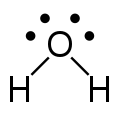
| AX2E2 | 彎曲的 | 
|

|

|
H2O H2S OF2 | |||
| AX2E3 | 線性的 | 
|

|
XeF2 I3− | ||||
| AX3E0 | 三角形的平面 | 
|

|

|

|
BF3 CO32− NO3− SO3 | ||
| AX3E1 | 三角錐形的 | 
|

|

|

|
NH3 PCl3 | ||
| AX3E2 | T 形 | 
|

|

|

|
ClF3 BrF3 | ||
| AX4E0 | 四面體的 | 
|

|

|

|
CH4 NH4+ PO43− SO42− ClO4− | ||
| AX4E1 | 蹺蹺板形 | 
|

|

|

|
SF4 | ||
| AX4E2 | 方形平面 | 
|

|

|
XeF4 | |||
| AX5E0 | 三角雙錐形的 | 
|

|

|

|
PCl5 | ||
| AX5E1 | 方形錐形的 | 
|

|

|

|
ClF5 BrF5 | ||
| AX5E2 | 五角形的平面 | 
|

|

|
XeF5- | |||
| AX6E0 | 八面體的 | 
|

|

|

|
SF6 | ||
| AX6E1 | 五角錐形 | 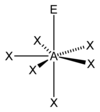
|

|

|

|
IF6- | ||
| AX7E0 | 五角雙錐形 | 
|

|

|

|
IF7 | ||
| AX8E0 | 正方反稜柱形 | 
|

|
IF8- | ||||
| AX8E1 | 扭曲的正方反稜柱形 | 
|
XeF82- | |||||
| AX9E0 | 三帽三角柱形 或 頂蓋正方反稜柱形 | 
|

|
ReH92- (三帽三角柱形) |