A 級化學/OCR(Salters)/芳烴的反應
芳烴的反應是化學思想中第 12.4 節的標題。
芳烴比烯烴穩定得多,反應性也更低。與烯烴不同,芳烴不進行親電加成反應,因為這樣做會破壞芳烴的芳香性(由於環中的電子離域而產生的穩定性)。
芳烴的特徵反應完全不同。它們傾向於進行親電取代,這涉及親電子試劑取代芳烴苯環上的一個氫原子。

無論何時使用三氯化鋁,AlCl3,無水條件都是必不可少的——與水接觸時,可能會發生爆炸性反應,釋放出腐蝕性氯化氫氣體。
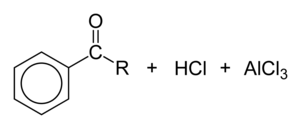
傅-克醯基化中心的親電試劑是醯基離子,[RCO]+。它的碳原子帶有很大的部分正電荷,並且具有高度的親電子性,使其能夠與苯等非常不活潑的芳烴反應。醯基離子的鍵合最好描述為兩種共振形式的共振雜化體
芳烴與 NO2+ 反應,NO2+ 是一種高度親電的線性陽離子,稱為硝醯離子。結果,硝基,RNO2,取代了芳烴苯環上的一個氫原子。
由於 NO2+ 反應性很高,因此它不方便以鹽的形式使用。它必須原位(在反應容器中)透過濃硫酸與濃硝酸反應產生,兩者合稱為硝化混合物。
- HNO3 + 2H2SO4 → NO2+ + 2HSO4− + H3O+
每摩爾硝化的苯消耗一摩爾的硝酸,因此硝酸是反應物。相反,硫酸在硝化完成後再生,使其成為催化劑。

為了限制新增的硝基數量,溫度必須保持在 55 °C 以下。高於此溫度,會形成二硝基和三硝基化合物,這些化合物通常極不穩定,容易爆炸。一個例子是 TNT(三硝基甲苯,2,4,6-三硝基甲苯的俗名)。
濃鹽酸中的錫是將硝基芳烴還原為芳胺的有效催化劑。

濃硫酸中含有一些三氧化硫,SO3,被認為是芳烴磺化反應中涉及的親電試劑。SO3的中心硫原子具有很大的正偏電荷,它足夠親電以吸引苯環上的離域電子。
苯很難氫化,因為這樣做會導致穩定的芳香體系(離域電子)消失。氫化苯需要高度活性的催化劑以及高溫高壓條件。
該催化劑基於高度分散的鎳,被稱為雷尼鎳。工業上使用的條件是30個大氣壓和300 °C的溫度。氫化一摩爾苯需要三摩爾氫氣,H2。
除了氫化以外,這裡介紹的芳烴反應都是親電取代反應。芳烴,尤其是苯,具有極其穩定且不活潑的芳香體系(離域電子)。因此,芳烴只與最活潑的親電試劑反應,並且需要特殊的催化劑來生成所需的高度親電物質,例如Br+、NO2+和R+。

一旦生成了合適的親電物質E+,它將與苯快速反應。形成一個高度不穩定的中間體(包含一個四面體碳),這會顯著破壞環中電子的離域。中間體立即釋放一個質子以恢復完全的芳香環,從而大幅降低其能量。
對機理的更詳細觀察表明,苯中的一個氫原子被親電試劑取代。