A-level 物理 (進階物理)/理想氣體
外觀
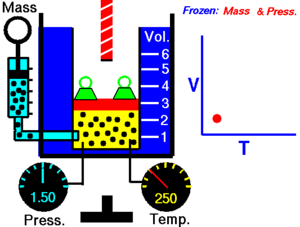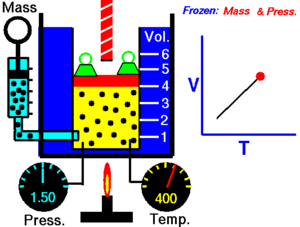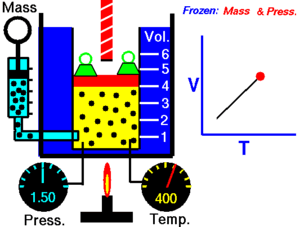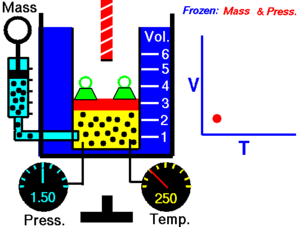
現實世界中的氣體可以被建模為理想氣體。理想氣體由許多隨機運動的點粒子組成,這些粒子之間發生彈性碰撞。有四個關於理想氣體的簡單定律,你需要了解。
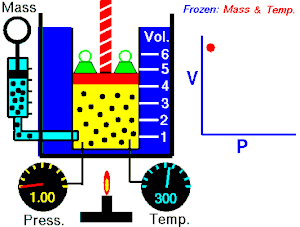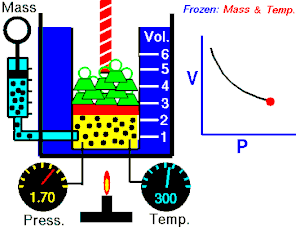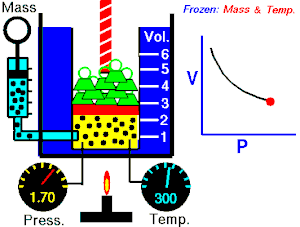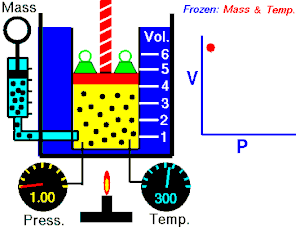
波義耳定律指出,理想氣體的壓力與其體積成反比,假設氣體的質量和溫度保持不變。如果我將理想氣體壓縮到原來空間的一半,則容器外部的壓力將翻倍。所以
查理定律指出,理想氣體的體積與其溫度成正比。
T 必須以開爾文為單位進行測量,其中 1°K 的升高等於 1°C 的升高,而 0°C = 273°K。如果我們將氣體的溫度翻倍,則粒子會移動兩倍,因此體積也會翻倍。
該定律指出,理想氣體的壓力與其物質的量成正比。如果我們擁有兩倍的粒子數量 N,那麼它們所在容器上的壓力也會翻倍。
摩爾是粒子的數量。1 摩爾 = 6.02 x 1023 個粒子。因此,氣體的壓力也與存在的摩爾數 n 成正比。
壓力定律指出,理想氣體的壓力與其溫度成正比。溫度 (以 °K 為單位) 翻倍的氣體會在它所在的容器壁上產生兩倍的壓力。
這些定律可以組合成更大的公式,將 p、V、T 和 N 聯絡起來。為此,我們需要一個比例常數 (R),即通用摩爾氣體常數,其實驗值為 8.31Jmol−1K−1
1. 我將一些氬氣從 250K 加熱到 300K。如果氣體在 250K 時的壓力為 0.1 MPa,那麼加熱後的壓力是多少?
2. 氬氣在一個長 0.5 米、半徑 10 釐米的圓柱形容器中。它佔用的體積是多少?
3. 然後用活塞壓縮氬氣,使其只佔據容器長度的 0.4 米。它的新壓力是多少?
4. 它的新溫度是多少?
5. 25% 的氬氣被抽走。現在它的壓力是多少?





