分子生物學/細胞週期導論
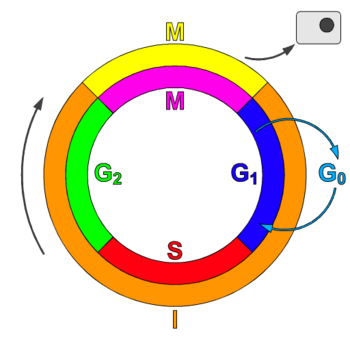
細胞週期,或稱細胞分裂週期 (cdc),是指細胞中發生的一系列事件,最終導致細胞分裂和複製。在沒有細胞核的細胞(原核生物)中,細胞週期透過稱為二元分裂的過程進行。在有細胞核的細胞(真核生物)中,細胞週期可以分為兩個簡短的時期:間期——在此期間,細胞生長,積累有絲分裂所需的營養物質並複製其 DNA——以及有絲分裂 (M) 期,在此期間,細胞將自身分裂成兩個不同的細胞,通常稱為“子細胞”。細胞分裂週期是單細胞受精卵發育成為成熟生物體的必要過程,也是頭髮、皮膚、血液細胞以及一些內部器官更新的過程。[1]
細胞週期包含四個不同的階段:G1 (Gap1) 期、S 期 (合成期)、G2 (Gap2) 期(統稱為間期)和 M 期(有絲分裂期)。M (有絲分裂) 期本身由兩個緊密耦合的過程組成:有絲分裂,在此期間,細胞的染色體在兩個子細胞之間分配;胞質分裂,在此期間,細胞的胞質分裂成兩半,形成不同的細胞。每個階段的啟用都取決於先前階段的正常進展和完成。暫時或可逆地停止分裂的細胞被稱為進入一種稱為 G0 期的靜止狀態。[1]
暫時停止分裂的細胞被稱為進入一種稱為G0 期的靜止狀態。G0 期被認為是延長了的 G1 期,在此期間,細胞既不分裂也不準備分裂,或者是一種與細胞週期無關的獨特靜止階段。G0 有時被稱為“有絲分裂後”狀態,因為 G0 期的細胞處於細胞週期外的非分裂階段。一些型別的細胞,例如神經細胞和心肌細胞,在達到成熟期(即終末分化)時會進入有絲分裂後狀態,但會繼續執行它們的主要功能,直到生物體的生命結束。不發生胞質分裂的多核肌細胞通常也被認為處於 G0 階段。有時,會在 G0 細胞和“有絲分裂後”細胞(例如心肌細胞和神經元)之間進行術語區分,前者永遠不會進入 G1 期,而後者則可能進入 G1 期。[2]
間期的第一個階段是 G1 期,從上一次有絲分裂期結束到 DNA 複製開始,稱為 G1 期(G 代表間隙)。它也被稱為生長期。在此階段,細胞的生物合成活動在 M 期已大大減緩,現在恢復到高水平。該階段的標誌是合成 S 期所需的各種酶,主要是 DNA 複製所需的酶。G1 的持續時間變化很大,即使在同一物種的不同細胞之間也是如此。[1]
DNA 複製的開始是 S 期的標誌;當它完成時,所有的染色體都已複製,此時每條染色體都有兩個(姐妹)染色單體。因此,在此階段,細胞中的 DNA 量實際上翻了一番,但細胞的倍性保持不變。RNA 轉錄和蛋白質合成的速率在此階段非常低。一個例外是組蛋白的產生,它主要發生在 S 期。[1]
在 S 期或複製後,細胞進入 G2 期,持續到細胞進入有絲分裂。同樣,在此階段會發生大量的生物合成,主要涉及微管的產生,微管在有絲分裂過程中是必需的。抑制 G2 期的蛋白質合成會阻止細胞進行有絲分裂。
細胞週期分析
細胞週期分析是細胞生物學中的一種方法,它利用流式細胞術來區分處於不同細胞週期階段的細胞。在分析之前,細胞會被透化並用一種熒光染料進行處理,該染料可以定量地染色 DNA,通常是碘化丙啶 (PI)。因此,染色細胞在特定波長下的熒光強度將與它們所含的 DNA 量相關。由於細胞在細胞週期的 S 階段會複製 DNA,因此可以確定處於 G0 期和 G1 期(S 階段之前)、S 階段、以及 G2 期和 M 期(S 階段之後)的細胞比例,因為 G2/M 期的細胞的熒光強度將是 G0/G1 期的細胞的兩倍。細胞週期異常可能是各種細胞損傷的症狀,例如 DNA 損傷,會導致細胞在某些檢查點中斷細胞週期,以防止其轉化為癌細胞(致癌作用)。異常的其他可能原因包括缺乏營養物質,例如在血清剝奪之後。細胞週期分析首次於 1969 年在洛斯阿拉莫斯國家實驗室由加州大學的一個小組使用 Feulgen 染色技術進行描述。使用碘化丙啶染色的細胞週期分析的第一個方案是由哈佛醫學院的 Awtar Krishan 於 1975 年提出的,至今仍然被廣泛引用。[3]
有絲分裂是有絲分裂真核細胞將細胞核中的染色體分離成兩個相同組並形成兩個細胞核的過程。它通常緊隨細胞質分裂,細胞質分裂將細胞核、細胞質、細胞器和細胞膜分成兩個細胞,包含這些細胞成分的幾乎相等的份額。有絲分裂和細胞質分裂一起定義了細胞週期的有絲分裂 (M) 期 - 母細胞分裂成兩個子細胞,在遺傳上彼此相同,也與其親代細胞相同。這約佔細胞週期的 10%。有絲分裂僅發生在真核細胞中,但在不同物種中以不同的方式發生。例如,動物經歷“開放式”有絲分裂,其中核膜在染色體分離之前破裂,而真菌如麴黴和釀酒酵母(酵母)經歷“封閉式”有絲分裂,其中染色體在完整的細胞核內分裂。原核細胞沒有細胞核,透過稱為二元裂變的過程分裂。有絲分裂過程是複雜的,並且受到高度調控。事件的順序被劃分為階段,對應於一組活動的完成和下一組活動的開始。這些階段分別是前期、前中期、中期、後期和末期。在有絲分裂過程中,染色體對會濃縮並附著在將姐妹染色單體拉到細胞兩側的纖維上。然後細胞在細胞質分裂中分裂,產生兩個相同的子細胞。由於細胞質分裂通常與有絲分裂同時發生,因此“有絲分裂”經常與“M 期”互換使用。然而,在許多細胞中,有絲分裂和細胞質分裂會分開發生,形成多個核的單細胞。這在真菌和粘菌中最為突出,但在各種不同的群體中都有發現。即使在動物中,細胞質分裂和有絲分裂也可能獨立發生,例如在果蠅胚胎髮育的某些階段。有絲分裂中的錯誤會導致細胞凋亡而死亡,或者會導致可能導致癌症的突變。[4]
前期


前期來自古希臘語 pro(之前)和 phase(階段),是有絲分裂的一個階段,其中染色質濃縮(它變得更短更粗)成高度有序的結構,稱為染色體,其中染色質變得可見。這個過程稱為染色質濃縮,是由凝聚素複合體介導的。由於遺傳物質在細胞週期的早期階段已經複製,因此細胞中每條染色體有兩個相同的副本。相同的染色體被稱為姐妹染色單體,彼此附著在每個染色體上存在的 DNA 元件上,稱為著絲粒。在前期,可以應用吉姆薩染色以在染色體中引發 G 帶。前期約佔細胞週期持續時間的 3%。有絲分裂中一個重要的細胞器是中心體,它是後生動物中微管的組織中心。在前期,兩個中心體在有絲分裂中獨立複製,由於 γ-微管的募集,它們的微管活性增加。中心體將透過作用於微管的分子馬達的作用被推到細胞核的兩端。核膜分解以允許微管到達染色體上的動粒,標誌著前期的結束。前中期是緊接有絲分裂的下一步,將看到染色體被微管捕獲。[5]
植物細胞中的前期
在這個有絲分裂的第一階段,植物細胞經歷一系列被稱為青春期的變化。在高液泡植物細胞中,收縮液泡必須遷移到細胞中心,有絲分裂才能開始。這在細胞週期的 G2 期實現。橫向的細胞質片將細胞沿未來的細胞分裂平面一分為二。植物細胞中的前期之前是一個僅在植物中發現的階段,即在未來有絲分裂紡錘體的赤道平面下方形成微管和肌動蛋白絲環,並預測末期細胞板融合的位置。在動物細胞的末期,會形成一個胞質分裂溝。儘管有相反的看法,但前期帶在核膜分解和前中期紡錘體形成過程中消失。高等植物的細胞缺乏中心粒。相反,核膜充當微管組織中心。紡錘體微管在前期和前期期間聚集在核膜表面,形成前期紡錘體。[5]
中期
中期來自古希臘語 meta(之間)和 phase(階段),是真核細胞週期中有絲分裂的一個階段,其中濃縮的、高度螺旋的染色體攜帶遺傳資訊,在被分離到兩個子細胞中的每一個之前,排列在細胞的中間。中期約佔細胞週期持續時間的 4%。在前期發生的事件之前,並且在後期之後,前期形成的微管已經在中期找到了並附著在動粒上。染色體的著絲粒會在中期板(或赤道板)上匯聚,中期板是距離兩個中心體極等距的假想線。這種均勻的排列是由於相反的動粒產生的拉力產生的平衡,類似於兩個力量相等的人之間的拔河。在某些型別的細胞中,染色體不會排列在中期板上,而是隨機地在兩極之間來回移動,只是大致排列在中間線。中期的早期事件可能與前中期的後期事件同時發生,因為具有連線動粒的染色體將在其他具有未連線動粒的染色體(它們仍然徘徊在前中期事件中)之前單獨開始中期的事件。細胞週期檢查點之一發生在前中期和中期。只有當所有染色體都排列在中期板上,每個動粒都正確地附著在一個微管束上時,細胞才會進入後期。據認為,未附著或未正確附著的動粒會產生一個訊號來阻止過早進入後期,即使大多數動粒已經附著並且大多數染色體已經排列。這樣的訊號產生了有絲分裂紡錘體檢查點。這將透過調節後期促進複合體、安全蛋白和分離酶來實現。[6]
後期(ana(向上)和 phase(階段))
後期以中期向後期的過渡的調控觸發而突然開始,約佔細胞週期持續時間的 1%。此時,後期開始。這透過切割和使 M 期細胞週期蛋白失活來終止活性,M 期細胞週期蛋白對於 M 期細胞週期蛋白依賴性激酶 (M-Cdks) 的功能是必需的。它還會切割安全蛋白,安全蛋白抑制稱為分離酶的蛋白酶。分離酶然後切割凝聚素,凝聚素是負責將姐妹染色單體連線在一起的蛋白質。在後期早期(或後期 A),染色單體突然分離並移向紡錘體極。這是透過紡錘體微管的縮短來實現的,其中力主要在動粒處施加。後期是染色單體彼此分離並移動到細胞兩端的時間。當染色單體完全分離時,後期後期(或後期 B)開始。這涉及極性微管的伸長,並相對於彼此滑動以將紡錘體極驅動到細胞的兩端。後期 B 透過三種力驅動姐妹中心體分離到相反的兩極。附著在極性微管上的驅動蛋白會將微管推到彼此的旁邊。第二種力涉及微管被皮質相關的胞質動力蛋白拉動。染色體分離的第三種力涉及極性微管在其正端的延長。這兩個過程最初是根據它們對藥物的不同敏感性來區分的,它們在機械上是不同的。後期早期(後期 A)涉及透過在其正端解聚而縮短動粒微管。在這個過程中,滑動套允許染色單體運動。沒有參與的運動蛋白,因為 ATP 耗竭不會抑制後期早期。後期後期(後期 B)涉及重疊微管的伸長以及兩組不同的運動蛋白的使用:一組將重疊微管拉到彼此的旁邊,另一組拉動附著在細胞皮質上的星體微管。後期早期和後期後期對整個後期的貢獻因細胞型別而異。在哺乳動物細胞中,後期後期緊隨後期早期之後,將紡錘體延伸到大約中期長度的兩倍;相比之下,酵母和某些原生動物使用後期中期作為染色體分離的主要手段,在此過程中,它們可以將紡錘體延伸到中期長度的 15 倍。[7]
細胞週期蛋白
[edit | edit source]細胞週期蛋白是一組透過啟用Cyclin-dependent kinase (Cdk) 酶來控制細胞透過細胞週期程序的蛋白質。細胞週期蛋白於 1982 年由R. Timothy Hunt在研究海膽細胞週期時發現。
細胞週期蛋白的型別
[edit | edit source]有幾種不同的細胞週期蛋白在細胞週期的不同部分處於活躍狀態,並且會導致 Cdk 磷酸化不同的底物。
有兩種細胞週期蛋白
G1/S 細胞週期蛋白 – 這些細胞週期蛋白對於控制細胞週期在 G1/S 轉變時的作用至關重要,細胞週期蛋白 A / CDK2 – 在 S 期活躍。細胞週期蛋白 D / CDK4、細胞週期蛋白 D / CDK6 和細胞週期蛋白 E / CDK2 – 調節從 G1 到 S 期的過渡。
G2/M 細胞週期蛋白 – 在 G2/M 轉換(有絲分裂)期間控制細胞週期的必需物質。G2/M 細胞週期蛋白在 G2 期間穩定積累,並在細胞退出有絲分裂(在 M 期的末尾)時突然被破壞。細胞週期蛋白 B/CDK1 – 調節從 G2 到 M 期的進展。
還有一些尚未確定 Cdk 伴侶的“孤兒”細胞週期蛋白。例如,細胞週期蛋白 F 是一種孤兒細胞週期蛋白,對 G2/M 轉換至關重要。[8]
細胞週期蛋白依賴性激酶 (CDKs)
[edit | edit source]CDKs 是一系列蛋白激酶。CDKs 存在於所有已知的真核生物中,它們在細胞週期中的調節功能在進化上是保守的。CDKs 也參與轉錄調控、mRNA 加工和神經細胞的分化。一個有趣的事實是,當酵母細胞的 CDK 基因被同源的人類基因取代時,它們可以正常增殖。CDKs 是相對較小的蛋白質,分子量在 34 到 40 kDa 之間,並且只包含激酶結構域。CDK 與稱為細胞週期蛋白的調節蛋白結合。沒有細胞週期蛋白,CDK 幾乎沒有激酶活性,只有細胞週期蛋白-CDK 複合物才是活性激酶。CDKs 在其底物的絲氨酸和蘇氨酸上磷酸化,因此它們是絲氨酸-蘇氨酸激酶。CDK 底物氨基酸序列中磷酸化位點的共有序列是 [S/T*]PX[K/R],其中 S/T* 是磷酸化的絲氨酸或蘇氨酸,P 是脯氨酸,X 是任何氨基酸,K 是賴氨酸,R 是精氨酸。[9]
表: 控制模式生物細胞週期的細胞週期蛋白依賴性激酶。[10]
| 物種 | 名稱 | 原始名稱 | 大小(氨基酸) | 功能 |
|---|---|---|---|---|
| 釀酒酵母 | Cdk1 | Cdc28 | 298 | 所有細胞週期階段 |
| 裂殖酵母 | Cdk1 | Cdc2 | 297 | 所有細胞週期階段 |
| 果蠅 | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | Cdc2c | 314 | G1/S、S,可能還有 M | |
| Cdk4 | Cdk4/6 | 317 | G1,促進生長 | |
| 非洲爪蟾 | Cdk1 | Cdc2 | 301 | M |
| Cdk2 | 297 | S,可能還有 M | ||
| 智人 | Cdk1 | Cdc2 | 297 | M |
| Cdk2 | 298 | G1、S,可能還有 M | ||
| Cdk4 | 301 | G1 | ||
| Cdk6 | 326 | G1 |
細胞週期蛋白和 CDKs 的功能
[edit | edit source]兩類關鍵的調節分子,細胞週期蛋白和細胞週期蛋白依賴性激酶 (CDKs),決定了細胞在細胞週期中的進展。萊蘭·H·哈特維爾、R·蒂莫西·亨特和保羅·M·納斯因發現這些核心分子獲得了 2001 年諾貝爾生理學或醫學獎。編碼細胞週期蛋白和 CDKs 的許多基因在所有真核生物中都是保守的,但總的來說,更復雜的生物體具有更精細的細胞週期控制系統,包含更多單獨的組分。許多相關基因最初是透過研究酵母(特別是釀酒酵母)而發現的;酵母的遺傳命名法將許多這些基因稱為 cdc(代表“細胞分裂週期”),後面跟著一個標識號,例如 cdc25 或 cdc20。
細胞週期蛋白構成活性異二聚體的調節亞基,而 CDKs 構成催化亞基;細胞週期蛋白沒有催化活性,而 CDKs 在沒有伴侶細胞週期蛋白的情況下是無活性的。當被結合的細胞週期蛋白啟用時,CDKs 執行一種稱為磷酸化的常見生化反應,該反應啟用或失活目標蛋白以協調進入細胞週期的下一階段。不同的細胞週期蛋白-CDK 組合決定了被靶向的下游蛋白。CDKs 在細胞中組成性表達,而細胞週期蛋白在細胞週期的特定階段合成,以響應各種分子訊號。
在接收到促有絲分裂的細胞外訊號後,G1 細胞週期蛋白-CDK 複合物被啟用,為細胞準備進入 S 期,促進轉錄因子的表達,這些轉錄因子反過來促進 S 細胞週期蛋白和 DNA 複製所需的酶的表達。G1 細胞週期蛋白-CDK 複合物還透過靶向它們進行泛素化來促進作為 S 期抑制劑起作用的分子降解。一旦蛋白質被泛素化,它就會被蛋白酶體靶向進行蛋白水解降解。活性 S 細胞週期蛋白-CDK 複合物磷酸化構成 G1 期在 DNA 複製起點上組裝的預複製複合物的蛋白質。磷酸化有兩個目的:啟用每個已組裝的預複製複合物,並防止形成新的複合物。這確保了細胞基因組的每個部分都會被複制一次且只有一次。阻止複製缺口的原因相當清楚,因為缺少所有或部分關鍵基因的子細胞將死亡。然而,由於與基因複製數效應有關的原因,某些基因的額外複製對子細胞也有害。有絲分裂細胞週期蛋白-CDK 複合物在 S 和 G2 期合成但處於失活狀態,透過刺激與染色體凝聚和有絲分裂紡錘體組裝相關的下游蛋白來促進有絲分裂的啟動。在此過程中啟用的關鍵複合物是一種稱為後期促進複合物 (APC) 的泛素連線酶,它促進與染色體著絲粒相關的結構蛋白降解。APC 還靶向有絲分裂細胞週期蛋白進行降解,確保可以進行末期和胞質分裂。間期:間期在哺乳動物組織中通常持續至少 12 到 24 小時。在此期間,細胞不斷合成 RNA,產生蛋白質並生長。透過研究細胞中的分子事件,科學家已經確定間期可以分為 4 個步驟:間隙 0 (G0)、間隙 1 (G1)、S (合成) 期、間隙 2 (G2)。
細胞週期蛋白 D 是細胞週期中第一個產生的細胞週期蛋白,以響應細胞外訊號(例如生長因子)。細胞週期蛋白 D 與現有的 CDK4 結合,形成活性細胞週期蛋白 D-CDK4 複合物。細胞週期蛋白 D-CDK4 複合物反過來磷酸化視網膜母細胞瘤易感蛋白 (Rb)。過度磷酸化的 Rb 從 E2F/DP1/Rb 複合物(與 E2F 響應基因結合,有效地“阻斷”它們轉錄)中分離出來,啟用 E2F。E2F 的啟用導致各種基因的轉錄,例如細胞週期蛋白 E、細胞週期蛋白 A、DNA 聚合酶、胸腺嘧啶激酶等。由此產生的細胞週期蛋白 E 與 CDK2 結合,形成細胞週期蛋白 E-CDK2 複合物,將細胞從 G1 推入 S 期(G1/S 轉換)。細胞週期蛋白 B 以及 cdc2(cdc2 - 裂殖酵母(CDK1 - 哺乳動物))形成細胞週期蛋白 B-cdc2 複合物,啟動 G2/M 轉換。細胞週期蛋白 B-cdc2 複合物的啟用導致核膜的破裂和前期啟動,隨後,它的失活導致細胞退出有絲分裂。[1]
細胞週期失調
[edit | edit source]細胞週期組分的失調會導致腫瘤形成。如上所述,一些基因(如細胞週期抑制劑、RB、p53 等)在發生突變時,可能會導致細胞無限制地增殖,形成腫瘤。儘管腫瘤細胞的細胞週期持續時間等於或長於正常細胞週期,但腫瘤中處於活躍細胞分裂狀態的細胞(與處於 G0 期的靜止細胞相比)的比例遠高於正常組織。因此,由於透過凋亡或衰老死亡的細胞數量保持不變,細胞數量淨增加。處於活躍細胞週期中的細胞是癌症治療的靶點,因為 DNA 在細胞分裂過程中相對暴露,因此容易受到藥物或輻射的損傷。這一事實被用於癌症治療;透過稱為去瘤的程式,去除大量腫瘤,這會導致剩餘腫瘤細胞中相當一部分從 G0 期進入 G1 期(由於營養物質、氧氣、生長因子等的可用性增加)。去瘤程式後的放射治療或化療會殺死這些新進入細胞週期的細胞。培養中最快速迴圈的哺乳動物細胞,腸上皮隱窩細胞,其週期時間短至 9 到 10 小時。靜止小鼠皮膚中的幹細胞的週期時間可能超過 200 小時。這種差異的主要原因是 G1 的長度不同,G1 是週期中最不穩定的階段。M 和 S 的變化不大。一般來說,細胞在 M 期後期和 G2 期最敏感,在 S 期後期最耐受。對於具有較長細胞週期時間和明顯較長 G1 期的細胞,在 G1 期後期存在另一個耐受峰。耐受和敏感性模式與細胞中硫氫基化合物的水平相關。硫氫基是天然的放射防護劑,其水平在 S 期最高,而在有絲分裂附近最低。[1]
細胞週期檢查點
[edit | edit source]G1/S 檢查點
[edit | edit source]
G1/S 轉換,更常被稱為出芽酵母中的起始檢查點(其他生物體中的限制點),調節細胞週期承諾。在這個檢查點,細胞要麼在 DNA 複製之前停滯(由於營養物質限制或資訊素訊號),要麼延長 G1 期(大小控制),要麼開始複製並透過細胞週期的其餘部分。出芽酵母中的 G1/S 調節網路或調節子包括 G1 週期蛋白 Cln1、Cln2 和 Cln3、Cdc28(Cdk1)、轉錄因子 SBF 和 MBF 以及轉錄抑制因子 Whi5。[11] Cln3 與 Cdk1 相互作用,透過磷酸化大量靶標(包括 SBF、MBF 和 Whi5)來啟動一系列事件。Whi5 的磷酸化導致它從細胞核中轉運出去,防止它抑制 SBF 和 MBF。活躍的 SBF/MBF 透過開啟 B 型週期蛋白並啟動 DNA 複製、芽形成和紡錘體複製來驅動 G1/S 轉換。此外,SBF/MBF 驅動 Cln1 和 Cln2 的表達,它們也可以與 Cdk1 相互作用以促進其靶標的磷酸化。
最初認為這個 G1/S 開關以從 Cln3 開始並以 S 期結束的線性事件序列起作用。[12] 然而,任何一個 Clns 都足以啟用調節子的觀察表明,Cln1 和 Cln2 可能能夠參與正反饋來啟用它們自身的轉錄。這將導致一個不斷加速的迴圈,該迴圈可以充當不可逆的雙穩態觸發器。Skotheim 等人使用出芽酵母中的單細胞測量表明這種正反饋確實存在。少量的 Cln3 會誘導 Cln1/2 表達,然後反饋迴路接管,導致 Whi5 從細胞核中快速而突然地退出,並因此導致 G1/S 調節子基因的連貫表達。在沒有連貫基因表達的情況下,細胞需要更長的時間才能退出 G1 期,並且相當一部分甚至在 S 期之前停滯,這突出了正反饋在銳化 G1/S 開關中的重要性。
G1/S 細胞週期檢查點控制真核細胞從第一個間隙期 G1 期進入 DNA 合成期 S 期。在哺乳動物細胞中的這種轉換中,有兩個細胞週期激酶有助於控制檢查點:細胞週期激酶 CDK4/6-細胞週期蛋白 D 和 CDK2-細胞週期蛋白 E。包含 Rb 和 E2F 的轉錄複合物在控制此檢查點中很重要。在第一個間隙期,Rb-HDAC 抑制複合物與 E2F-DP1 轉錄因子結合,因此抑制下游轉錄。CDK4/6 和 CDK2 對 Rb 的磷酸化解離了 Rb-抑制複合物,並作為細胞週期的開/關開關。一旦 Rb 被磷酸化,對 E2F 轉錄活性的抑制就會解除。這使得能夠轉錄編碼放大 G1 到 S 期轉換的蛋白質的 S 期基因。[13]
許多不同的刺激應用檢查點控制,包括 TGFb、DNA 損傷、接觸抑制、複製性衰老和生長因子撤回。前四個透過誘導 INK4 或 Kip/Cip 家族的細胞週期激酶抑制劑成員來起作用。TGFb 抑制 Cdc25A 的轉錄,Cdc25A 是一種啟用細胞週期激酶的磷酸酶,而生長因子撤回啟用 GSK3b,GSK3b 磷酸化細胞週期蛋白 D。這導致其快速泛素化。[14]
G2/M 檢查點
[edit | edit source]這種轉換是由 E2F 介導的細胞週期蛋白 A 的轉錄開始的,形成細胞週期蛋白 A-Cdk2 複合物。這在調節前期事件中很有用。為了透過前期,細胞週期蛋白 B-Cdk1 複合物(最初被稱為 MPF 或 M 相促進因子)被 Cdc 25(一種蛋白質磷酸酶1)啟用。隨著有絲分裂開始,核膜崩解,染色體濃縮並變得可見,細胞為分裂做好準備。細胞週期蛋白 B-Cdk1 的啟用導致核膜分解,這是有絲分裂開始的特徵。很明顯,細胞週期蛋白 A 和 B 與 Cdk 的複合物有助於調節 G2/M 轉換時的有絲分裂事件。[15]
如上所述,進入有絲分裂是由細胞週期蛋白 B-Cdk1 複合物控制的(最初被稱為 MPF 或 M 相促進因子;Cdk1 在裂殖酵母中也被稱為 Cdc2,在出芽酵母中被稱為 Cdc28)。該複合物構成了一個有趣的調節迴路的一部分,其中 Cdk1 可以磷酸化並激活其啟用劑,磷酸酶 Cdc25(正反饋),並磷酸化並失活其失活劑,激酶 Wee1(雙負反饋)。有人提出,該回路可以充當雙穩態觸發器[16],在 G2 期(Cdk 和 Cdc25 關閉,Wee1 開啟)有一個穩定的穩態,而在 M 相(Cdk 和 Cdc25 活躍,Wee1 關閉)有一個穩定的穩態。一旦細胞進入有絲分裂,細胞週期蛋白 B-Cdk1 就會啟用後期促進複合物 (APC),它反過來透過降解細胞週期蛋白 B 來失活細胞週期蛋白 B-Cdk1,最終導致退出有絲分裂。將雙穩態 Cdk1 響應函式與來自 APC 的負反饋耦合可以產生所謂的弛豫振盪器,[17] 其中 Cdk1 活性的急劇峰值觸發了強大的有絲分裂週期。然而,在弛豫振盪器中,控制引數相對於系統的響應動力學緩慢移動,這可能是對有絲分裂進入的準確描述,但不一定是對有絲分裂退出的準確描述。
為了退出細胞週期的有絲分裂階段,必須失活細胞週期蛋白 B-Cdk1 複合物。然後,細胞可以返回第一個間隙期 G1 期,並等待週期再次進行。

2003 年,Pomerening 等人透過證明非洲爪蟾卵母細胞胞質提取物中 Cdk1 啟用的滯後現象和雙穩態現象,為該假設提供了強有力的證據。[17] 他們首先證明了 Cdk1 對不可破壞細胞週期蛋白 B 濃度變化的非連續急劇響應(以將 Cdk1 響應網路與 APC 介導的負反饋分離)。然而,這種響應與單穩態超敏感轉變和雙穩態轉變都一致。為了區分這兩種可能性,他們測量了響應於細胞週期蛋白水平變化的活性 Cdk1 的穩態水平,但在兩個單獨的實驗中,一個從間期提取物開始,另一個從已經進入有絲分裂的提取物開始。在細胞週期蛋白的中間濃度下,他們發現兩種活性 Cdk1 的穩態濃度。哪一種穩態被佔據取決於系統的歷史,即它們是從間期提取物還是有絲分裂提取物開始,有效地證明了滯後現象和雙穩態現象。
同年,Sha 等人[18] 獨立地得出了相同的結論,也使用非洲爪蟾卵提取物揭示了滯後迴圈。在這篇文章中,為了得出滯後現象是“細胞週期進入和退出有絲分裂的驅動力”的結論,測試了 Novak-Tyson 模型的三個預測。Novak-Tyson 模型的預測對於所有鞍節點分岔來說都是通用的。鞍節點分岔在不完美的世界中是非常有用的分岔,因為它們有助於描述不完美的生物系統。第一個預測是,進入有絲分裂的細胞週期蛋白閾值濃度高於退出有絲分裂的細胞週期蛋白閾值濃度,這透過補充迴圈卵提取物以不可降解的細胞週期蛋白 B 並測量新增環己醯亞胺 (CHX) 後的啟用和失活閾值得到證實,環己醯亞胺 (CHX) 是一種蛋白質合成抑制劑。此外,Novak-Tyson 模型的第二個預測也得到驗證:未複製的脫氧核糖核酸或 DNA 會增加進入有絲分裂所需的細胞週期蛋白閾值濃度。為了得出這一結論,細胞靜止因子釋放的提取物補充了 CHX、APH(一種 DNA 聚合酶抑制劑)或兩者,並添加了不可降解的細胞週期蛋白 B。本文中測試並證明為真的第三個也是最後一個預測是,Cdc2 啟用速率在接近細胞週期蛋白的啟用閾值濃度時會減慢。這些預測和實驗證明了動態系統中的滯後現象可以描述的類似切換的切換行為。[19]
中期-後期檢查點
[edit | edit source]
從紡錘體檢查點 | 中期到後期的轉變中,確保姐妹染色單體正確且同時分離到細胞的兩端至關重要。姐妹染色單體的分離最初受到強烈抑制,以防止有絲分裂後期過早分離,但這種抑制通過後期促進複合物 (APC) 在姐妹染色單體雙定向後破壞抑制元件而解除。這些抑制元件之一是安全蛋白,它透過結合蛋白酶分離酶來阻止凝聚素的破壞,凝聚素是將姐妹染色單體連線在一起的複合物,分離酶靶向凝聚素複合物的一個亞基 Scc1 進行破壞。在這個系統中,磷酸酶 Cdc14 可以從安全蛋白中去除抑制性磷酸,從而促進 APC 摧毀安全蛋白,釋放分離酶。正如 Uhlmann 等人所述,在染色體附著到有絲分裂紡錘體期間,染色單體保持配對,因為姐妹之間的凝聚力阻止了分離。[20]凝聚力是在 DNA 複製過程中建立的,依賴於凝聚素,凝聚素是一個由 Scc1、Scc3、Smc2 和 Smc3 組成的多亞基複合物。在酵母中,在中期到後期的轉變過程中,Scc1 從染色體上解離,姐妹染色單體分離。這個過程受 Esp1 蛋白的控制,Esp1 蛋白與後期抑制劑 Pds1 緊密結合,而 Pds1 被後期促進複合物摧毀。為了驗證 Esp1 是否確實在調節 Scc1 染色體關聯中發揮作用,細胞株被用α因子阻滯在 G1 期。這些細胞在發育過程中保持阻滯狀態。使用 Esp1-1 突變體細胞並重復實驗,Scc1 成功地結合到染色體上,即使在合成終止後也保持關聯。這對於表明 Esp1 阻礙了 Scc1 在 G1 期間穩定地與染色體結合的能力,以及 Esp1 實際上可以直接從染色體上移除 Scc1 至關重要。[13]
Holt 等人已經證明[21],分離酶啟用 Cdc14,而 Cdc14 反過來作用於安全蛋白,從而形成一個正反饋迴路,增強了中期到後期的轉變的清晰度和姐妹染色單體分離的協調。[21]Holt 等人利用酵母的突變“安全蛋白”菌株探測了正反饋在安全蛋白磷酸化中的作用基礎,並測試了安全蛋白磷酸調節的變化如何影響姐妹染色單體分離的同步性。他們的結果表明,干擾這種安全蛋白-分離酶-cdc14 的正反饋迴路會降低姐妹染色單體分離的同步性。這種正反饋可以假設地在向後期的轉變中產生雙穩態,導致細胞做出不可逆轉的決定來分離姐妹染色單體。
裂殖酵母的細胞分裂
[edit | edit source]裂殖酵母是一種單細胞真菌,具有簡單、完全特徵化的基因組和快速的生長速度。它長期以來被用於釀造、烘焙和分子遺傳學。粟酒裂殖酵母是一種桿狀細胞,直徑約 3 µm,完全透過端部伸長生長。有絲分裂後,分裂發生在細胞中央形成隔膜或細胞板,將細胞在中部分開。
細胞繁殖的核心事件是染色體複製,發生在 S(合成)期,然後是染色體分離和核分裂(有絲分裂)以及細胞分裂(胞質分裂),這些事件統稱為 M(有絲分裂)期。G1 是 M 和 S 期之間的間隙,G2 是 S 和 M 期之間的間隙。在出芽酵母中,G2 期特別延長,胞質分裂(子細胞分離)直到啟動新的 S(合成)期才發生。
裂殖酵母透過與多細胞動物相似的機制控制有絲分裂。它通常以單倍體狀態增殖。當飢餓時,相反交配型別的細胞(P 和 M)融合形成一個二倍體合子,立即進入減數分裂以產生四個單倍體孢子。當條件改善時,這些孢子萌發產生增殖的單倍體細胞。[22]
需要記住的事實
[edit | edit source]| 狀態 | 階段 | 縮寫 | 描述 |
|---|---|---|---|
| 靜止 / 衰老 |
間隙 0 | G0 | 細胞離開週期並停止分裂的靜止階段。 |
| 間期 | 間隙 1 | G1 | 細胞在間隙 1 中增大。G1 檢查點控制機制確保一切準備就緒,以便進行DNA合成。 |
| 合成 | S | 在此階段進行DNA 複製。 | |
| 間隙 2 | G2 | 在 DNA 合成和有絲分裂之間的間隙中,細胞將繼續生長。G2 檢查點控制機制確保一切準備就緒,以便進入 M(有絲分裂)期並進行分裂。 | |
| 細胞分裂 | 有絲分裂 | M | 細胞生長在此階段停止,細胞能量集中在有序地分裂成兩個子細胞。有絲分裂中期的檢查點(中期檢查點)確保細胞已準備好完成細胞分裂。 |
有絲分裂的階段 [4]
透過染色真實的有絲分裂細胞,用熒光抗體和染料可以在顯微鏡下觀察到它們。這些光學顯微照片包含在下面。
-
前期早期:非著絲點微管,顯示為綠色細絲,已在藍色降解的細胞核周圍建立了基質。綠色小體是中心體。
-
前中期早期:核膜剛剛降解,使微管能夠快速與染色體上的著絲點相互作用,染色體剛剛凝集。
-
中期後期:中心體已移動到細胞的兩極並建立了有絲分裂紡錘體。染色體,以淺藍色顯示,都已組裝在中期板處,除了一個。
-
後期:伸長的非著絲點微管將兩套染色體進一步推開。
參考文獻
[edit | edit source]- ↑ a b c d e f 細胞週期
- ↑ G0 期
- ↑ 細胞週期分析
- ↑ a b 有絲分裂
- ↑ a b 前期
- ↑ 中期
- ↑ 後期
- ↑ 週期蛋白
- ↑ 週期蛋白依賴性激酶
- ↑ Morgan,David O.(2007)。細胞週期:控制原理。倫敦:新科學出版社,第一版。
- ↑ Skotheim, J.M.; Di Talia, S.; Siggia, E.D.; Cross, F.R. (2008), "G1 週期蛋白的正反饋確保了細胞週期進入的連貫性",自然,454 (7202): 291,檢索於 2009-12-11
- ↑ Stuart, D.; Wittenberg, C. (1995), "CLN3,而不是正反饋,決定了迴圈細胞中 CLN2 轉錄的時間" (PDF),基因與發育,9 (22): 2780,檢索於 2009-12-11
- ↑ a b 細胞週期中的生化開關
- ↑ Harper JW. 細胞週期控制中磷酸化驅動的泛素化開關. TrendsCell Biol. 2002 年 3 月;12(3):104-7. PMID 11859016
- ↑ 細胞週期中的生化開關
- ↑ Novak, B.; Tyson, J.J. (1993), "非洲爪蟾卵母細胞提取物和完整胚胎中 M 期控制的綜合模型的數值分析", Journal of Cell Science, 106 (4): 1153, 檢索於 2009-12-11
- ↑ a b Pomerening, J. R., E. D. Sontag 等人 (2003)。“構建細胞週期振盪器:Cdc2 啟用中的滯後現象和雙穩態”。Nat Cell Biol 5(4): 346-351。
- ↑ Sha, W.; Moore, J.; Chen, K.; Lassaletta, A.D.; Yi, C.S.; Tyson, J.J.; Sible, J.C. (2003), "滯後現象驅動非洲爪蟾卵提取物中的細胞週期轉變", Proceedings of the National Academy of Sciences, 100 (3): 975, 檢索於 2009-12-11
- ↑ Cooper, G. (2000),“細胞:分子方法”。檢索於 2010-11-21
- ↑ Uhlmann F.; Lottspeich F.; Nasmyth K. (1999),“粘連亞基 Scc1 的裂解促進了後期開始時的姐妹染色單體分離”,Nature 400: 37-42,檢索於 2010-9-25
- ↑ a b Holt, L. J., A. N. Krutchinsky 等人 (2008)。“正反饋使後期開關變得敏銳”。Nature 454(7202): 353-357。
- ↑ 裂殖酵母




