分子生物學/基因表達簡介
基因表達是指基因中的資訊被用來合成功能性基因產物的過程。這些產物通常是蛋白質,但在非蛋白質編碼基因(如核糖體RNA(rRNA)基因或轉移RNA(tRNA)基因)中,產物是功能性RNA。基因表達過程被所有已知生命形式使用 - 真核生物(包括多細胞生物)、原核生物(細菌和古細菌)和病毒 - 來產生維持生命的生物大分子機制。基因表達過程中的幾個步驟可能會受到調節,包括蛋白質的轉錄、RNA剪接、翻譯和翻譯後修飾。基因調控使細胞能夠控制其結構和功能,並且是細胞分化、形態發生以及任何生物體靈活性和適應性的基礎。基因調控也可能作為進化變化的基質,因為對基因表達時間、位置和量的控制可以對基因在細胞或多細胞生物體中的功能(作用)產生深遠的影響。在遺傳學中,基因表達是基因型產生表型的最基本層次。以核苷酸序列形式儲存在 DNA 中的遺傳密碼透過基因表達被“解釋”,而表達產物的特性導致了生物體的表型。[1] 最初由弗朗索瓦·雅各布和雅克·莫諾提出,允許遺傳物質被實現為蛋白質的分子。1965年,幾個實驗室在體外建立了RNA聚合酶的RNA合成;然而,這些酶合成的RNA具有表明存在一個額外的因子,需要正確終止轉錄。1972年,沃爾特·菲爾斯成為第一個真正證明終止酶存在的科學家。羅傑·D·科恩伯格因“他對真核生物轉錄的分子基礎的研究”獲得2006年諾貝爾化學獎。
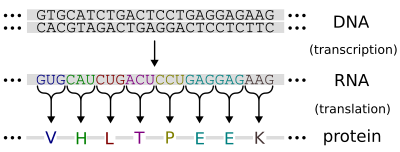
從DNA生成RNA被稱為轉錄。換句話說,轉錄是建立DNA序列的互補RNA副本的過程。在轉錄過程中,DNA序列被RNA聚合酶讀取,它產生一個互補的反向RNA鏈。與DNA複製相反,轉錄產生的RNA互補鏈包含尿嘧啶(U),在DNA互補鏈中所有出現胸腺嘧啶(T)的地方都會出現尿嘧啶(U)。[2] 轉錄可以透過4或5個簡單的步驟來輕鬆解釋,每個步驟就像波浪一樣沿著DNA移動。
As the Hydrogen Bonds Break DNA unwinds. The free nucleotides of the RNA, pair with complementary DNA bases. RNA sugar-phosphate backbone forms. (by RNA Polymerase.) Hydrogen bonds of the untwisted RNA-DNA "ladder" break, freeing the new RNA. The RNA is further processed and then moves through the small nuclear pores to the cytoplasm.
轉錄是導致基因表達的第一步。轉錄成RNA分子的DNA片段被稱為轉錄單位,它至少編碼一個基因。如果被轉錄的基因編碼蛋白質,那麼轉錄的結果是信使RNA(mRNA),然後將透過翻譯過程被用來建立該蛋白質。或者,被轉錄的基因可能編碼核糖體RNA(rRNA)或轉移RNA(tRNA),這是蛋白質組裝過程的其他組分,或其他核酶。
編碼蛋白質的DNA轉錄單位不僅包含最終將直接翻譯成蛋白質的序列(編碼序列),還包含指導和調節該蛋白質合成的調控序列。編碼序列之前的調控序列(上游)被稱為5'UTR(5'非翻譯區),編碼序列之後的序列(下游)被稱為3'UTR(3'非翻譯區)。轉錄具有一些校對機制,但這些機制少於且不如複製DNA的控制機制有效;因此,轉錄的複製保真度低於DNA複製。與DNA複製一樣,DNA在轉錄過程中從3'→5'方向讀取。同時,互補RNA從5'→3'方向建立。這意味著它的5'端首先在鹼基配對中被建立。雖然DNA以雙螺旋形式排列成兩條反平行鏈,但只有兩條DNA鏈中的一條被稱為模板鏈用於轉錄。這是因為RNA是單鏈的,而DNA是雙鏈的。另一條DNA鏈被稱為編碼鏈,因為它的序列與新建立的RNA轉錄本相同(除了尿嘧啶取代胸腺嘧啶)。只使用3'→5'鏈可以消除對DNA複製中觀察到的岡崎片段的需要。轉錄分為5個階段:起始前、起始、啟動子清除、延伸和終止。
一個基因一個酶假說是指基因透過產生酶來發揮作用,每個基因負責產生一種特定的酶,而這種酶又會影響代謝途徑中的一個特定步驟。這個概念是由喬治·比德爾和愛德華·塔特姆在他們1941年關於真菌Neurospora crassa的遺傳突變的一篇有影響力的論文中提出的,[3] 後來被他們的合作者諾曼·霍洛維茨稱為“一個基因一個酶假說”。它通常被認為是後來被稱為分子生物學的第一項重大成果。雖然這個假說影響深遠,但在它被提出後不久就被認識到它過於簡單化了。甚至後來提出的“一個基因一個多肽”假說也被認為過於簡單,無法描述基因和蛋白質之間的關係。[4]
什麼是Neurospora?Neurospora crassa是一種屬於子囊菌門的紅色麵包黴。屬名意為“神經孢子”,指的是孢子上的特徵條紋。
N. crassa被用作模式生物,因為它易於培養,並且具有單倍體生命週期,這使得遺傳分析變得簡單,因為隱性性狀會在後代中顯現出來。由於Neurospora的子囊孢子中減數分裂產物的排列有序,因此可以方便地分析遺傳重組。它的整個包含7條染色體的基因組已經測序。愛德華·塔特姆和喬治·威爾斯·比德爾在他們的實驗中使用Neurospora,他們因此獲得了1958年的諾貝爾生理學或醫學獎。比德爾和塔特姆用X射線照射N. crassa,導致突變。然後,他們觀察了由於特定酶出現錯誤而導致的代謝途徑中的故障。這導致他們提出了“一個基因一個酶”假說,即特定基因編碼特定的蛋白質。他們的假說後來由諾曼·霍洛維茨進一步闡述,他也從事Neurospora的研究。
到20世紀50年代初,生物化學遺傳學的進展——部分源於最初的假說——使一個基因一個酶假說看起來不太可能(至少在最初的形式上)。從1957年開始,弗農·英格拉姆等人透過蛋白質指紋圖譜表明,蛋白質中的遺傳變異(如鐮狀細胞血紅蛋白)可能僅限於多聚體蛋白質中單個多肽鏈的差異,從而導致了“一個基因一個多肽”假說的提出。根據遺傳學家羅蘭·H·戴維斯的說法,“到1958年——實際上,即使到1948年——一個基因一個酶不再是需要堅決捍衛的假說;它僅僅是一個研究專案的名稱。”目前,一個基因一個多肽的觀點無法解釋許多真核生物中的各種剪接版本,這些真核生物使用剪接體根據各種細胞間和細胞內環境訊號分別準備RNA轉錄本。這種剪接是由菲利普·夏普和理查德·J·羅伯茨在1977年發現的。
操縱子是基因組材料的功能單位,包含一個基因簇,受單個調控訊號或啟動子的控制。這些基因一起轉錄成一個 mRNA 鏈,並在細胞質中一起翻譯,或者進行轉剪接以建立單順反子 mRNA,這些 mRNA 被單獨翻譯,即幾個 mRNA 鏈,每個鏈編碼一個單一的基因產物。其結果是操縱子中包含的基因要麼一起表達,要麼根本不表達。幾個基因必須同時轉錄和共調節以定義一個操縱子。最初認為操縱子只存在於原核生物中,但自從 1990 年代初在真核生物中發現第一個操縱子以來,越來越多的證據表明它們比以前認為的更常見。
操縱子主要存在於原核生物中,但也存在於一些真核生物中,包括線蟲,如秀麗隱杆線蟲,以及果蠅。 rRNA 基因通常存在於操縱子中,這些操縱子已在包括脊索動物在內的多種真核生物中被發現。操縱子由多個結構基因組成,這些基因排列在一個共同的啟動子下,並受一個共同的操縱子的調節。它被定義為一組相鄰的結構基因,加上影響結構基因轉錄的相鄰調控訊號。給定操縱子的調控因子,包括阻遏物、共阻遏物和啟用物,不一定由該操縱子編碼。調控因子、啟動子、操縱子和結構 DNA 序列的位置和條件可以決定常見突變的影響。操縱子與調節子、刺激子和調控子相關。操縱子包含一組受相同操縱子調節的基因,而調節子包含一組受單個調控蛋白調節的基因,刺激子包含一組受單個細胞刺激調節的基因。[5]
操縱子的結構
[edit | edit source]啟動子 - 使基因能夠被轉錄的核苷酸序列。啟動子被 RNA 聚合酶識別,然後啟動轉錄。在 RNA 合成中,啟動子指示哪些基因應該用於信使 RNA 的建立 - 並且,透過擴充套件,控制細胞製造哪些蛋白質。
操縱子 - DNA 片段,調控因子與之結合。它在乳糖操縱子中被經典地定義為啟動子和操縱子基因之間的片段。在阻遏物的情況下,阻遏蛋白在物理上阻止 RNA 聚合酶轉錄基因。
結構基因 - 由操縱子共調節的基因。
原核生物啟動子
[edit | edit source]在原核生物中,啟動子包含兩個短序列,分別位於轉錄起始位點上游的 -10 和 -35 位置。σ因子不僅有助於增強 RNAP 與啟動子的結合,還有助於 RNAP 靶向特定基因進行轉錄。-10 的序列稱為 Pribnow 盒,或 -10 元件,通常由六個核苷酸 TATAAT 組成。Pribnow 盒對於啟動原核生物中的轉錄至關重要。-35 處的另一個序列(-35 元件)通常由七個核苷酸 TTGACAT 組成。它的存在允許非常高的轉錄速率。上述兩個共有序列,雖然平均而言是保守的,但在大多數啟動子中並沒有完整地找到。平均而言,在每個共有序列中只有 6 個鹼基對中的 3 個在任何給定的啟動子中被發現。迄今為止,尚未發現任何啟動子在 -10 和 -35 處都具有完整的共有序列;發現具有 -10/-35 六聚體的完全保守性的合成啟動子以非常高的效率促進 RNA 鏈起始。一些啟動子包含一個 UP 元件(共有序列 5'-AAAWWTWTTTTNNNAAANNN-3';W = A 或 T;N = 任何鹼基),以 -50 為中心;-35 元件的存在似乎對於來自 UP 元件包含的啟動子的轉錄並不重要。應該注意的是,上述啟動子序列僅被與原核生物 RNA 聚合酶相互作用的 σ-70 蛋白識別。原核生物 RNA 聚合酶與其他 σ 因子的複合物識別完全不同的核心啟動子序列。
<-- upstream downstream -->
5'-XXXXXXXPPPPPXXXXXXPPPPPPXXXXGGGCCGGGTTGGTTGGGCCGAAGGGTTGGCCGGGGGGGGXXXX-3'
-35 -10 Gene to be transcribed
真核生物啟動子
[edit | edit source]真核生物啟動子極其多樣,難以表徵。它們通常位於基因上游,並且可以具有距離轉錄起始位點幾千個鹼基對的調控元件(增強子)。在真核生物中,轉錄複合物可以導致 DNA 彎曲回到自身,這使得調控序列可以放置在遠離實際轉錄位點的區域。許多真核生物啟動子,在所有基因中佔 10% 到 20%,包含一個TATA 盒(序列 TATAAA),進而結合一個TATA 結合蛋白,它有助於形成RNA 聚合酶轉錄複合物。TATA 盒通常位於非常靠近轉錄起始位點的區域(通常在 50 個鹼基對內)。
真核生物啟動子調控序列通常結合稱為轉錄因子的蛋白質,這些蛋白質參與轉錄複合物的形成。一個例子是E 盒(序列 CACGTG),它與鹼性螺旋-環-螺旋(bHLH)家族(例如BMAL1-Clock、cMyc)中的轉錄因子結合。
增強子
[edit | edit source]增強子是 DNA 的一個短區域,可以與蛋白質(即順式作用因子,非常像一組轉錄因子)結合,以增強基因簇中基因的轉錄水平(因此得名)。雖然增強子通常是順式作用的,但增強子不需要特別靠近它作用的基因,也不需要位於同一條染色體上。
在真核細胞中,DNA 的染色質複合體的結構以一種功能上模擬原核生物 DNA 特徵的超螺旋狀態的方式摺疊,因此,儘管增強子 DNA 在核苷酸數量方面遠離基因,但它在幾何上靠近啟動子和基因。這使它能夠與通用轉錄因子和 RNA 聚合酶 II 相互作用。增強子可以位於其調控的基因的上游或下游。
此外,增強子不需要位於靠近轉錄起始位點的位置以影響基因的轉錄,因為一些增強子被發現結合在起始位點上游或下游數十萬個鹼基對處。增強子本身並不作用於啟動子區域,而是被啟用蛋白結合。這些啟用蛋白與介質複合物相互作用,介質複合物招募聚合酶 II 和通用轉錄因子,然後開始轉錄基因。增強子也可以存在於內含子中。增強子的方向甚至可以反轉,而不會影響其功能。此外,增強子可以被切除並插入染色體的其他位置,並且仍然影響基因轉錄。這就是為什麼內含子多型性被檢查,儘管它們沒有被翻譯。
共阻遏物
[edit | edit source]共阻遏物是一種蛋白質,透過與包含 DNA 結合域的轉錄因子結合來降低基因表達。共阻遏物本身無法結合 DNA。共阻遏物可以透過招募組蛋白脫乙醯酶來抑制轉錄起始,組蛋白脫乙醯酶催化從賴氨酸殘基去除乙醯基。這增加了組蛋白的正電荷,從而增強了組蛋白與 DNA 之間的相互作用,使後者難以被轉錄。
核糖開關
[edit | edit source]在分子生物學中,核糖開關是 mRNA 分子的一部分,它可以直接結合一個小分子靶標,並且結合靶標會影響基因的活性。因此,包含核糖開關的 mRNA 直接參與調節自身的活性,以響應其靶標分子的濃度。現代生物體利用 RNA 結合小分子,並區分密切相關的類似物這一發現,顯著擴充套件了人們對 RNA 天然能力的認識,超出了其編碼蛋白質或結合其他 RNA 或蛋白質大分子的能力。該術語“核糖開關”的最初定義規定了它們直接感知小分子代謝物的濃度。雖然此定義仍然在普遍使用中,但一些生物學家使用更廣泛的定義,包括其他順式調控 RNA。但是,本文將只討論代謝物結合核糖開關。大多數已知的核糖開關存在於細菌中,但已在植物和某些真菌中發現了型別為 TPP 核糖開關的功能性核糖開關。TPP 核糖開關也被預測存在於古細菌中,但尚未經過實驗驗證。[6]
lac 操縱子是大腸桿菌和其他一些腸桿菌中運輸和代謝乳糖所需的操縱子。它包含三個相鄰的結構基因,lacZ、lacY 和 lacA。lac 操縱子受多種因素調節,包括葡萄糖和乳糖的可用性。lac 操縱子的基因調控是第一個被闡明的複雜遺傳調控機制,也是原核生物基因調控的最主要例子之一。
在自然環境中,lac 操縱子允許有效消化乳糖。細胞可以透過產生酶β-半乳糖苷酶來將乳糖消化成葡萄糖和半乳糖,從而利用乳糖作為能源。然而,在沒有乳糖的情況下或存在更易獲得的能量來源(如葡萄糖)的情況下,產生酶將是低效的。lac 操縱子使用兩部分控制機制來確保細胞只有在必要時才消耗能量來產生β-半乳糖苷酶、β-半乳糖苷通透酶和硫代半乳糖苷轉乙醯酶(也稱為半乳糖苷 O-乙醯基轉移酶)。它透過lac 阻遏蛋白來實現這一點,lac 阻遏蛋白在沒有乳糖的情況下阻止生產,以及分解代謝啟用蛋白(CAP),它在沒有葡萄糖的情況下協助生產。這種雙重控制機制導致葡萄糖和乳糖在兩個不同的生長階段(稱為雙營養生長)中被依次利用。類似的雙營養生長模式已在細菌在其他糖混合物上的生長中觀察到,例如葡萄糖和木糖,或葡萄糖和阿拉伯糖等的混合物。這種雙營養生長模式背後的遺傳控制機制被稱為xyl 操縱子和ara 操縱子等。[7] 乳糖操縱子包含三個結構基因,以及一個啟動子、一個終止子、一個調節器和一個操縱元。
三個結構基因是:lacZ、lacY 和 lacA。
lacZ 編碼β-半乳糖苷酶(LacZ),一種將二糖乳糖裂解成葡萄糖和半乳糖的細胞內酶。
lacY 編碼β-半乳糖苷通透酶(LacY),一種將乳糖泵入細胞的膜結合轉運蛋白。
lacA 編碼β-半乳糖苷轉乙醯酶(LacA),一種將乙醯基從乙醯輔酶 A 轉移到β-半乳糖苷的酶。
只有 lacZ 和 lacY 似乎是乳糖分解代謝所必需的。

乳糖阻遏蛋白於 1966 年首次由沃爾特·吉爾伯特和本諾·穆勒-希爾分離出來。他們在體外證明了該蛋白質結合了含有乳糖操縱子的 DNA,並在新增 IPTG 後釋放了 DNA。(IPTG 是一種異乳糖類似物。)他們還能夠透過使用脫氧核糖核酸酶來分離由蛋白質結合的 DNA 部分,脫氧核糖核酸酶會分解 DNA。在處理阻遏蛋白-DNA 複合物後,一些 DNA 保留下來,表明它已被阻遏蛋白掩蓋。這後來得到了證實。這些實驗很重要,因為它們證實了乳糖操縱子的機制,該機制之前由雅克·莫諾和弗朗索瓦·雅各布提出。乳糖阻遏蛋白的結構包含三個不同的區域
一個核心區域(結合異乳糖)一個四聚化區域(將四個單體連線在一個α-螺旋束中)一個 DNA 結合區域(其中兩個 LacI 蛋白結合單個操縱元位點)乳糖阻遏蛋白以四聚體(四個相同的亞基結合在一起)的形式存在。這可以看作是兩個二聚體,每個二聚體能夠結合到單個乳糖操縱元上。兩個亞基分別結合到操縱元中稍微分離的(主溝)區域。啟動子被乳糖阻遏蛋白稍微覆蓋,因此 RNA 聚合酶無法結合並轉錄操縱子。DNA 結合區域包含一個螺旋-轉角-螺旋結構基序。可在蛋白質百科中找到阻遏蛋白結構(一些與 DNA 結合)的互動式、旋轉 3D 檢視,包括其如何彎曲 DNA 雙螺旋的變形。乳糖阻遏蛋白 (LacI) 透過結合到乳糖操縱子操縱元區域的主溝來發揮作用。這會阻止 RNA 聚合酶結合,從而阻止編碼 Lac 蛋白的 mRNA 的轉錄。當存在乳糖時,異乳糖會結合到乳糖阻遏蛋白上,導致其形狀發生變構變化。在這種變化狀態下,乳糖阻遏蛋白無法結合到其同源操縱元上。
乳糖基因及其衍生物可以作為報告基因用於多種基於細菌的選擇技術,例如雙雜交分析,其中必須確定轉錄啟用因子與特定啟動子序列的成功結合。在含有 X-gal 的 LB 平板上,菌落顏色從白色變為藍色對應於大約 20-100 個β-半乳糖苷酶單位,而四氮唑乳糖和麥康凱乳糖培養基的範圍為 100-1000 個單位,分別在該範圍的高階和低端最敏感。由於麥康凱乳糖和四氮唑乳糖培養基都依賴於乳糖分解的產物,因此它們需要 lacZ 和 lacY 基因的存在。因此,許多僅包含 lacZ 基因的乳糖融合技術適用於 X-gal 平板或 ONPG 液體培養基。[8]
色氨酸操縱子是一個操縱子——一組一起使用或轉錄的基因——它編碼生產色氨酸的成分。色氨酸操縱子存在於許多細菌中,但最初是在大腸桿菌中被表徵的。它受到調節,以便當環境中存在色氨酸時,它不會被使用。它是一個重要的實驗系統,用於學習基因調控,並且通常用於教授基因調控。
色氨酸操縱子於 1953 年由雅克·莫諾及其同事發現,是第一個被發現的可阻遏操縱子。雖然乳糖操縱子可以被一種化學物質(異乳糖)啟用,但色氨酸(Trp)操縱子會被一種化學物質(色氨酸)抑制。該操縱子包含五個結構基因:trp E、trp D、trp C、trp B 和 trp A,它們編碼色氨酸合酶。它還包含一個啟動子,該啟動子與 RNA 聚合酶結合,以及一個操縱元,該操縱元在與阻遏基因(trp R)合成的蛋白質結合時會阻止轉錄,該蛋白質會結合到操縱元上。在乳糖操縱子中,異乳糖會結合到阻遏蛋白上,允許基因轉錄,而在色氨酸操縱子中,色氨酸會結合到阻遏蛋白上,有效地阻止基因轉錄。在這兩種情況下,阻遏都是對 RNA 聚合酶轉錄操縱子中基因的阻遏。與乳糖操縱子不同,色氨酸操縱子還包含一個引導肽和一個衰減子序列,這允許分級調節。
它是基因表達負調控的一個例子。在操縱子的調控序列中,操縱元在存在色氨酸的情況下被阻遏蛋白阻斷(從而阻止轉錄),並在色氨酸不存在的情況下被釋放(從而允許轉錄)。衰減過程補充了這種調控作用。[9]
模式細菌大腸桿菌的L-阿拉伯糖操縱子是分子生物學研究的重點領域已有40多年,並在遺傳、生化、生理和生物物理學層面進行了廣泛研究。它受雙重正負系統控制。有3個結構基因:araB、araA和araD。它們編碼分解單糖阿拉伯糖為D-木酮糖-5-磷酸的代謝酶,然後透過戊糖磷酸途徑代謝。包含操縱子位點和啟動子的起始區稱為araI(araI的最後一個字母是大寫字母“i”)。在該位點附近是araC基因,它編碼一個阻遏蛋白。AraC蛋白結合到起始區araI。
管家基因通常是構成型基因,對於維持基本的細胞功能是必需的,存在於所有的人類細胞中。雖然一些管家基因以相對恆定的水平表達(如HSP90和β-肌動蛋白),但其他管家基因可能會根據實驗條件而變化。術語“管家基因”的起源仍然不清楚。1976年的文獻使用該術語專門描述tRNA和rRNA。解釋基因表達資料可能存在問題,大多數人類基因在每個細胞中註冊5-10個複製(可能代表誤差)。管家基因在每個細胞中至少表達25個複製,有時數量達到數千個。
基因表達的調控是指對基因功能產物數量和出現時間的控制。表達控制對於細胞在需要時產生所需的基因產物至關重要;反過來,這使細胞能夠靈活地適應可變環境、外部訊號、細胞損傷等。基因表達重要的簡單例子包括
控制胰島素表達,使其發出訊號以調節血糖
雌性哺乳動物中X染色體的失活,以防止其所含基因的“過量表達”。
細胞週期蛋白表達水平控制真核細胞週期程序
更一般地說,基因調控使細胞能夠控制所有結構和功能,是細胞分化、形態發生以及任何生物體多功能性和適應性的基礎。基因表達的任何步驟都可以進行調節,從DNA-RNA轉錄步驟到蛋白質的翻譯後修飾。最終基因產物(無論是RNA還是蛋白質)的穩定性也影響基因的表達水平——不穩定的產物會導致低表達水平。一般來說,基因表達是透過改變影響DNA轉錄和RNA翻譯的分子之間相互作用的數量和型別的變化來調節的。根據基因的調節方式,有許多術語用於描述基因型別,這些術語包括:構成型基因是指與兼性基因相比,持續轉錄的基因,兼性基因僅在需要時轉錄。管家基因通常是構成型基因,以相對恆定的水平轉錄。管家基因的產物通常是維持細胞所必需的。一般認為它們的表達不受實驗條件的影響。例子包括肌動蛋白、GAPDH和泛素。兼性基因是指與構成型基因相比,僅在需要時轉錄的基因。誘導型基因是指其表達對環境變化有反應或依賴於細胞週期中位置的基因。[10]
轉錄調控 轉錄調控可以細分為三個主要的影響途徑;遺傳(控制因子與基因的直接相互作用)、調節(控制因子與轉錄機制的相互作用)和表觀遺傳(DNA結構的非序列變化,影響轉錄)。
λ阻遏蛋白轉錄因子(綠色)以二聚體形式結合到DNA靶標(紅色和藍色)的主要溝,並停用轉錄起始。來自PDB 1LMB。與DNA的直接相互作用是蛋白質改變轉錄水平的最簡單、最直接的方法。基因通常在其編碼區的周圍具有多個蛋白質結合位點,這些位點具有調節轉錄的特定功能。已知許多型別的調控DNA結合位點,如增強子、絕緣子、阻遏子和沉默子。調節轉錄的機制多種多樣,從阻斷RNA聚合酶在DNA上的關鍵結合位點,到充當啟用劑並透過幫助RNA聚合酶結合來促進轉錄。轉錄因子的活性還受到細胞內訊號的進一步調節,導致蛋白質翻譯後修飾,包括磷酸化、乙醯化或糖基化。這些變化會影響轉錄因子直接或間接結合啟動子DNA、招募RNA聚合酶或有利於新合成RNA分子的延伸的能力。真核生物中的核膜允許透過轉錄因子的核記憶體在時間來進一步調節轉錄因子,這種存在時間受其結構可逆變化以及其他蛋白質的結合的調節。環境刺激或內分泌訊號可能會引起調控蛋白的修飾,引發細胞內訊號級聯反應,最終導致基因表達的調控。最近,越來越明顯的是,非DNA序列特異性效應對翻譯有巨大影響。這些效應被稱為表觀遺傳學,涉及DNA的高階結構、非序列特異性DNA結合蛋白以及DNA的化學修飾。一般來說,表觀遺傳效應改變了DNA對蛋白質的可及性,因此調節轉錄。
在真核生物中,DNA以核小體的形式組織。注意DNA(藍色和綠色)是如何緊緊地包裹在由組蛋白八聚體(帶狀線圈)構成的蛋白質核心周圍的,限制了對DNA的訪問。來自PDB 1KX5。DNA甲基化是表觀遺傳學影響基因表達的普遍機制,存在於細菌和真核生物中,在可遺傳的轉錄沉默和轉錄調控中發揮作用。在真核生物中,染色質的結構受組蛋白密碼控制,調節對DNA的訪問,對常染色質和異染色質區域中基因的表達有重大影響。
轉錄後調控
在真核生物中,由於RNA的轉運是翻譯的必要條件,因此核轉運被認為提供了對基因表達的額外控制。所有進出核的轉運都是透過核孔進行的,轉運受多種進出口蛋白的控制。編碼蛋白質的基因的表達只有在攜帶密碼的信使RNA存活足夠長的時間以被翻譯的情況下才有可能。在一個典型的細胞中,一個RNA分子只有在被專門保護免受降解的情況下才穩定。RNA降解在真核細胞的表達調控中具有特殊的重要性,在真核細胞中,mRNA必須在被翻譯之前長距離移動。在真核生物中,RNA透過某些轉錄後修飾而穩定,特別是5'帽子和聚腺苷酸化尾。有意降解mRNA不僅用作防禦機制,防止外源RNA(通常來自病毒),而且也是mRNA去穩定化的途徑。如果一個mRNA分子與一個小的干擾RNA具有互補序列,那麼它就會透過RNA干擾途徑被靶向降解。
翻譯調控
新黴素是減少所有蛋白質基因表達的小分子,它不可避免地導致細胞死亡,因此具有抗生素的作用。
直接調節翻譯不如轉錄或mRNA穩定性的控制普遍,但偶爾也會使用。抑制蛋白質翻譯是毒素和抗生素的主要靶標,目的是透過覆蓋其正常的基因表達控制來殺死細胞。蛋白質合成抑制劑包括抗生素新黴素和毒素蓖麻毒素。蛋白質降解
蛋白質合成完成後,可以透過蛋白質降解來降低該蛋白質的表達水平。在所有原核生物和真核生物中都存在主要的蛋白質降解途徑,其中蛋白酶體是共同的組成部分。不需要或受損的蛋白質通常透過新增泛素來標記降解。
基因工程中使用的質粒被稱為載體。質粒是遺傳學和生物技術實驗室的重要工具,它們通常用於複製(製作特定基因的許多副本)或表達特定基因。許多質粒可用於此類用途。要複製的基因被插入到包含使細胞對特定抗生素具有抗性的基因和多克隆位點(MCS 或多連線體)的質粒副本中,該位點是一個包含幾個常用限制性酶切位點的短區域,允許輕鬆地將 DNA 片段插入此位置。 接下來,質粒透過稱為轉化的方法插入細菌。然後,細菌暴露於特定的抗生素。只有吸收了質粒副本的細菌才能存活,因為質粒使它們具有抗性。特別是,保護基因被表達(用於製造蛋白質),表達的蛋白質分解抗生素。透過這種方式,抗生素充當過濾器,僅選擇修飾過的細菌。現在,這些細菌可以在大量培養、收穫和裂解(通常使用鹼性裂解法)以分離感興趣的質粒。質粒的另一個主要用途是製造大量蛋白質。在這種情況下,研究人員培養含有包含感興趣基因的質粒的細菌。正如細菌產生蛋白質以賦予其抗生素抗性一樣,它也可以被誘導產生大量來自插入基因的蛋白質。這是一種廉價且簡單的大規模生產基因或其編碼的蛋白質的方法,例如胰島素甚至抗生素。但是,質粒只能包含約 1-10 kbp 的插入片段。為了克隆更長的 DNA 片段,可以使用刪除了溶源基因的 λ 噬菌體、柯斯質粒、細菌人工染色體或酵母人工染色體。 [11]
現代載體可能包含除轉基因插入片段和骨架之外的其他特徵:啟動子:所有載體的必要組成部分:用於驅動載體轉基因的轉錄。
遺傳標記:病毒載體的遺傳標記可以確認載體是否已整合到宿主基因組 DNA 中。
抗生素抗性:具有抗生素抗性開放閱讀框的載體允許在含有抗生素的培養基中透過抗生素選擇,吸收了載體的細胞存活。
表位:載體包含特定表位的序列,該序列被整合到表達的蛋白質中。允許抗體識別表達目標蛋白質的細胞。
β-半乳糖苷酶:一些載體包含 β-半乳糖苷酶的序列,β-半乳糖苷酶是一種消化半乳糖的酶,其中包含多克隆位點(基因可能被插入的區域)。成功連線到載體的插入片段將破壞 β-半乳糖苷酶基因並使半乳糖消化失效。包含載體插入片段的細胞可以使用藍白篩選來識別,方法是在含有半乳糖類似物(X-gal)的培養基中培養細胞。表達 β-半乳糖苷酶(因此不包含插入片段)的細胞表現為藍色菌落。白色菌落將被選擇為可能包含插入片段的菌落。其他可能類似於報告基因的功能的蛋白質包括綠色熒光蛋白和熒光素酶。
靶向序列:表達載體可能包含在最終蛋白質中編碼靶向序列,該序列將表達的蛋白質引導至細胞中的特定細胞器或特定位置,例如細菌的周質空間。
蛋白質純化標籤:一些表達載體包含蛋白質或肽序列,這些序列允許更容易地純化表達的蛋白質。示例包括多組氨酸標籤、谷胱甘肽-S-轉移酶和麥芽糖結合蛋白。這些標籤中的一些還可以增加目標蛋白質的溶解度。目標蛋白質與蛋白質標籤融合,但在蛋白質和標籤之間的多肽連線體區域定位的蛋白酶裂解位點允許後來去除標籤。柯斯質粒 柯斯質粒主要是帶有細菌 oriV、抗生素選擇標記和克隆位點的質粒,但它們帶有來自 λ 噬菌體的 1 個或最近 2 個 cos 位點。根據實驗的具體目標,可以獲得廣宿主範圍柯斯質粒、穿梭柯斯質粒或“哺乳動物”柯斯質粒(與 SV40 oriV 和哺乳動物選擇標記相關)。柯斯質粒的負載能力取決於載體本身的大小,但通常在 40-45 kb 左右。克隆程式涉及生成兩個載體臂,然後將其與外源 DNA 連線。針對野生型柯斯質粒 DNA 的選擇簡單地透過尺寸排阻來完成。然而,柯斯質粒始終形成菌落,而不是噬菌斑。此外,克隆密度要低得多,每 µg 連線的 DNA 約為 105 - 106 個 CFU。在構建重組 λ 或柯斯質粒文庫後,將總 DNA 透過稱為體外包裝的技術轉移到合適的 E.coli 宿主中。必要的包裝提取物來自 E.coli cI857 溶源體(分別為 red- gam- Sam 和 Dam(頭部組裝)和 Eam(尾部組裝))。這些提取物將識別和體外包裝重組分子,產生成熟的噬菌體顆粒(基於 λ 的載體)或包含在噬菌體外殼中的重組質粒(柯斯質粒)。這些差異反映在支援 λ 替代載體的不同感染頻率中。這彌補了它們略低的負載能力。噬菌體文庫也比柯斯質粒(菌落!)文庫更容易儲存和篩選。目標 DNA:要克隆的基因組 DNA 必須切割成適當大小範圍的限制性片段。這通常透過部分限制性酶切,然後進行尺寸分餾或去磷酸化(使用小腸鹼性磷酸酶)來完成,以避免染色體混雜,即物理上沒有關聯的片段的連線。Fosmids Fosmids 類似於柯斯質粒,但基於細菌 F-質粒。克隆載體受到限制,因為宿主(通常是 E.coli)只能包含一個 fosmid 分子。Fosmids 是 40 kb 的隨機基因組 DNA。Fosmid 文庫從目標生物的基因組中製備,並克隆到 fosmid 載體中。低複製數比同等的高複製數柯斯質粒具有更高的穩定性。Fosmid 系統可能有助於構建來自複雜基因組的穩定文庫。Fosmid 克隆被用來幫助評估公共人類基因組序列的準確性。
細菌人工染色體 (BAC) 細菌人工染色體 (BAC) 是一種基於功能性生育質粒 (或 F-質粒) 的 DNA 結構,用於細菌(通常是 E.coli)中的轉化和克隆。F-質粒發揮著至關重要的作用,因為它們包含促進細菌細胞分裂後質粒均勻分佈的分隔基因。細菌人工染色體的通常插入片段大小為 150-350 kbp,但可以大於 700 kbp。一種類似的克隆載體稱為 PAC,也已經從細菌 P1-質粒中產生。BAC 通常用於基因組專案中對生物體的基因組進行測序,例如人類基因組專案。生物體的 DNA 的一小段被放大作為插入片段,然後在 BAC 中進行測序。最後,對測序的部分進行計算機模擬,從而得到生物體的基因組序列。
酵母人工染色體 (YAC) 酵母人工染色體 (YAC) 是一種用於克隆大於 100 kb 且高達 3000 kb 的 DNA 片段的載體。YAC 有助於複雜基因組的物理作圖和大型基因的克隆。YAC 由 Murray 和 Szostak 於 1983 年首次描述,它是一種人工構建的染色體,包含在酵母細胞中複製和儲存所需的端粒、著絲粒和複製起點序列。YAC 是使用一個初始的環狀質粒構建的,該質粒通常使用限制性酶切割成兩個線性分子;然後使用 DNA 連線酶將感興趣的序列或基因連線到兩個線性分子之間,形成一個大的線性 DNA 片段。[需要引用] 酵母表達載體(如 YAC、YIps(酵母整合質粒)和 YEps(酵母附加型質粒))比細菌人工染色體 (BAC) 具有優勢,因為它們可以用於表達需要翻譯後修飾的真核蛋白質。然而,已經發現 YAC 比 BAC 穩定性差,會產生嵌合效應。
病毒載體的型別
逆轉錄病毒
逆轉錄病毒是當前基因治療方法的主要支柱之一。重組逆轉錄病毒(如莫洛尼鼠白血病病毒)能夠以穩定的方式整合到宿主基因組中。它們包含一個逆轉錄酶,該酶允許整合到宿主基因組中。它們已用於許多 FDA 批准的臨床試驗,例如 SCID-X1 試驗。逆轉錄病毒載體可以是複製competent或複製defective的。複製defective載體是研究中最常見的選擇,因為病毒已經具有編碼額外輪次病毒體複製和包裝所需的基因的編碼區,這些編碼區被其他基因取代或刪除。這些病毒能夠感染其目標細胞並遞送其病毒載荷,但隨後無法繼續典型的裂解途徑,該途徑導致細胞裂解和死亡。相反,複製competent病毒載體包含病毒體合成所需的所有必要基因,並且一旦感染髮生就會繼續繁殖。由於這些載體的病毒基因組要長得多,因此與複製defective載體的插入片段可能長度相比,實際插入的感興趣基因的長度受到限制。根據病毒載體的不同,複製defective病毒載體中允許的 DNA 插入片段的典型最大長度通常約為 8-10 kB。雖然這限制了許多基因組序列的引入,但大多數 cDNA 序列仍然可以容納。使用莫洛尼逆轉錄病毒等逆轉錄病毒的主要缺點是需要細胞積極分裂才能進行轉導。因此,神經元等細胞對逆轉錄病毒的感染和轉導具有很強的抵抗力。人們擔心由於整合到宿主基因組中而引起的插入突變可能導致癌症或白血病。
慢病毒
慢病毒是逆轉錄病毒的一個亞類。由於它們能夠整合到非分裂細胞的基因組中,近年來它們被用作基因傳遞載體(載體)。這是慢病毒的獨特特性,因為其他逆轉錄病毒只能感染分裂細胞。當病毒進入細胞時,以 RNA 形式存在的病毒基因組被逆轉錄為 DNA,然後由病毒整合酶在基因組的隨機位置插入。該載體現在被稱為前病毒,它保留在基因組中,並在細胞分裂時傳遞給子代細胞。整合位點是不可預測的,這可能是一個問題。前病毒可能干擾細胞基因的功能,並導致癌基因的啟用,從而促進癌症的發展,這引起了人們對慢病毒在基因治療中可能應用的擔憂。然而,研究表明,與 γ-逆轉錄病毒載體相比,慢病毒載體在可能導致癌症的位置整合的可能性更低。更具體地說,一項研究發現,在腫瘤發生率高得多的鼠系中,慢病毒載體既不會導致腫瘤發生率增加,也不會導致腫瘤早期發生。此外,利用慢病毒載體將基因治療用於治療 HIV 的臨床試驗中,沒有出現致突變或致癌事件的增加。出於安全原因,慢病毒載體從不攜帶它們複製所需的基因。為了產生慢病毒,將幾種質粒轉染到所謂的包裝細胞系中,通常是 HEK 293。一個或多個質粒,通常被稱為包裝質粒,編碼病毒蛋白,例如衣殼蛋白和逆轉錄酶。另一個質粒包含要由載體傳遞的遺傳物質。它被轉錄產生單鏈 RNA 病毒基因組,並以 ψ(psi)序列的存在為標誌。該序列用於將基因組包裝到病毒顆粒中。
腺病毒
與慢病毒相反,腺病毒 DNA 不整合到基因組中,也不在細胞分裂過程中複製。這限制了它們在基礎研究中的應用,儘管腺病毒載體偶爾用於體外實驗。它們的主要應用是基因治療和疫苗接種。由於人類通常會接觸到腺病毒,腺病毒會導致呼吸道、胃腸道和眼部感染,因此它們會引發快速免疫反應,並可能造成危險後果。為了克服這個問題,科學家們目前正在研究人類沒有免疫力的腺病毒。
腺相關病毒
腺相關病毒 (AAV) 是一種感染人類和其他一些靈長類動物的小病毒。目前尚不清楚 AAV 會引起疾病,因此該病毒引起的免疫反應非常輕微。AAV 可以感染分裂和非分裂細胞,並可能將其基因組整合到宿主細胞的基因組中。這些特性使 AAV 成為建立用於基因治療的病毒載體的非常有吸引力的候選者。

PCR
[edit | edit source]PCR 用於擴增 DNA 鏈的特定區域(DNA 目標)。大多數 PCR 方法通常擴增不超過 ~10 千鹼基對 (kb) 的 DNA 片段,儘管有些技術允許擴增高達 40 kb 的片段。基本的 PCR 設定需要幾個元件和試劑。這些元件包括
包含要擴增的 DNA 區域(目標)的 DNA 模板。
兩個引物,分別與 DNA 目標的正義鏈和反義鏈的 3'(三素)端互補。Taq 聚合酶或其他 DNA 聚合酶,其最佳溫度約為 70 °C。脫氧核苷三磷酸 (dNTP),DNA 聚合酶合成新 DNA 鏈的構建塊。緩衝溶液,為 DNA 聚合酶提供最佳活性及穩定性的適當化學環境。二價陽離子,鎂或錳離子;通常使用 Mg2+,但 Mn2+ 可用於 PCR 介導的 DNA 誘變,因為更高的 Mn2+ 濃度會提高 DNA 合成過程中的錯誤率。一價陽離子鉀離子。PCR 通常在熱迴圈儀的小反應管(0.2–0.5 ml 體積)中,在 10–200 μl 的反應體積中進行。熱迴圈儀加熱和冷卻反應管,以在反應的每個步驟中實現所需的溫度(見下文)。許多現代熱迴圈儀利用珀耳帖效應,透過簡單地反轉電流即可實現保持 PCR 管的塊的加熱和冷卻。薄壁反應管允許良好的熱傳導,從而實現快速熱平衡。大多數熱迴圈儀都有加熱蓋,以防止反應管頂部的冷凝。缺少加熱蓋的較舊熱迴圈儀需要在反應混合物頂部新增一層油或在管內新增一塊蠟。[12]
步驟
圖 1:PCR 迴圈的示意圖。 (1) 在 94–96 °C 下變性。 (2) 在 ~65 °C 下退火 (3) 在 72 °C 下延伸。此處顯示了四個迴圈。藍線代表 DNA 模板,引物(紅色箭頭)與其退火,並由 DNA 聚合酶(淺綠色圓圈)延伸,得到更短的 DNA 產物(綠色線),這些產物本身在 PCR 進行時用作模板。通常,PCR 包含一系列 20-40 次重複的溫度變化,稱為迴圈,每個迴圈通常包含 2-3 個離散的溫度步驟,通常是三個。迴圈通常以單個溫度步驟(稱為保持)在高溫 (>90 °C) 下進行,並在最後以一個保持結束,用於最終產物延伸或短暫儲存。使用的溫度以及它們在每個迴圈中應用的時間長度取決於各種引數。這些包括用於 DNA 合成的酶、反應中二價離子和 dNTP 的濃度以及引物的熔解溫度 (Tm)。初始化步驟:此步驟包括將反應加熱到 94–96 °C(或如果使用極其耐熱聚合酶,則為 98 °C),並保持 1–9 分鐘。它僅適用於需要透過熱啟動 PCR 進行熱啟用的 DNA 聚合酶。變性步驟:這是第一個常規迴圈事件,包括將反應加熱到 94–98 °C,持續 20–30 秒。它透過破壞互補鹼基之間氫鍵引起 DNA 模板的熔解,從而產生單鏈 DNA 分子。退火步驟:將反應溫度降低到 50–65 °C,持續 20–40 秒,允許引物與單鏈 DNA 模板退火。通常,退火溫度比所用引物的 Tm 低約 3-5 攝氏度。穩定的 DNA-DNA 氫鍵僅在引物序列與模板序列非常匹配時才會形成。聚合酶與引物-模板雜交體結合,並開始 DNA 合成。延伸/延長步驟:此步驟的溫度取決於所使用的 DNA 聚合酶;Taq 聚合酶的最佳活性溫度為 75–80 °C,並且通常使用該酶時使用 72 °C 的溫度。在此步驟中,DNA 聚合酶透過新增與模板互補的 dNTP 來合成與 DNA 模板鏈互補的新 DNA 鏈,以 5' 到 3' 的方向,將 dNTP 的 5'-磷酸基團與新生(延伸)DNA 鏈末端的 3'-羥基縮合。延長時間取決於所使用的 DNA 聚合酶和要擴增的 DNA 片段的長度。作為一個經驗法則,在其最佳溫度下,DNA 聚合酶每分鐘將聚合 1000 個鹼基。在最佳條件下,即如果不存在由限制性底物或試劑造成的限制,在每個延伸步驟中,DNA 目標的數量都會翻倍,導致特定 DNA 片段的指數(幾何)擴增。最終延伸:此單個步驟偶爾在最後一個 PCR 迴圈後在 70–74 °C 的溫度下進行 5–15 分鐘,以確保任何剩餘的單鏈 DNA 完全延伸。[13]最終保持:此步驟在 4–15 °C 的溫度下進行無限時間,可用於短期儲存反應。
為了檢查 PCR 是否生成了預期的 DNA 片段(有時也稱為擴增子或擴增產物),採用瓊脂糖凝膠電泳對 PCR 產物進行大小分離。PCR 產物的大小透過與 DNA 梯度(分子量標記)進行比較來確定,DNA 梯度包含已知大小的 DNA 片段,與 PCR 產物一起在凝膠上執行。
限制性內切酶
[edit | edit source]限制性內切酶識別特定的核苷酸序列,並在 DNA 中產生雙鏈切割。雖然識別序列在 4 到 8 個核苷酸之間變化,但其中許多是 迴文,對應於從前到後讀取相同的氮鹼基序列。[14] 理論上,DNA 中可能存在兩種型別的迴文序列。映象迴文類似於普通文字中發現的迴文,其中一個序列在同一 DNA 鏈(即單鏈)上前後讀取相同,例如 GTAATG。反向重複迴文也是一個序列,前後讀取相同,但前後序列在互補的 DNA 鏈(即雙鏈)中找到,例如 GTATAC(注意,GTATAC 與 CATATG 互補)。[15] 反向重複比映象重複更常見,並且具有比映象重複更大的生物學意義。
5'-GTATAC-3' :::::: 3'-CATATG-5' |
| 迴文識別位點在反向鏈上的讀取方式與在正向鏈上的讀取方式相同 |
EcoRI 酶切產生“粘性”末端,
而 SmaI 限制性內切酶切割產生“平 blunt”末端。
每個限制性內切酶的 DNA 識別序列不同,導致酶切產生的片段長度、序列和鏈方向(5' 端 或 3' 端)的“粘性末端”懸垂不同。 [16]
識別相同序列的不同限制性內切酶被稱為 同源異裂酶。它們通常在序列的不同位置切割;然而,識別和切割相同位置的不同酶被稱為 同裂酶。
限制性內切酶分類
限制性內切酶根據其組成和酶輔助因子的需求、目標序列的性質以及其 DNA 切割位點相對於目標序列的位置,被分為三或四類(I 型、II 型和 III 型)。限制性內切酶共有四類:I 型、II 型、III 型和 IV 型。所有型別的酶都識別特定的短 DNA 序列,並進行 DNA 的內切核酸酶切割,產生具有末端 5'-磷酸的特定雙鏈片段。它們在識別序列、亞基組成、切割位置和輔助因子需求方面有所不同,總結如下:
I 型酶(EC 3.1.21.3) 在識別位點以外的位點切割;需要 ATP 和 S-腺苷甲硫氨酸才能發揮作用;具有限制性和甲基化酶(EC 2.1.1.72)兩種功能的多功能蛋白。
II 型酶(EC 3.1.21.4) 在識別位點內或距離識別位點很短的距離內切割;大多數需要鎂;獨立於甲基化酶的單功能(限制性)酶。
III 型酶(EC 3.1.21.5) 在距離識別位點很短的距離內切割;需要 ATP(但不水解 ATP);S-腺苷甲硫氨酸刺激反應但不必需;作為與修飾甲基化酶(EC 2.1.1.72)的複合物的一部分存在。IV 型酶靶向甲基化的 DNA。
限制性內切酶的例子包括:[17]
| 酶 | 來源 | 識別序列 | 切割 |
|---|---|---|---|
| EcoRI | 大腸桿菌 |
5'GAATTC 3'CTTAAG |
5'---G AATTC---3' 3'---CTTAA G---5' |
| EcoRII | 大腸桿菌 |
5'CCWGG 3'GGWCC |
5'--- CCWGG---3' 3'---GGWCC ---5' |
| BamHI | 枯草芽孢桿菌 |
5'GGATCC 3'CCTAGG |
5'---G GATCC---3' 3'---CCTAG G---5' |
| HindIII | 流感嗜血桿菌 |
5'AAGCTT 3'TTCGAA |
5'---A AGCTT---3' 3'---TTCGA A---5' |
| TaqI | 熱泉菌 |
5'TCGA 3'AGCT |
5'---T CGA---3' 3'---AGC T---5' |
| NotI | 耳諾卡氏菌 |
5'GCGGCCGC 3'CGCCGGCG |
5'---GC GGCCGC---3' 3'---CGCCGG CG---5' |
| HinfI | 流感嗜血桿菌 |
5'GANTCA 3'CTNAGT |
5'---G ANTC---3' 3'---CTNA G---5' |
| Sau3A | 金黃色葡萄球菌 |
5'GATC 3'CTAG |
5'--- GATC---3' 3'---CTAG ---5' |
| PovII* | 普通變形桿菌 |
5'CAGCTG 3'GTCGAC |
5'---CAG CTG---3' 3'---GTC GAC---5' |
| SmaI* | 粘質沙雷氏菌 |
5'CCCGGG 3'GGGCCC |
5'---CCC GGG---3' 3'---GGG CCC---5' |
| HaeIII* | 埃及嗜血桿菌 |
5'GGCC 3'CCGG |
5'---GG CC---3' 3'---CC GG---5' |
| HgaI[18] | 雞嗜血桿菌 |
5'GACGC 3'CTGCG |
5'---NN NN---3' 3'---NN NN---5' |
| AluI* | 類芽孢桿菌 |
5'AGCT 3'TCGA |
5'---AG CT---3' 3'---TC GA---5' |
| EcoRV* | 大腸桿菌 |
5'GATATC 3'CTATAG |
5'---GAT ATC---3' 3'---CTA TAG---5' |
| EcoP15I | 大腸桿菌 |
5'CAGCAGN25NN 3'GTCGTCN25NN |
5'---CAGCAGN25NN ---3' 3'---GTCGTCN25 NN---5' |
| KpnI | 肺炎克雷伯菌 |
5'GGTACC 3'CCATGG |
5'---GGTAC C---3' 3'---C CATGG---5' |
| PstI | 斯氏普羅維登斯菌 |
5'CTGCAG 3'GACGTC |
5'---CTGCA G---3' 3'---G ACGTC---5' |
| SacI | 無色鏈黴菌 |
5'GAGCTC 3'CTCGAG |
5'---GAGCT C---3' 3'---C TCGAG---5' |
| SalI | 白色鏈黴菌 |
5'GTCGAC 3'CAGCTG |
5'---G TCGAC---3' 3'---CAGCT G---5' |
| ScaI | 叢毛鏈黴菌 |
5'AGTACT 3'TCATGA |
5'---AGT ACT---3' 3'---TCA TGA---5' |
| SpeI | 球衣菌 |
5'ACTAGT 3'TGATCA |
5'---A CTAGT---3' 3'---TGATC A---5' |
| SphI | 嗜色鏈黴菌 |
5'GCATGC 3'CGTACG |
5'---GCATG C---3' 3'---C GTACG---5' |
| StuI[19][20] | 結核鏈黴菌 |
5'AGGCCT 3'TCCGGA |
5'---AGG CCT---3' 3'---TCC GGA---5' |
| XbaI | 黃單胞菌 |
5'TCTAGA 3'AGATCT |
5'---T CTAGA---3' 3'---AGATC T---5' |
關鍵
* = 平 blunt 末端
N = C 或 G 或 T 或 A
W = A 或 T
基因克隆及其表達
[edit | edit source]在分子生物學中,克隆是指分離一個確定的 DNA 序列並在體外獲得其多個複製的過程。克隆經常用於擴增包含基因的 DNA 片段,但也可以用於擴增任何 DNA 序列,例如啟動子、非編碼序列、化學合成的寡核苷酸和隨機片段化的 DNA。克隆廣泛應用於各種生物學實驗和技術應用中,例如大規模蛋白質生產和基因在 HeLa 細胞等細胞系中的表達。
從本質上講,為了在體內和體外擴增任何 DNA 序列,所討論的序列必須與能夠指導自身和連線序列在所需目標宿主中複製和增殖的主要序列元素連線起來。所需的序列元素根據宿主而不同,但總是包括複製起點和一個可選擇標記。然而,在實踐中,許多其他特徵是需要的,並且存在各種專門的克隆 載體,它們允許蛋白質表達、標記、單鏈 RNA 和 DNA 的生產,以及在後續應用中很有用的其他操作。
基於重組酶的克隆 一種新的克隆或亞克隆任何 DNA 片段的方法,透過將感興趣的特殊 DNA 片段插入到目標 DNA 的特殊區域,透過相關 DNA 片段的交換來實現。 [21]
這是一個一步反應:簡單、高效,有利於高通量或自動克隆和/或亞克隆。 [22]
限制性/連線克隆 在經典的限制性和連線克隆方案中,克隆任何 DNA 片段基本上涉及四個步驟:使用 限制性內切酶 進行 DNA 片段化,將 DNA 片段與 載體 進行 連線, 轉染 和 篩選/選擇。儘管這些步驟在克隆過程中是恆定的,但根據具體應用,可以在各個點選擇許多替代路線;這些被總結為“克隆策略”。
插入片段的分離 最初,需要分離要克隆的 DNA 片段。克隆 DNA 片段的製備可以透過多種替代方法完成。插入片段的製備通常透過 聚合酶鏈式反應 來實現,但也可以透過 限制性內切酶 消化、DNA 超聲處理 和 瓊脂糖凝膠電泳 分離來實現。如果目標序列大小不超過化學合成的限制,也可以使用化學合成的寡核苷酸。插入片段的分離可以使用鳥槍法克隆、c-DNA 克隆、基因機器(人工化學合成)來完成。
轉化
連線完成後,連線產物(質粒)被 轉化 到細菌中進行增殖。然後將細菌接種到選擇性瓊脂培養基上,以選擇含有感興趣質粒的細菌。挑取單個菌落並測試其是否含有所需的插入片段。可以進行大提質粒操作以獲得大量含有插入基因的質粒。
轉染 連線完成後,連線反應的一部分(包括以所需方向插入片段的載體)被 轉染 到細胞中。有多種替代技術可用,例如細胞的化學敏感化、電穿孔和基因槍轟擊。細胞的化學敏感化經常被採用,因為這不需要專門的裝置,並且提供相對較高的轉化效率。當需要極高的轉化效率時(例如在非常低效的克隆策略中),使用 電穿孔。 基因槍轟擊 主要用於植物細胞轉化,其中細胞壁是 DNA 被細胞吸收的主要障礙。細菌轉化通常透過藍白篩選來觀察。
選擇 最後, 轉染 的細胞被培養。由於上述過程的效率特別低,因此需要識別含有所需插入片段且方向正確的細胞,並將這些細胞從未成功轉化的細胞中分離出來。現代 克隆載體 包括可選擇標記(最常見的是 抗生素 抗性標記),這些標記只允許載體(但不是插入片段)被轉染的細胞生長。此外,克隆載體可能包含顏色選擇標記,這些標記在 X-gal 培養基上提供藍白篩選(透過 α 因子互補)。然而,這些選擇步驟不能完全保證 DNA 插入片段存在於細胞中。需要對所得菌落進行進一步研究以確認克隆是否成功。這可以透過 PCR、限制性片段長度多型性 和/或 DNA 測序來實現。
基因工程
基因工程是一種透過改變生物體的遺傳物質,以預定的方式改變其遺傳特性的方法。這通常是為了使微生物(如細菌或病毒)能夠合成更高產量的化合物,形成全新的化合物,或適應不同的環境。這項技術(也稱為重組 DNA 技術)的其他用途包括基因治療,即向患有遺傳疾病或其他疾病(如獲得性免疫缺陷綜合徵 (AIDS) 或癌症)的人提供功能基因,以及整個生物體的克隆。
遺傳工程涉及操縱脫氧核糖核酸,即DNA。在這個過程中,重要的工具是限制性內切酶(稱為限制性酶),它們是由各種細菌產生的。限制性酶可以識別DNA分子中化學單元鏈(稱為核苷酸鹼基)的特定序列,並在該位置切割DNA。這樣產生的DNA片段可以使用另一種稱為連線酶的酶連線起來。因此,限制性酶和連線酶允許對DNA片段進行特定的切割和重新組裝。在DNA操縱中也很重要的是所謂的載體,它們是能夠獨立於宿主細胞中DNA進行自我複製(產生自身的副本)的DNA片段。載體的例子包括質粒、病毒和人工染色體。載體允許生成特定DNA片段的多個副本,使其成為生成足夠數量可用於工作的材料的有用方法。將DNA片段工程化到載體的過程稱為“分子克隆”,因為會產生多個相同DNA分子的副本。另一種產生許多相同特定(通常是短的,例如100-3,000個鹼基對)DNA片段副本的方法是聚合酶鏈反應。該方法快速且避免了將DNA克隆到載體的需要。
報告基因
[edit | edit source]在分子生物學中,報告基因是指研究人員將其連線到細胞培養、動物或植物中另一個感興趣基因的調控序列的基因。某些基因被選作報告基因,因為它們賦予表達它們的生物體的特徵易於識別和測量,或者因為它們是選擇性標記。報告基因通常被用作特定基因是否被細胞或生物體群體吸收或表達的指示。
為了將報告基因匯入生物體,科學家將報告基因和感興趣基因放在同一個DNA構建體中,將其插入細胞或生物體。對於細菌或培養中的真核細胞,這通常以稱為質粒的環狀DNA分子的形式出現。重要的是使用在研究的細胞或生物體中未天然表達的報告基因,因為報告基因的表達被用作基因攝取成功的標誌。通常用於誘導視覺化識別特徵的常用報告基因通常涉及熒光和發光蛋白;例如包括編碼水母綠色熒光蛋白(GFP)的基因,該基因導致表達它的細胞在藍光下發出綠色熒光,以及編碼螢光素酶的基因,該基因催化與螢光素反應產生光,以及來自基因dsRed的紅色熒光蛋白。細菌中另一個常見的報告基因是Lac Z基因,它編碼β-半乳糖苷酶蛋白。這種酶導致表達該基因的細菌在含有底物類似物X-gal的培養基上生長時呈藍色。細菌中選擇性標記報告基因的例子是氯黴素乙醯轉移酶(CAT)基因,它賦予對氯黴素抗性。
報告基因還可以用來檢測感興趣基因的表達,該基因可能產生對細胞培養或生物體沒有明顯或直接影響的蛋白質。在這些情況下,報告基因直接連線到感興趣基因以建立基因融合。這兩個基因在相同的啟動子元件下,被轉錄成單個信使RNA分子。然後,mRNA被翻譯成蛋白質。在這些情況下,重要的是兩種蛋白質能夠正確摺疊成它們的活性構象並與它們的底物相互作用,儘管它們是融合的。在構建DNA構建體時,通常包含一個編碼靈活多肽連線子區域的DNA片段,以便報告基因和基因產物僅在最小程度上相互干擾。[23]
實踐中的基因表達和純化
蛋白質表達在生物化學中至關重要,因為它提供了用於進一步分析所需的底物或酶。在進行大規模蛋白質表達之前,通常會先進行小規模表達檢查。BL21感受態大腸桿菌是常用的蛋白質表達感受態細胞。它對某些抗生素(如卡那黴素)具有抗性;它可以進行修飾以表達感興趣的蛋白質。
在表達檢查中,將所需的基因接種並在含有相應抗生素的5ml適當培養基中過夜表達。過夜表達後,將含有所需蛋白質的培養基離心。在去除上清液後,將沉澱物懸浮在適當的裂解緩衝液中並進行超聲處理。超聲處理後,將樣品離心。將可溶性部分和不可溶性部分用於SDS凝膠電泳分析。必須提前知道和計算所需蛋白質的大致大小。如果在SDS凝膠電泳中顯示出所需條帶,則可以進行大規模蛋白質表達。

在大規模蛋白質表達中,通常使用3升培養瓶進行接種和誘導。在開始時,需要透過在5ml至25ml的滅菌培養基中接種已修飾的蛋白質表達感受態細胞來製備感興趣基因的起始培養物。常用的培養基是LB,TB等。起始培養物需要在適當的溫度(如37攝氏度)下孵育,並伴隨充分搖動過夜。在同一天,可以準備升的培養基。在LB培養基的情況下,每升去離子水中需要25克LB。將培養瓶用鋁箔封好並進行高壓滅菌。接種前,LB需要保持用鋁箔覆蓋以保持無菌。在接種當天,培養基需要冷卻至至少室溫。將適當的抗生素新增到培養基中並充分搖動。接種是透過將5-10ml起始培養物新增到每升培養基中進行的。然後將培養基置於37度搖床中。跟蹤接種培養物的吸光度至關重要。所需的吸光度為0.6。在大腸桿菌的情況下,這種吸光度大約在接種3小時後獲得。大腸桿菌每20分鐘複製一次;然而,在抗生素存在的情況下,這種複製時間可能會更長。但3小時的接種時間是安全的。3小時後,應仔細監測培養基的吸光度。如果OD過低,誘導可能不足;而如果OD過高,我們可能會獲得不想要的蛋白質,因此所需的OD為0.6。在OD達到0.6後,在誘導之前需要將培養基在冰上冷卻。IPTG通常用於誘導BL21感受態細胞。1mM的IPTG足以用於誘導。誘導溫度可能與接種溫度不同。誘導需要過夜。
第二天,將培養基離心成沉澱物。需要透過法國壓機或微流化儀裂解沉澱物,具體取決於可用沉澱物的數量。法國壓機通常適用於2升培養物裂解,而微流化儀更適合於任何超過2升的培養物裂解。實際選擇還取決於可用裝置以及沉澱物在裂解緩衝液中的溶解度。
在將沉澱物懸浮在裂解緩衝液中後,加入溶菌酶、DNase和RNase,並至少孵育10分鐘。如果新增任何這些物質的數量不足,沉澱物在裂解過程中會顯得粘稠,裂解可能不完全。裂解後,將樣品離心以獲得含有我們所需蛋白質的可溶性部分。重要的是要保持整個裂解過程處於冷態,因為某些蛋白質可能在室溫下沉澱,或者機器變熱會導致蛋白質損失。利用含有我們感興趣蛋白質的可溶性部分,可以進行進一步的純化。例如鹽析、離子交換和親和層析。進一步的純化可能涉及FPLC。
適當的裂解緩衝液在蛋白質表達中至關重要。不同的質粒在不同的培養基中表達不同。溫度和pH也是需要考慮的重要因素。
參考文獻
[edit | edit source]- ↑ 基因表達
- ↑ 轉錄(遺傳學)
- ↑ Beadle GW, Tatum EL (1941年11月15日). “遺傳控制著真菌中的生化反應”. PNAS 27 (11): 499–506.
- ↑ 一個基因一個酶假說
- ↑ 操縱子
- ↑ http://en.wikipedia.org/w/index.php?title=Riboswitch&oldid=420979855
- ↑ 乳糖操縱子
- ↑ http://en.wikipedia.org/w/index.php?title=Lac_repressor&oldid=426589639
- ↑ http://en.wikipedia.org/w/index.php?title=Trp_operon&oldid=428240917
- ↑ 基因表達
- ↑ 質粒
- ↑ 聚合酶鏈反應
- ↑ 聚合酶鏈反應
- ↑ Pingoud A, Jeltsch A (2001年9月). "II型限制性內切酶的結構和功能". Nucleic Acids Res. 29 (18): 3705–27. doi:10.1093/nar/29.18.3705. PMC 55916. PMID 11557805.
- ↑ David P. Clark 著,分子生物學:理解基因革命,Elsevier Academic Press 出版,2005年。 ISBN 0-12-175551-7.
- ↑ Goodsell DS (2002). "分子視角:限制性內切酶". Stem Cells. 20 (2): 190–1. doi:10.1634/stemcells.20-2-190. PMID 11897876.
- ↑ Roberts RJ (1980年1月). "限制性內切酶和修飾酶及其識別序列". Nucleic Acids Res. 8 (1): r63–r80. doi:10.1093/nar/8.1.197-d. PMC 327257. PMID 6243774.
- ↑ R.J Roberts,1988,Nucl Acids Res. 16(增刊):271 摘自Lodish、Berk、Zipursky、Matsudaira、Baltimore 和 Darnell 編著的《分子細胞生物學》第四版,第 213 頁。
- ↑ "來自鏈黴菌 tubercidicus 的 Stu I". Sigma-Aldrich. 檢索於 2008-06-07.
{{cite web}}: 引用中存在空值未知引數:|coauthors=(幫助) - ↑ Shimotsu H, Takahashi H, Saito H (1980年11月). "來自鏈黴菌 tubercidicus 的一種新的位點特異性內切酶 StuI". Gene. 11 (3–4): 219–25. doi:10.1016/0378-1119(80)90062-1. PMID 6260571.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Copeland NG, Jenkins NA, Court DL (2001). "重組工程:小鼠功能基因組學中的一種強大新工具". Nat. Rev. Genet. 2 (10): 769–79. doi:10.1038/35093556. PMID 11584293.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 maint: multiple names: authors list (link) - ↑ Lu JP, Beatty LK, Pinthus JH. (2008). "基於雙表達重組酶(DERB)的單載體系統,用於活細胞中蛋白質相互作用的高通量篩選和驗證". Nature Precedings.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://en.wikipedia.org/w/index.php?title=Reporter_gene&oldid=422027341

