分子生物學/RNA 簡介:核糖核酸
核糖核酸俗稱 RNA。RNA 是三種主要的大分子(連同 DNA 和蛋白質)之一,對所有已知的生命形式至關重要。RNA 的化學結構與 DNA 非常相似,有兩個區別——(a) RNA 包含糖核糖,而 DNA 包含稍微不同的糖脫氧核糖(一種缺少一個氧原子的核糖),以及 (b) RNA 包含核鹼基尿嘧啶,而 DNA 包含胸腺嘧啶(尿嘧啶和胸腺嘧啶具有相似的鹼基配對性質)。信使 RNA (mRNA) 是一種 RNA,它將資訊從 DNA 傳遞到核糖體,核糖體是細胞中蛋白質合成(翻譯)的場所。mRNA 的編碼序列決定了所產生蛋白質中的氨基酸序列。然而,許多 RNA 不編碼蛋白質(大約 97% 的轉錄輸出在真核生物中是非蛋白質編碼的)。這些所謂的非編碼 RNA(“ncRNA”)可以由它們自己的基因(RNA 基因)編碼,但也可以來自 mRNA 內含子。最突出的非編碼 RNA 示例是轉移 RNA (tRNA) 和核糖體 RNA (rRNA),它們都參與翻譯過程。還有一些非編碼 RNA 參與基因調控、RNA 加工和其他作用。某些 RNA 能夠催化化學反應,例如切割和連線其他 RNA 分子,以及核糖體中肽鍵形成的催化作用;這些被稱為核酶。[1]

核酸於 1868 年由弗里德里希·米歇爾發現,他稱這種物質為“核素”,因為它是在細胞核中發現的。[2] 後來發現,沒有細胞核的原核細胞也含有核酸。RNA 在蛋白質合成中的作用早在 1939 年就已受到懷疑。[3] 塞韋羅·奧喬亞在發現一種能夠在實驗室中合成 RNA 的酶後,獲得了 1959 年諾貝爾生理學或醫學獎(與阿瑟·科恩伯格分享)。[4] 具有諷刺意味的是,奧喬亞發現的酶(多核苷酸磷酸化酶)後來被證明是負責 RNA 降解,而不是 RNA 合成。
1965 年,羅伯特·W·霍利發現了酵母 tRNA 的 77 個核苷酸序列,[5] 使霍利獲得了 1968 年諾貝爾生理學或醫學獎(與哈爾·戈賓德·科拉納和馬歇爾·尼倫伯格分享)。
1967 年,卡爾·沃斯假設 RNA 可能具有催化作用,並建議最早的生命形式(自我複製分子)可能依賴於 RNA 來攜帶遺傳資訊和催化生化反應——RNA 世界。[6][7]
在 20 世紀 70 年代初期,逆轉錄病毒和逆轉錄酶被發現,首次表明酶可以將 RNA 複製成 DNA(與遺傳資訊傳遞的通常路線相反)。由於這項工作,大衛·巴爾的摩、雷納託·杜爾貝科和霍華德·特明於 1975 年獲得了諾貝爾獎。1976 年,沃爾特·費爾斯和他的團隊確定了第一個完整的 RNA 病毒基因組核苷酸序列,即噬菌體 MS2 的基因組序列。[8]
1977 年,內含子和 RNA 剪接在哺乳動物病毒和細胞基因中都被發現,導致菲利普·夏普和理查德·羅伯茨獲得了 1993 年諾貝爾獎。催化 RNA 分子(核酶)在 20 世紀 80 年代初被發現,導致托馬斯·切赫和西德尼·奧特曼獲得了 1989 年諾貝爾獎。1990 年,在矮牽牛中發現,引入的基因可以沉默植物自身相似的基因,現在已知是 RNA 干擾的結果。[9][10]
大約在同一時間,發現 22 個核苷酸長的 RNA(現在稱為 microRNA)在秀麗隱杆線蟲的發育中發揮作用。[11] 關於 RNA 干擾的研究使安德魯·法厄和克雷格·梅洛獲得了 2006 年諾貝爾獎,同年,羅傑·科恩伯格因對 RNA 轉錄的研究而獲得了另一個諾貝爾獎。基因調控 RNA 的發現導致人們試圖開發由 RNA 製成的藥物,例如 siRNA,來沉默基因。[12]
信使 RNA (mRNA) 是一種 RNA 分子,編碼蛋白質產物的化學“藍圖”。mRNA 從 DNA 模板轉錄而來,並將編碼資訊攜帶到蛋白質合成的場所:核糖體。在這裡,核酸聚合物被翻譯成氨基酸聚合物:蛋白質。在 mRNA 中,就像在 DNA 中一樣,遺傳資訊編碼在排列成密碼子的核苷酸序列中,每個密碼子由三個鹼基組成。每個密碼子編碼一個特定的氨基酸,除了終止蛋白質合成的終止密碼子。這個過程需要另外兩種型別的 RNA:轉移 RNA (tRNA) 介導對密碼子的識別並提供相應的氨基酸,而核糖體 RNA (rRNA) 是核糖體蛋白質製造機器的核心成分。

核糖體核糖核酸 (rRNA) 是核糖體的 RNA 成分,核糖體是所有活細胞中蛋白質合成的場所。核糖體 RNA 提供了一種將 mRNA 解碼為氨基酸的機制,並在翻譯過程中與 tRNA 相互作用,透過提供肽基轉移酶活性。tRNA 帶來了與相應 mRNA 密碼子對應的必要氨基酸。
-
rRNA
轉運 RNA (tRNA) 是一種小型的 RNA 分子(通常約 73-95 個核苷酸),它在翻譯過程中將特定的活性氨基酸轉移到核糖體上正在生長的多肽鏈上。它有一個 3' 端位點用於氨基酸的連線。這種共價連線是由氨醯 tRNA 合成酶催化的。它還包含一個稱為反密碼子的三個鹼基區域,可以與 mRNA 上相應的三個鹼基密碼子區域配對。每種型別的 tRNA 分子只能連線到一種型別的氨基酸,但由於遺傳密碼包含多個指定相同氨基酸的密碼子,因此帶有不同反密碼子的 tRNA 分子也可以攜帶相同的氨基酸。
-
tRNA 的三級結構。CCA 尾部為黃色,受體莖為紫色,可變環為橙色,D 臂為紅色,反密碼子臂為藍色,反密碼子為黑色,T 臂為綠色。
-
tRNA 和 mRNA 在蛋白質合成中的相互作用。
小核 RNA (snRNA) 是一類在真核細胞核中發現的小型 RNA 分子。它們由 RNA 聚合酶 II 或 RNA 聚合酶 III 轉錄,並參與多種重要過程,例如 RNA 剪接(從 hnRNA 中去除內含子)、轉錄因子的調控(7SK RNA)或 RNA 聚合酶 II(B2 RNA),以及維持端粒。它們總是與特定的蛋白質相關聯,這些複合體被稱為小核核糖核蛋白 (snRNP) 或有時被稱為 snurps。這些元素富含尿嘧啶。
小核仁 RNA (snoRNA) 是一類主要指導其他 RNA 化學修飾的小型 RNA 分子,主要包括核糖體 RNA、轉運 RNA 和小核 RNA。snoRNA 主要分為兩類,C/D 盒 snoRNA 與甲基化相關,H/ACA 盒 snoRNA 與假尿嘧啶化相關。snoRNA 通常被稱為引導 RNA,但不要與引導錐蟲中 RNA 編輯的引導 RNA 混淆。
轉錄後,新生 rRNA 分子(稱為 pre-rRNA)需要經過一系列加工步驟才能生成成熟的 rRNA 分子。在被外切核酸酶和內切核酸酶切割之前,pre-rRNA 會經歷複雜的核苷修飾模式。這些修飾包括甲基化和假尿嘧啶化,由 snoRNA 指導。甲基化是在各種底物上新增或取代甲基。人類的 rRNA 包含大約 115 個甲基修飾。其中大多數是 2'O-核糖甲基化(甲基連線到核糖基)。假尿嘧啶化是將核苷尿嘧啶轉化(異構化)為不同的異構形式假尿嘧啶 (Ψ)。成熟的人類 rRNA 包含大約 95 個 Ψ 修飾。每個 snoRNA 分子只作為靶 RNA 中一個(或兩個)單獨修飾的引導。為了進行修飾,每個 snoRNA 與至少四個蛋白質分子在 RNA/蛋白質複合體中結合,稱為小核仁核糖核蛋白 (snoRNP)。與每個 RNA 相結合的蛋白質取決於 snoRNA 分子的型別(見下面的 snoRNA 引導家族)。snoRNA 分子包含一個反義元件(一段 10-20 個核苷酸),它與 pre-RNA 分子中被修飾的鹼基 (核苷酸) 周圍的序列互補。這使 snoRNP 能夠識別並結合到靶 RNA 上。一旦 snoRNP 結合到靶位點,相關的蛋白質就會處於正確的位置以催化靶鹼基的化學修飾。[13]
核糖核酸酶 P (RNase P) 是一種核糖核酸酶,它切割 RNA。RNase P 與其他 RNase 的獨特之處在於它是一種核酶——一種像蛋白質酶一樣起催化作用的核糖核酸。它的作用是切割 tRNA 分子上額外的或前體 RNA 序列。
-
預測的 RNaseP_bact_a 的二級結構和序列保守性。
端粒酶 RNA 元件,也稱為 TERC,是真核生物中發現的 RNA 基因,它是端粒酶的組成部分,用於延長端粒。端粒酶 RNA 在脊椎動物、纖毛蟲和酵母之間在序列和結構上差異很大,但它們在模板序列附近共享一個 5' 假結結構。脊椎動物端粒酶 RNA 具有一個 3' H/ACA snoRNA 樣域。
-
端粒酶 RNA 元件部分的 3D 表示。這是人端粒酶 RNA 中 P2b-P3 假結的溶液結構。
反義 RNA 是一種單鏈 RNA,它與細胞內轉錄的信使 RNA (mRNA) 鏈互補。反義 RNA 可以被引入細胞以透過與互補 mRNA 配對並物理阻礙翻譯機制來抑制互補 mRNA 的翻譯。因此,這種效果是化學計量的。自然發生的 mRNA 反義機制的一個例子是大腸桿菌 R1 質粒的 hok/sok 系統。反義 RNA 長期以來被認為是一種很有前景的疾病治療技術;唯一進入市場的此類案例是藥物福米維森。一位評論員將反義 RNA 描述為“數十種在概念上很美妙,但在實際應用中卻令人沮喪的技術”之一。總的來說,反義 RNA 仍然缺乏有效的設計、生物活性以及有效的給藥途徑。[14]
微小 RNA (miRNA) 是一種短的核糖核酸 (RNA) 分子,平均只有 22 個核苷酸長,存在於所有真核細胞中。miRNA 是轉錄後調節因子,它們結合到靶信使 RNA 轉錄本 (mRNA) 上的互補序列,通常導致翻譯抑制和基因沉默。人類基因組可能編碼超過 1000 個 miRNA,它們可能靶向大約 60% 的哺乳動物基因,並且在許多人類細胞型別中含量豐富。
-
來自甘藍的 pre-microRNA 的莖環二級結構。
小干擾 RNA (siRNA),有時稱為短干擾 RNA 或沉默 RNA,是一類雙鏈 RNA 分子,長度為 20-25 個核苷酸,在生物學中發揮著多種作用。最值得注意的是,siRNA 參與 RNA 干擾 (RNAi) 途徑,它干擾特定基因的表達。除了它們在 RNAi 途徑中的作用外,siRNA 還作用於 RNAi 相關途徑,例如,作為一種抗病毒機制或在塑造基因組的染色質結構方面;這些途徑的複雜性才剛剛被闡明。siRNA 最初是由英國諾里奇塞恩斯伯裡實驗室的大衛·鮑爾科姆團隊發現的,作為植物轉錄後基因沉默 (PTGS) 的一部分。
小干擾 RNA 的識別
透過作圖研究表明,靶轉錄本的切割對應於與dsRNA互補的區域,並且發生在21-22-nt的間隔處,看起來與dsRNA衍生的siRNA大小相同。為了測試siRNA是否介導RISC活性,合成了具有對稱2-nt 3'懸垂的21-22-nt RNA雙鏈體以模擬dsRNA加工產物。當然,這些合成的寡核苷酸在與小RNA中部相對應的位置誘導了靶mRNA的切割。因此,這些dsRNA衍生的siRNA被命名為小干擾RNA(siRNA)。然而,一項最重要的貢獻是由證明透過將合成的siRNA轉染到哺乳動物細胞中沉默靶轉錄本而做出的。這項工作為眾多基於RNAi的應用奠定了基礎,包括強大的“關閉”功能策略和一種新的潛在治療方法。因此,這些里程碑式的研究為基礎科學(包括傳統生物化學)在產生生物醫學應用的新領域方面的重要性提供了一個壯觀的例子。
RNA的結構
[edit | edit source]

RNA中的每個核苷酸都包含一個核糖糖,其碳原子從1'到5'編號。鹼基通常連線在1'位置,通常是腺嘌呤(A)、胞嘧啶(C)、鳥嘌呤(G)或尿嘧啶(U)。腺嘌呤和鳥嘌呤是嘌呤,胞嘧啶和尿嘧啶是嘧啶。一個磷酸基團連線到一個核糖的3'位置和下一個核糖的5'位置。磷酸基團在生理pH值下都帶負電荷,使RNA成為帶電分子(聚陰離子)。鹼基可以在胞嘧啶和鳥嘌呤之間、腺嘌呤和尿嘧啶之間以及鳥嘌呤和尿嘧啶之間形成氫鍵。但是,其他相互作用也是可能的,例如一組腺嘌呤鹼基在凸起中相互結合,或者具有鳥嘌呤-腺嘌呤鹼基對的GNRA四環。
RNA的一個重要結構特徵是它與DNA的區別,即核糖糖的2'位置存在一個羥基。該官能團的存在導致螺旋採用A型幾何形狀,而不是在DNA中最常觀察到的B型幾何形狀。這導致一個非常深而窄的主溝和一個淺而寬的次溝。2'-羥基存在的第二個結果是在RNA分子構象靈活的區域(即不參與雙螺旋形成),它可以化學攻擊相鄰的磷酸二酯鍵以斷裂主鏈。
核糖是一種醛戊糖,即含有五個碳原子的單糖,在開鍊形式中,在一個末端具有醛官能團。在單糖的常規編號方案中,碳原子從C1'(在醛基中)到C5'編號。脫氧核糖衍生物(存在於DNA中)與核糖的不同之處在於碳原子C2'處羥基被氫原子取代。像許多單糖一樣,核糖在水中以直鏈形式H-(C=O)-(CHOH)4-H存在,以及兩種環形式中的任何一種:呋喃核糖(“C3'-內消旋”),具有五元環,和吡喃核糖(“C2'-內消旋”),具有六元環。呋喃核糖形式在水溶液中占主導地位。名稱D-核糖中的“D-”指的是最遠離醛基(C4')的手性碳原子的立體化學。在D-核糖中,與所有D-糖一樣,這個碳原子具有與D-甘油醛相同的構型。核糖構成了RNA的主鏈,RNA是一種生物聚合物,是基因轉錄的基礎。它與DNA中發現的脫氧核糖有關。一旦磷酸化,核糖可以成為ATP、NADH和其他幾種對代謝至關重要的化合物的亞基。[15]
RNA鹼基
[edit | edit source]腺嘌呤 (A)
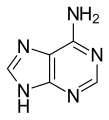
腺嘌呤 (A,) 是一種核鹼基(嘌呤衍生物),在生物化學中有多種作用,包括細胞呼吸(以能量豐富的腺苷三磷酸 (ATP) 和輔酶煙醯胺腺嘌呤二核苷酸 (NAD) 和黃素腺嘌呤二核苷酸 (FAD) 的形式),以及蛋白質合成(作為 DNA 和 RNA 的化學成分)。腺嘌呤的形狀與 DNA 中的胸腺嘧啶或 RNA 中的尿嘧啶互補。
-
腺嘌呤
胞嘧啶 (C)
胞嘧啶 (C) 是 DNA 和 RNA 中發現的四種主要鹼基之一,其他三種是腺嘌呤、鳥嘌呤和胸腺嘧啶(RNA 中的尿嘧啶)。它是一種嘧啶衍生物,具有雜環芳香環和兩個連線的取代基(位置 4 處的胺基和位置 2 處的酮基)。胞嘧啶的核苷是胞苷。
-
胞嘧啶
鳥嘌呤 (G)
鳥嘌呤 (G) 是 DNA 和 RNA 中發現的四種主要核鹼基之一,其他三種是腺嘌呤、胞嘧啶和胸腺嘧啶(RNA 中的尿嘧啶)。在 DNA 中,鳥嘌呤與胞嘧啶配對。鳥嘌呤的化學式為 C5H5N5O,是嘌呤的衍生物,由一個稠合的嘧啶-咪唑環系組成,具有共軛雙鍵。
-
鳥嘌呤
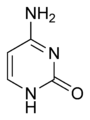
尿嘧啶 (U)
-
尿嘧啶

存在於 RNA 中,它與腺嘌呤配對,並在 DNA 轉錄過程中取代胸腺嘧啶。尿嘧啶的甲基化產生胸腺嘧啶。它變成胸腺嘧啶以保護 DNA 並提高 DNA 複製的效率。尿嘧啶可以與任何鹼基配對,具體取決於分子在螺旋上的排列方式,但很容易與腺嘌呤配對,因為甲基被排斥到固定位置。[16] 尿嘧啶透過氫鍵與腺嘌呤配對。尿嘧啶是氫鍵受體,可以形成兩個氫鍵。尿嘧啶還可以與核糖糖結合形成核苷尿苷。當磷酸連線到尿苷時,會生成尿苷 5'-單磷酸。[17]
尿嘧啶經歷醯胺-亞胺酸互變異構體轉變,因為分子可能由於缺乏正式的芳香性而具有的任何核不穩定性都會得到環狀醯胺穩定性的補償。醯胺互變異構體被稱為內醯胺結構,而亞胺酸互變異構體被稱為內醯亞胺結構。這些互變異構體在 pH 7 處占主導地位。內醯胺結構是尿嘧啶最常見的形式。
尿嘧啶還透過一系列磷酸核糖基轉移酶反應自身迴圈以形成核苷酸。尿嘧啶的降解產生天冬氨酸、二氧化碳和氨作為底物。
- C4H4N2O2 → H3NCH2CH2COO- + NH4+ + CO2
在 H2O2 和 Fe2+ 的存在下或在雙原子氧和 Fe2+ 的存在下,尿嘧啶的氧化降解會生成尿素和馬來酸。
尿嘧啶是一種弱酸;尿嘧啶的第一個電離位點尚不清楚。[18] 負電荷放在氧陰離子上,產生小於或等於 12 的 pKa。鹼性 pKa = -3.4,而酸性 pKa = 9.389。在氣相中,尿嘧啶有 4 個比水更酸性的位點。[19]
尿嘧啶是一種常見且天然存在的嘧啶衍生物。它最初於 1900 年被發現,是透過水解牛胸腺和脾臟、鯡魚精子和麥胚中發現的酵母核蛋白而分離出來的。它是一種平面、不飽和化合物,能夠吸收光。
DNA 與 RNA
[edit | edit source]
RNA 和 DNA 都是核酸,但在三個主要方面有所不同。
首先,與通常是雙鏈的 DNA 不同,RNA 在其許多生物學作用中是單鏈分子,並且具有更短的核苷酸鏈。
其次,雖然 DNA 包含脫氧核糖,但 RNA 包含核糖(在脫氧核糖中,在 2' 位置的戊糖環上沒有連線羥基)。這些羥基使 RNA 比 DNA 不穩定,因為它更容易發生水解。
第三,與腺嘌呤互補的鹼基不是胸腺嘧啶(如 DNA 中那樣),而是尿嘧啶,它是胸腺嘧啶的未甲基化形式。
第四,DNA 通常在鹼性條件下穩定,而 RNA 在鹼性條件下不穩定。
與 DNA 類似,大多數具有生物活性的 RNA,包括 mRNA、tRNA、rRNA、snRNA 和其他非編碼 RNA,都包含自互補序列,這些序列允許 RNA 的部分摺疊並與自身配對以形成雙螺旋。對這些 RNA 的結構分析表明它們具有高度結構化。與 DNA 不同,它們的結構不包含長雙螺旋,而是包含短螺旋的集合,這些短螺旋被包裝在一起形成類似於蛋白質的結構。透過這種方式,RNA 可以實現化學催化,就像酶一樣。例如,核糖體(催化肽鍵形成的酶)結構的確定表明,其活性位點完全由 RNA 組成。
snRNA 和 snRNP
[edit | edit source]snRNPs(發音為“snurps”),即小核核糖核蛋白,是一種 RNA-蛋白質複合物,它與未修飾的 pre-mRNA 和各種其他蛋白質結合形成剪接體,剪接體是一種大型 RNA-蛋白質分子複合物,pre-mRNA 的剪接發生在其上。snRNPs 的作用對於從 pre-mRNA 中去除內含子至關重要,這是 RNA 轉錄後修飾的一個關鍵方面,僅發生在真核細胞的細胞核中。snRNPs 的兩個基本組成部分是蛋白質分子和 RNA。snRNP 顆粒中發現的 RNA 被稱為小核 RNA 或 snRNA,其長度通常約為 150 個核苷酸。snRNP 中的 snRNA 元件透過“識別”內含子 5' 端和 3' 端以及分支位點的關鍵剪接訊號序列,賦予單個內含子特異性。snRNPs 中的 snRNA 與核糖體 RNA 類似,因為它直接包含酶促作用和結構作用。snRNPs 由邁克爾·R·勒納和瓊·A·施泰茨發現。托馬斯·R·切赫和西德尼·奧爾特曼也參與了這項發現,他們因獨立發現 RNA 在細胞發育中可以作為催化劑而於 1989 年獲得了諾貝爾化學獎。
至少五種不同型別的 snRNPs 加入剪接體以參與剪接。它們可以透過凝膠電泳觀察,分別被稱為:U1、U2、U4、U5 和 U6。它們的 snRNA 成分分別被稱為:U1 snRNA、U2 snRNA、U4 snRNA、U5 snRNA 和 U6 snRNA。在 20 世紀 90 年代中期,人們發現存在一種變異型別的 snRNPs,它有助於剪接僅在後生動物中發現的一類內含子,這些內含子具有高度保守的 5' 剪接位點和分支位點。這種變異型別的 snRNPs 包括:U11 snRNA、U12 snRNA、U4atac snRNA 和 U6atac snRNA。雖然不同,但它們分別執行與 U1、U2、U4 和 U6 相同的功能。[20]
完成的核心 snRNP-snurportin 1 複合物透過蛋白 importin β 轉運到細胞核。在細胞核內,核心 snRNPs 出現在卡哈爾小體中,snRNPs 的最終組裝發生在那裡。這包括特定於特定 snRNP(U1、U2、U4、U5)的其他蛋白質和其他修飾。U6 snRNP 的生物發生發生在細胞核中,儘管在細胞質中發現了大量的遊離 U6。LSm 環可能首先組裝,然後與 U6 snRNA 結合。
小核核糖核酸 (snRNA) 是一類在真核細胞細胞核中發現的小 RNA 分子。它們由 RNA 聚合酶 II 或 RNA 聚合酶 III 轉錄,參與各種重要的過程,例如 RNA 剪接(從 hnRNA 中去除內含子)、轉錄因子的調節 (7SK RNA) 或 RNA 聚合酶 II (B2 RNA),以及維持端粒。它們始終與特定蛋白質相關聯,並且這些複合物被稱為小核核糖核蛋白 (snRNP) 或有時被稱為 snurps。這些元素富含尿嘧啶。一大類 snRNA 被稱為小核仁 RNA (snoRNA)。這些是小的 RNA 分子,在 RNA 生物發生中起著至關重要的作用,並指導核糖體 RNA (rRNA) 和其他 RNA 基因 (tRNA 和 snRNA) 的化學修飾。它們位於真核細胞的核仁和卡哈爾小體中(RNA 合成的主要部位)。
RNA 作為一種酶
[edit | edit source]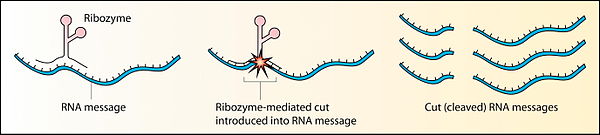
在發現核酶之前,酶被定義為催化蛋白質,[21] 是唯一已知的生物催化劑。1967 年,卡爾·沃斯、弗朗西斯·克里克和萊斯利·奧格爾最先提出 RNA 可以作為催化劑。這個想法是基於 RNA 可以形成複雜二級結構的發現。[22] 第一個核酶是在 20 世紀 80 年代由托馬斯·R·切赫發現的,他當時正在研究纖毛原生動物四膜蟲的 RNA 剪接,以及西德尼·奧爾特曼,他當時正在研究細菌 RNase P 複合物。這些核酶存在於 RNA 轉錄本的內含子中,內含子從轉錄本中去除自身,以及 RNase P 複合物的 RNA 成分中,RNase P 複合物參與 pre-tRNA 的成熟。1989 年,托馬斯·R·切赫和西德尼·奧爾特曼因其“發現 RNA 的催化特性”而獲得了諾貝爾化學獎。[23] 術語“核酶”是由凱利·克魯格等人首次提出的。1982 年發表在《細胞》雜誌上的一篇論文中。[24]
RNA 酶或核酶仍然存在於當今的 DNA 形式生命中,可能是活化石的例子。核酶發揮著至關重要的作用,例如核糖體中的作用,核糖體對蛋白質合成至關重要。許多其他核酶功能存在,例如:錘頭核酶進行自我裂解,[25] 以及 RNA 聚合酶核酶可以自分裂合成自身。[26]
在生命起源中重要的酶促特性包括
- 自我複製或複製其他 RNA 分子的能力。能夠複製其他 RNA 分子的相對較短的 RNA 分子已在實驗室中人工產生。最短的是 165 個鹼基長,儘管估計只有部分鹼基對該功能至關重要。一個版本,189 個鹼基長,其保真度為 98.9%,[27] 這意味著它將每八個複製中複製一個與自身一樣長的 RNA 分子的精確複製。這種 189 個鹼基對的核酶可以聚合最多 14 個核苷酸長的模板,這對於複製來說太短了,但它是進一步研究的有希望的線索。核酶聚合酶最長的引物延伸為 20 個鹼基。[28]
- 催化簡單化學反應的能力,這將增強構成 RNA 分子的分子的產生,即使建立更多 RNA 鏈更容易的 RNA 鏈。在實驗室中人工形成了具有這種能力的相對較短的 RNA 分子。[29] [30]
- 催化肽鍵形成的能力,以產生短肽或最終產生完整的蛋白質。現代細胞中,這是由核糖體完成的,核糖體是兩種稱為 rRNA 的大型 RNA 分子以及許多蛋白質的複合物。兩種 rRNA 分子被認為是其酶促活性的原因。在實驗室中形成了一個更短的 RNA 分子,它具有形成肽鍵的能力,並且有人推測 rRNA 是從類似的分子進化而來的。[31] 也有人推測,氨基酸最初可能是與 RNA 分子結合作為輔因子,增強或多樣化它們的酶促能力,然後才進化為更復雜的肽。mRNA 可能從這樣的 RNA 分子進化而來,而 tRNA 可能從催化氨基酸轉移到它們的 RNA 分子進化而來。[32]
雖然大多數核酶在細胞中相當罕見,但它們的作用有時對生命至關重要。例如,核糖體的功能部分,即將 RNA 翻譯成蛋白質的分子機器,本質上是一種核酶,由 RNA 三級結構基序組成,這些基序通常與金屬離子(如 Mg2+)配位作為輔因子。在能夠催化四核苷酸底物的反式苯丙氨酸化反應的五核苷酸 RNA 中,不需要二價陽離子,該底物與催化劑具有三個鹼基互補序列。催化劑和底物是透過截斷 C3 核酶而設計的。
核糖核酸酶
[edit | edit source]

核糖核酸酶(通常縮寫為 RNase)是一種催化 RNA 降解為更小成分的核酸酶。核糖核酸酶可以分為內切核糖核酸酶和外切核糖核酸酶,並且包含 EC 2.7 類 (磷酸解酶) 和 3.1 類 (水解酶) 酶中的幾個亞類。
內切核糖核酸酶 內切核糖核酸酶是一種核糖核酸酶內切酶。它根據酶的不同,可以切割單鏈或雙鏈 RNA。示例包括單個蛋白質,例如 RNase III、RNase A、RNase T1 和 RNase H,但也包括蛋白質複合物,例如 RNase P 和 RNA 誘導的沉默複合物。
外切核糖核酸酶 外切核糖核酸酶是一種外切核糖核酸酶,它們是透過從 RNA 分子的 5' 端或 3' 端去除末端核苷酸來降解 RNA 的酶。從 5' 端去除核苷酸的酶被稱為 5'-3' 外切核糖核酸酶,而從 3' 端去除核苷酸的酶被稱為 3'-5' 外切核糖核酸酶。
外切核糖核酸酶可以使用水來切割核苷酸之間的鍵(稱為水解活性),也可以使用無機磷酸鹽(稱為磷解活性)。水解外切核糖核酸酶在 EC 號碼 3.1 下分類,而磷解外切核糖核酸酶在 EC 號碼 2.7.7 下分類。由於磷解酶使用無機磷酸鹽來切割鍵,因此它們會釋放核苷酸二磷酸鹽,而水解酶(使用水)則會釋放核苷酸單磷酸鹽。外切核糖核酸酶存在於所有生物界中,包括細菌、古細菌和真核生物。外切核糖核酸酶參與許多不同 RNA 種類的降解,包括信使 RNA、轉運 RNA、核糖體 RNA 和 miRNA。外切核糖核酸酶可以是單個蛋白質(如 RNase D 或 RNase PH),也可以是多個蛋白質的複合物,如外泌體複合物(其中代表了四個主要的核糖核酸酶家族)[33]
RNase A RNase A 是一種相對較小的蛋白質(124 個殘基,約 13.7 kDa)。它可以被描述為一種雙層 α + β 蛋白質,摺疊成兩半,類似於一個玉米卷,有一個深的裂縫用於結合 RNA 底物。第一層由來自蛋白質 N 末端一半的三個 α 螺旋組成(殘基 3-13、24-34 和 50-60)。第二層由三個 β 髮夾組成(殘基 61-74、79-104 和 105-124 來自 C 末端一半),排列成兩個 β 片層。髮夾 61-74 和 105-124 形成了一個四鏈的反平行 β 片層,位於螺旋 3(殘基 50-60)上。最長的 β 髮夾 79-104 與一條短的 β 鏈(殘基 42-45)配對,形成一個三鏈的反平行 β 片層,位於螺旋 2(殘基 24-34)上。RNase A 在其天然狀態下有四個二硫鍵:Cys26-Cys84、Cys58-110、Cys40-95 和 Cys65-72。前兩個(26-84 和 58-110)對於構象摺疊至關重要;每個都將第一層的 α 螺旋連線到第二層的 β 片層,在其附近形成一個小的疏水核心。後兩個二硫鍵(40-95 和 65-72)對於摺疊來說不太重要;其中任何一個都可以被還原(但不能同時還原)而不會影響生理條件下的天然結構。這些二硫鍵連線環段,並且相對暴露在溶劑中。有趣的是,65-72 二硫鍵具有非常高的形成傾向,遠遠超過肽和全長蛋白質中預期的環熵。這表明 61-74 β 髮夾具有很高的構象摺疊傾向。RNase A 是一種鹼性蛋白質(pI = 8.63);它的大量正電荷與其結合 RNA(一種多陰離子)一致。更普遍地說,RNase A 異常極性,或者說,異常缺乏疏水基團,尤其是脂肪族基團。這可能是其需要四個二硫鍵來穩定其結構的原因。低疏水含量還可以減少高度帶電基團(其自身和其底物 RNA 的基團)與低介電常數區域(非極性殘基)之間的物理排斥。RNase A 的 N 末端 α 螺旋(殘基 3-13)透過一個靈活的連線體(殘基 16-23)連線到 RNase A 的其餘部分。如 F. M. Richards 所示,該連線體可以透過枯草桿菌蛋白酶在殘基 20 和 21 之間被切割,而不會導致 N 末端螺旋從 RNase A 的其餘部分解離。肽-蛋白質複合物稱為 RNase S,肽(殘基 1-20)稱為 S-肽,其餘部分(殘基 21-124)稱為 S-蛋白質。S-肽對 S-蛋白質的解離常數約為 30 pM;這種緊密的結合可用於蛋白質純化,方法是將 S-肽連線到目標蛋白質上,並將混合物透過一個帶有結合的 S-蛋白質的親和柱。[一個更小的 C-肽(殘基 1-13)也可以工作。] RNase S 模型系統也被用於研究蛋白質摺疊,方法是將摺疊和締合耦合在一起。S-肽是第一個來自天然蛋白質的肽,被證明在分離狀態下具有(閃爍的)二級結構(由 Klee 和 Brown 在 1967 年發現)。[34]
RNase H 在分子生物學實驗室中,由於 RNase H 特異性地降解 RNA:DNA 雜交體中的 RNA,而不會降解 DNA 或非雜交 RNA,因此它通常用於在逆轉錄酶逆轉錄合成第一鏈互補 DNA(cDNA)後破壞 RNA 模板,以及核酸酶保護測定等程式。RNase H 也可以用於在 cDNA 寡核苷酸雜交時降解特定的 RNA 鏈,例如從與 oligo(dT) 雜交的 mRNA 中去除 poly(A) 尾巴,或破壞活細胞內部或外部的選定非編碼 RNA。為了終止反應,通常新增螯合劑,如 EDTA,以螯合反應混合物中所需的金屬離子。RNase H 酶是一種非特異性內切核酸酶,並透過水解機制催化 RNA 的切割。RNase H 家族的成員幾乎可以在所有生物體中找到,從古細菌和原核生物到真核生物。
RNase H 的 3-D 結構通常由一個被 α 螺旋分佈包圍的 5 鏈 β 片層組成。在一些 RNase H 中,例如在 HIV-1 中發現的 RNase H,該酶缺少一個稱為 C 螺旋的螺旋,這是一個帶正電的 α 螺旋,其突出形狀增加了底物結合能力。該酶的活性位點圍繞一個保守的 DEDD 基序(由殘基組成:D443、E478、D498 和 D549)集中,該基序執行 RNA 底物的水解。鎂離子通常用作水解步驟中的輔因子。這是一種可能的但未經證實的機制,其中多個離子對於執行水解是必要的。該酶還包含一個大約 60 Å 長的核酸結合裂縫,可以包含 18 個結合的 RNA/DNA 鹼基對區域。RNase H 的核糖核酸酶活性切割 DNA/RNA 雙鏈中 RNA 的 3’-O-P 鍵,產生 3’-羥基和 5’-磷酸終止產物。在 DNA 複製中,RNase H 負責去除 RNA 引物,從而完成新合成的 DNA。[35]
RNAi
[edit | edit source]
RNAi 的發現早於反義 RNA 在轉基因植物中表達導致轉錄抑制的觀察[37],更直接地說是由 1990 年代初美國和荷蘭的植物科學家在實驗中觀察到的意外結果[38]。為了改變牽牛花的花色,研究人員將編碼查耳酮合酶的基因的額外複製(一種花色素沉著的重要酶)引入到通常為粉紅色或紫色的牽牛花中。過表達的基因預計會導致更深的花朵,但相反,它產生了色素沉著更少的,完全或部分白色的花朵,表明查耳酮合酶的活性已大幅下降;事實上,白色花朵中的內源基因和轉基因都被下調。不久之後,在真菌粗糙脈孢黴中觀察到了一種相關的事件,稱為抑制[39],儘管當時並沒有立即認識到它與之相關。對植物中這種現象的進一步研究表明,下調是由於透過增加 mRNA 降解速率導致的基因表達的轉錄後抑制[40]。這種現象被稱為基因表達的共抑制,但其分子機制仍然未知[41]。

不久之後,從事提高植物抗病毒病能力的植物病毒學家觀察到類似的意外現象。雖然眾所周知,表達病毒特異性蛋白質的植物表現出增強的對病毒感染的耐受性或抵抗力,但人們沒有想到的是,僅攜帶病毒 RNA 序列的短片段非編碼區域的植物會表現出類似的保護水平。研究人員認為,轉基因產生的病毒 RNA 也可以抑制病毒複製[43]。反向實驗,其中將植物基因的短序列引入病毒,表明目標基因在受感染的植物中被抑制。這種現象被稱為“病毒誘導的基因沉默”(VIGS),而這一系列現象統稱為轉錄後基因沉默[44]。
在植物中觀察到這些初步現象後,世界各地的許多實驗室開始研究這種現象是否也存在於其他生物體中。[45] [46] 1998 年,克雷格·梅洛和安德魯·法爾在《自然》雜誌上發表了一篇論文,報道了將雙鏈 RNA 注入秀麗隱杆線蟲後,觀察到了一種強大的基因沉默效應。在研究肌肉蛋白產生的調控過程中,他們發現無論是 mRNA 還是反義 RNA 注射都沒有影響蛋白的產生,但雙鏈 RNA 成功地沉默了目標基因。基於這項研究,他們創造了“RNAi”這個術語。法爾和梅洛的發現尤為突出,因為它首次確定了這種現象的致病因子。由於他們的工作,法爾和梅洛獲得了 2006 年諾貝爾生理學或醫學獎。
RNAi 是一種依賴於 RNA 的基因沉默過程,由 RNA 誘導沉默複合物 (RISC) 控制,由細胞質中的短雙鏈 RNA 分子引發,這些分子與催化性 RISC 成分 Argonaute 相互作用。當 dsRNA 來自外源 (來自具有 RNA 基因組的病毒感染或實驗室操作) 時,RNA 會直接匯入細胞質並被 Dicer 酶切割成短片段。引發性 dsRNA 也可能來自內源 (起源於細胞),就像基因組中編碼 RNA 的基因表達的 pre-microRNA 一樣。來自這些基因的初級轉錄本首先在細胞核中被加工成 pre-miRNA 的特徵性莖環結構,然後被轉運到細胞質中,並被 Dicer 切割。因此,外源和內源的兩種 dsRNA 途徑在 RISC 複合物處匯聚。[47]
dsRNA 切割
內源 dsRNA 透過啟用核糖核酸酶蛋白 Dicer 來啟動 RNAi,Dicer 結合並切割雙鏈 RNA (dsRNA) 來產生 20-25 個鹼基對的雙鏈片段,並在 3' 端具有 2 個核苷酸的突出部分。對多種生物基因組進行的生物資訊學研究表明,這種長度最大限度地提高了靶基因的特異性並最大限度地減少了非特異性效應。[10] 這些短的雙鏈片段被稱為小干擾 RNA (siRNA)。這些 siRNA 然後被分離成單鏈並整合到一個活性 RISC 複合物中。整合到 RISC 後,siRNA 與其靶 mRNA 配對並誘導 mRNA 切割,從而阻止其用作翻譯模板。
RISC
RNA 誘導沉默複合物 (RISC) 是一種多蛋白複合物,包含一小干擾 RNA (siRNA) 或 micro RNA (miRNA) 的一條鏈。RISC 使用 siRNA 或 miRNA 作為模板來識別互補的 mRNA。當它找到互補鏈時,它就會啟用 RNase 並切割 RNA。此過程在 microRNA 調控基因表達和抵禦病毒感染方面都至關重要,病毒感染通常使用雙鏈 RNA 作為感染載體。
RNA 誘導沉默複合物 (RISC) 的活性成分是稱為 Argonaute 蛋白的內切核酸酶,它們切割與其結合的 siRNA 互補的靶 mRNA 鏈。由於 Dicer 產生的片段是雙鏈的,因此理論上它們每個都可以產生一個功能性 siRNA。然而,只有兩條鏈中的一條 (被稱為引導鏈) 結合 Argonaute 蛋白並引導基因沉默。另一條反引導鏈或乘客鏈在 RISC 活化過程中被降解。
Dicer
Dicer 是 RNase III 家族中的一種核糖核酸內切酶,它將雙鏈 RNA (dsRNA) 和 pre-microRNA (miRNA) 切割成稱為小干擾 RNA (siRNA) 的短雙鏈 RNA 片段,長度約為 20-25 個核苷酸,通常在 3' 端具有兩個鹼基的突出部分。Dicer 包含兩個 RNase III 結構域和一個 PAZ 結構域;這兩個區域之間的距離由連線螺旋的長度和角度決定,並決定了它產生的 siRNA 的長度。Dicer 催化 RNA 干擾途徑中的第一步,並啟動 RNA 誘導沉默複合物 (RISC) 的形成,其催化成分 Argonaute 是一種能夠降解信使 RNA (mRNA) 的內切核酸酶,該 mRNA 的序列與其 siRNA 指導鏈互補。[48] 該基因的人類版本是 DICER1。
RNAi 和疾病控制
[編輯 | 編輯原始碼]在治療中利用 RNA 干擾可能是可行的。雖然由於干擾素反應很難將長的 dsRNA 鏈引入哺乳動物細胞,但使用短干擾 RNA 模擬物取得了更大的成功。在進入臨床試驗的首批應用中,包括治療黃斑變性症和呼吸道合胞病毒,RNAi 還被證明可以有效逆轉小鼠模型中誘導的肝衰竭。
其他提出的臨床應用集中在抗病毒治療上,包括使用 RNAi 來治療感染的區域性微殺劑治療 (在哈佛大學醫學院;目前在小鼠中),例如抑制 2 型單純皰疹病毒感染,以及抑制癌細胞中病毒基因表達,敲除 HIV 的宿主受體和輔助受體,沉默乙型肝炎和丙型肝炎基因,沉默流感病毒基因表達,以及抑制麻疹病毒複製。還提出了用於治療神經退行性疾病的潛在療法,尤其關注亨廷頓氏舞蹈症等多聚谷氨醯胺疾病。RNA 干擾通常被認為是一種很有前景的治療癌症的方法,透過沉默在腫瘤細胞中差異上調的基因或參與細胞分裂的基因來實現。在將 RNAi 用於臨床應用的研究中,一個關鍵領域是開發安全的遞送方法,到目前為止,這主要涉及類似於基因治療的病毒載體系統。
MicroRNA (miRNA)
[編輯 | 編輯原始碼]MicroRNA 於 1993 年由維克多·安布羅斯、羅莎琳德·李和羅達·費恩鮑姆在研究秀麗隱杆線蟲發育中的 lin-14 基因時發現。他們發現 LIN-14 蛋白的丰度受 lin-4 基因編碼的短 RNA 產物調控。來自 lin-4 基因的 61 個核苷酸前體成熟成一個 22 個核苷酸的 RNA,該 RNA 包含與 lin-14 mRNA 3' UTR 中多個序列部分互補的序列。這種互補性足以且有必要抑制 lin-14 mRNA 翻譯成 LIN-14 蛋白。回顧過去,lin-4 小 RNA 是第一個被識別的 microRNA,儘管當時人們認為它只是線蟲的一種特異性現象。直到 2000 年,人們才鑑定了第二個 RNA:let-7,它在秀麗隱杆線蟲發育階段轉換過程中抑制了 lin-41、lin-14、lin-28、lin-42 和 daf-12 的表達。let-7 很快被發現儲存在許多物種中,表明存在更廣泛的現象。
MicroRNA (miRNA) 是短的核糖核酸 (RNA) 分子,平均只有 22 個核苷酸長,存在於所有真核細胞中。miRNA 是轉錄後調節因子,它們與靶信使 RNA 轉錄物 (mRNA) 上的互補序列結合,通常導致翻譯抑制和基因沉默。
miRNA 的功能似乎是基因調控。為此,miRNA 與一個或多個信使 RNA (mRNA) 的一部分互補。動物 miRNA 通常與 3' UTR 中的一個位點互補,而植物 miRNA 通常與 mRNA 的編碼區互補。與靶 RNA 完美或幾乎完美的鹼基配對促進 RNA 的切割。這是植物 microRNA 的主要模式。在動物中,microRNA 更常只部分配對並抑制靶 mRNA 的蛋白質翻譯 (這在植物中也存在,但不太常見)。部分互補的 microRNA 也可以加速去腺苷化,導致 mRNA 更快地降解。對於部分互補的 microRNA 來識別其靶標,miRNA 的 2-7 個核苷酸 (其“種子區”) 仍然必須完美互補。[68] miRNA 有時也會引起啟動子位點的組蛋白修飾和 DNA 甲基化,從而影響靶基因的表達。動物 microRNA 特別針對發育基因。相反,參與所有細胞共同功能 (例如基因表達) 的基因只有很少的 microRNA 靶位點,似乎在選擇中避免被 microRNA 靶向。dsRNA 也可以啟用基因表達,這種機制被稱為“小 RNA 誘導的基因啟用”或 RNAa。靶向基因啟動子的 dsRNA 可以誘導相關基因的強力轉錄啟用。這在人類細胞中使用稱為小啟用 RNA (saRNA) 的合成 dsRNA 進行了證明,但對於內源 microRNA 也得到了證明。[49]
miRNA 和疾病
正如 miRNA 參與真核細胞的正常功能一樣,miRNA 的失調也與疾病相關。一個手動整理的、公開可用的資料庫 miR2Disease 記錄了已知的 miRNA 失調與人類疾病之間的關係。
**miRNA 和癌症** 已經發現幾種 miRNA 與某些型別的癌症有關。一項對改造後的產生過量 c-Myc 的小鼠 (一種與多種癌症相關的突變形式蛋白) 的研究表明,miRNA 對癌症的發展有影響。被改造為產生淋巴瘤細胞中發現的過量型別 miRNA 的小鼠在 50 天內患上了該疾病,並在兩週後死亡。相比之下,沒有過量 miRNA 的小鼠存活了 100 多天。白血病可能是由於病毒基因組插入到 microRNA 的 17-92 陣列旁邊導致這種 microRNA 表達增加引起的。另一項研究發現,兩種型別的 miRNA 抑制 E2F1 蛋白,該蛋白調節細胞增殖。miRNA 似乎在信使 RNA 被翻譯成開啟和關閉基因的蛋白質之前就與信使 RNA 結合。透過測量編碼 miRNA 的 217 個基因的活性,可以辨別出可以區分癌症型別的基因活性模式。miRNA 特徵可能使癌症分類成為可能。這將使醫生能夠確定產生癌症的原始組織型別,並能夠根據原始組織型別進行靶向治療方案。miRNA 譜分析已經能夠確定慢性淋巴細胞白血病患者的癌症是緩慢生長還是侵襲性。過表達或缺乏特定 miRNA 的轉基因小鼠為深入瞭解小 RNA 在各種惡性腫瘤中的作用提供了見解。一種新的基於 miRNA 譜分析的早期結直腸癌檢測篩選方法已經開發出來,目前正在進行臨床試驗。早期結果表明,從早期、可切除 (II 期) 結直腸癌患者收集的血漿樣本可以與性別和年齡匹配的健康志願者區分開來。使用少量 (小於 1 毫升) 的血液樣本可以實現足夠的選擇性和特異性。該測試有可能成為一種經濟高效、無創的方法,用於識別應進行結腸鏡檢查的高風險患者。
miRNA 和心臟病 透過條件性抑制小鼠心臟中的 miRNA 成熟,已闡明瞭 miRNA 在心臟中的全域性作用,並揭示了 miRNA 在心臟發育中的重要作用。miRNA 表達譜分析表明,特定 miRNA 的表達水平在患病的人類心臟中發生變化,這表明它們與心肌病有關。此外,對動物模型中特定 miRNA 的研究已經確定了 miRNA 在心臟發育和病理條件下的不同作用,包括對心肌生成、肥大生長反應和心臟傳導的重要因子的調節。
miRNA 和神經系統 miRNA 似乎調節著神經系統。神經 miRNA 參與突觸發育的各個階段,包括樹突形成(涉及 miR-132、miR-134 和 miR-124)、突觸形成和突觸成熟(據認為 miR-134 和 miR-138 參與其中)。一些研究發現精神分裂症患者的 miRNA 表達發生改變。
這是一個自然界中RNA 列表。其中一些類別很寬泛,另一些則是單個 RNA 家族。
| 型別 | 縮寫 | 功能 | 分佈 | 參考 |
|---|---|---|---|---|
| 信使 RNA | mRNA | 編碼蛋白質 | 所有生物體 | |
| 核糖體 RNA | rRNA | 翻譯 | 所有生物體 | |
| 訊號識別顆粒 RNA | 7SL RNA 或 SRP RNA | 膜整合 | 所有生物體 | [50] |
| 轉運 RNA | tRNA | 翻譯 | 所有生物體 | |
| 轉運-信使 RNA | tmRNA | 拯救停滯的核糖體 | 細菌 | [51] |
| 型別 | 縮寫 | 功能 | 分佈 | 參考 |
|---|---|---|---|---|
| 小核 RNA | snRNA | 剪接和其他功能 | 真核生物和古細菌 | [52] |
| 小核仁 RNA | snoRNA | RNA 的核苷酸修飾 | 真核生物和古細菌 | [53] |
| SmY RNA | SmY | mRNA 轉剪接 | 線蟲 | [54] |
| 小卡哈爾體特異性 RNA | scaRNA | snoRNA 型別;RNA 的核苷酸修飾 | ||
| 引導 RNA | gRNA | mRNA 核苷酸修飾 | 動基體線粒體 | [55] |
| 核糖核酸酶 P | RNase P | tRNA 成熟 | 所有生物體 | [56] |
| 核糖核酸酶 MRP | RNase MRP | rRNA 成熟,DNA 複製 | 真核生物 | [57] |
| Y RNA | RNA 加工,DNA 複製 | 動物 | [58] | |
| 端粒酶 RNA | 端粒合成 | 大多數真核生物 | [59] |
| 型別 | 縮寫 | 功能 | 分佈 | 參考 |
|---|---|---|---|---|
| 反義 RNA | aRNA | 轉錄衰減/mRNA 降解/mRNA 穩定/翻譯阻滯 | 所有生物體 | [60][61] |
| 順式天然反義轉錄本 | 基因調控 | |||
| CRISPR RNA | crRNA | 抵抗寄生蟲,可能是透過靶向其 DNA | 細菌和古細菌 | [62] |
| 長非編碼 RNA | Long ncRNA | 多種多樣 | 真核生物 | |
| 微小 RNA | miRNA | 基因調控 | 大多數真核生物 | [63] |
| Piwi 相互作用 RNA | piRNA | 轉座子防禦,可能還有其他功能 | 大多數動物 | [64][65] |
| 小干擾 RNA | siRNA | 基因調控 | 大多數真核生物 | [66] |
| 反式作用 siRNA | tasiRNA | 基因調控 | 陸地植物 | [67] |
| 重複相關 siRNA | rasiRNA | piRNA 型別;轉座子防禦 | 果蠅 | [68] |
| 7SK RNA | 7SK | 負向調節 CDK9/cyclin T 複合物 |
| 型別 | 功能 | 分佈 | 參考 |
|---|---|---|---|
| 逆轉座子 | 自我複製 | 真核生物和一些細菌 | [69] |
| 病毒基因組 | 資訊載體 | 雙鏈 RNA 病毒、正鏈 RNA 病毒、負鏈 RNA 病毒、許多衛星病毒和逆轉錄病毒 | |
| 類病毒 | 自我複製 | 受感染的植物 | [70] |
| 衛星 RNA | 自我複製 | 受感染的細胞 |
| 型別 | 縮寫 | 功能 | 分佈 | 參考 |
|---|---|---|---|---|
| 拱頂 RNA | vRNA | 可能排出異生素 | [71] |
- ↑ RNA
- ↑ Dahm R (2005). "Friedrich Miescher and the discovery of DNA". Developmental Biology. 278 (2): 274–88. doi:10.1016/j.ydbio.2004.11.028. PMID 15680349.
- ↑ Caspersson T, Schultz J (1939). "Pentose nucleotides in the cytoplasm of growing tissues". Nature. 143: 602–3. doi:10.1038/143602c0.
- ↑ Ochoa S (1959). "Enzymatic synthesis of ribonucleic acid" (PDF). Nobel Lecture.
- ↑ Holley RW; et al. (1965). "Structure of a ribonucleic acid". Science. 147 (1664): 1462–65. doi:10.1126/science.147.3664.1462. PMID 14263761.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ↑ Siebert S (2006). "Common sequence structure properties and stable regions in RNA secondary structures" (PDF). Dissertation, Albert-Ludwigs-Universität, Freiburg im Breisgau. p. 1.
- ↑ Szathmáry E (1999). "The origin of the genetic code: amino acids as cofactors in an RNA world". Trends Genet. 15 (6): 223–9. doi:10.1016/S0168-9525(99)01730-8. PMID 10354582.
- ↑ Fiers W 等人 (1976)。“噬菌體 MS2-RNA 的完整核苷酸序列:複製酶基因的初級和二級結構”。自然。260 (5551): 500–7。 doi:10.1038/260500a0。 PMID 1264203.
{{cite journal}}: 在 |author= 中顯式使用 et al. (幫助) - ↑ Napoli C, Lemieux C, Jorgensen R (1990)。“將嵌合查爾酮合酶基因匯入矮牽牛會導致轉座同源基因的可逆共抑制”。植物細胞。2 (4): 279–89。 doi:10.1105/tpc.2.4.279。 PMC 159885。 PMID 12354959.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ Dafny-Yelin M, Chung SM, Frankman EL, Tzfira T (2007)。“pSAT RNA 干擾載體:用於植物中多個基因下調的模組化系列”。植物生理。145 (4): 1272–81。 doi:10.1104/pp.107.106062。 PMC 2151715。 PMID 17766396.
{{cite journal}}: 未知引數 |month= 被忽略 (幫助)CS1 maint: 多個名稱:作者列表 (連結) - ↑ Ruvkun G (2001)。“微小 RNA 世界的瞥見”。科學。294 (5543): 797–99。 doi:10.1126/science.1066315。 PMID 11679654.
- ↑ Fichou Y, Férec C (2006)。“寡核苷酸在治療應用中的潛力”。生物技術趨勢。24 (12): 563–70。 doi:10.1016/j.tibtech.2006.10.003。 PMID 17045686.
- ↑ 小核仁 RNA
- ↑ 反義 RNA
- ↑ RNA
- ↑ http://www.madsci.org
- ↑ Horton,Robert H.;等人。生物化學原理。第 3 版。新澤西州上鞍河:普倫蒂斯·霍爾,2002 年。
- ↑ Zorbach,W.W. 核酸化學合成程式:結構測定的物理和物理化學輔助。第 2 卷。紐約:Wiley-Interscience,1973 年。
- ↑ Lee,J.K.;Kurinovich,Ma。J Am Soc Mass Spectrom.13(8),2005 年,985-95。
- ↑ SnRNP
- ↑ 酶定義 Dictionary.com 2007 年 4 月 6 日訪問
- ↑ Carl Woese,遺傳密碼(紐約:Harper and Row,1967 年)。
- ↑ 1989 年諾貝爾化學獎頒發給了 Thomas R. Cech 和 Sidney Altman,以表彰他們“發現 RNA 的催化特性”。
- ↑ Kruger K, Grabowski PJ, Zaug AJ, Sands J, Gottschling DE, Cech TR (1982)。“自剪接 RNA:四膜蟲核糖體 RNA 插入序列的自動切除和自動環化”。細胞。31 (1): 147–57。 PMID 6297745.
{{cite journal}}: 未知引數 |month= 被忽略 (幫助)CS1 maint: 多個名稱:作者列表 (連結) - ↑ Forster AC, Symons RH (1987)。“病毒體及其結構模型的正反義 RNA 的自剪下”。細胞。49 (2): 211–220。 doi:10.1016/0092-8674(87)90562-9。 PMID 2436805.
- ↑ Johnston W, Unrau P, Lawrence M, Glasner M, Bartel D (2001)。“RNA 催化的 RNA 聚合:準確且通用的 RNA 模板引物延伸” (PDF)。科學。292 (5520): 1319–25。 doi:10.1126/science.1060786。 PMID 11358999.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ W. K. Johnston,P. J. Unrau,M. S. Lawrence,M. E. Glasner 和 D. P. Bartel RNA 催化的 RNA 聚合:準確且通用的 RNA 模板引物延伸。科學 292,1319 (2001)
- ↑ Hani S. Zaher 和 Peter J. Unrau,選擇具有優越延伸性和保真度的改進的 RNA 聚合酶核酶。RNA (2007),13:1017-1026
- ↑ Huang,Yang 和 Yarus,具有兩種小分子底物的 RNA 酶。化學與生物學,第 5 卷,669-678,1998 年 11 月
- ↑ Unrau, P. J. (1998). "RNA 催化的核苷酸合成". 自然. 395 (6699): 260–263. doi:10.1038/26193. PMID 9751052.
{{cite journal}}: 引文格式有錯誤:缺少引數:|month=(幫助); 忽略了未知引數:|coauthors=(|author=建議用) (幫助) - ↑ Zhang, Biliang (1997). "體外選擇的核酶介導的肽鍵形成". 自然. 390 (6655): 96–100. doi:10.1038/36375. PMID 9363898.
{{cite journal}}: 引文格式有錯誤:缺少引數:|month=(幫助); 忽略了未知引數:|coauthors=(|author=建議用) (幫助) - ↑ Szathmary, E. (1999). "遺傳密碼的起源:RNA 世界中的氨基酸作為輔因子". 遺傳學趨勢. 15 (6): 223–229. doi:10.1016/S0168-9525(99)01730-8. PMID 10354582.
{{cite journal}}: 引文格式有錯誤:缺少引數:|month=和|coauthors=(幫助) - ↑ 核糖核酸酶
- ↑ http://en.wikipedia.org/w/index.php?title=Ribonuclease_A&oldid=417169401
- ↑ http://en.wikipedia.org/w/index.php?title=RNase_H&oldid=422163070
- ↑ Macrae I, Zhou K, Li F, Repic A, Brooks A, Cande W, Adams P, Doudna J (2006). "Dicer 介導的雙鏈 RNA 加工的結構基礎". 科學. 311 (5758): 195–8. doi:10.1126/science.1121638. PMID 16410517.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (連結) - ↑ Ecker JR, Davis RW (1986). "透過反義 RNA 表達抑制植物細胞基因表達". 美國國家科學院院刊. 83 (15): 5372–5376. doi:10.1073/pnas.83.15.5372. PMC 386288. PMID 16593734.
- ↑ Napoli C, Lemieux C, Jorgensen R (1990). "將嵌合查爾酮合酶基因匯入矮牽牛會導致同源基因反式沉默的可逆性". 植物細胞. 2 (4): 279–289. doi:10.1105/tpc.2.4.279. PMC 159885. PMID 12354959.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (連結) - ↑ Romano N, Macino G (1992). "沉默:透過同源序列轉化使鏈孢黴基因表達短暫失活". 分子微生物學. 6 (22): 3343–53. doi:10.1111/j.1365-2958.1992.tb02202.x. PMID 1484489.
- ↑ Van Blokland R, Van der Geest N, Mol JNM, Kooter JM (1994). "矮牽牛中轉基因介導的查爾酮合酶表達抑制是由 RNA 週轉率增加引起的". 植物雜誌. 6: 861–77. doi:10.1046/j.1365-313X.1994.6060861.x/abs/.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (連結) - ↑ Mol JNM, van der Krol AR (1991). 反義核酸和蛋白質:基礎和應用. M. Dekker. pp. 4, 136. ISBN 0824785169.
- ↑ Matzke MA, Matzke AJM. (2004). "播下新正規化的種子". PLOS 生物學. 2 (5): e133. doi:10.1371/journal.pbio.0020133. PMC 406394. PMID 15138502.
- ↑ Covey S,Al-Kaff N,Lángara A,Turner D(1997)。“植物透過基因沉默對抗感染”。自然。385:781–2。 doi:10.1038/385781a0.
{{cite journal}}:CS1 維護:多個名稱:作者列表 (link) - ↑ Ratcliff F,Harrison B,Baulcombe D(1997)。“植物病毒防禦與基因沉默之間的相似性”。科學。276:1558–60。 doi:10.1126/science.276.5318.1558。 PMID 18610513.
{{cite journal}}:CS1 維護:多個名稱:作者列表 (link) - ↑ Guo S,Kemphues K(1995)。“par-1,一個建立秀麗隱杆線蟲胚胎極性的基因,編碼一個不對稱分佈的推定Ser/Thr激酶”。細胞。81(4):611–20。 doi:10.1016/0092-8674(95)90082-9。 PMID 7758115.
- ↑ Pal-Bhadra M,Bhadra U,Birchler J(1997)。“果蠅中的共抑制:白色-Adh 轉基因對酒精脫氫酶的基因沉默依賴於多梳蛋白”。細胞。90(3):479–90。 doi:10.1016/S0092-8674(00)80508-5。 PMID 9267028.
{{cite journal}}:CS1 維護:多個名稱:作者列表 (link) - ↑ Bagasra O,Prilliman KR(2004)。“RNA 干擾:分子免疫系統” (PDF)。J. Mol. Histol。35(6):545–53。 doi:10.1007/s10735-004-2192-8。 PMID 15614608.
- ↑ Jaronczyk K,Carmichael J,Hobman T(2005)。“探索 RNA 干擾途徑蛋白的功能:有些功能比其他功能更冒險?”。Biochem J。387(第 3 部分):561–71。 doi:10.1042/BJ20041822。 PMC 1134985。 PMID 15845026.
{{cite journal}}:CS1 維護:多個名稱:作者列表 (link) - ↑ 微小RNA
- ↑ Gribaldo1 S,Brochier-Armanet C(2006)。“古菌的起源和進化:現狀”。Philos Trans R Soc Lond B Biol Sci。361(1470):1007–22。 doi:10.1098/rstb.2006.1841。 PMC 1578729。 PMID 16754611.
- ↑ Gillet R,Felden B(2001)。“關於 tmRNA 介導的蛋白質標記和核糖體拯救的新觀點”。分子微生物學。42(4):879–85。 doi:10.1046/j.1365-2958.2001.02701.x。 PMID 11737633.
- ↑ Thore S,Mayer C,Sauter C,Weeks S,Suck D(2003)。“深海熱液球菌Sm 核心的晶體結構及其與 RNA 的複合物”。J. Biol. Chem。278(2):1239–47。 doi:10.1074/jbc.M207685200。 PMID 12409299.
{{cite journal}}:CS1 維護:多個名稱:作者列表 (link) - ↑ Kiss T(2001)。“小核仁 RNA 引導的細胞 RNA 轉錄後修飾”。歐洲分子生物學組織雜誌。20(14):3617–22。 doi:10.1093/emboj/20.14.3617。 PMC 125535。 PMID 11447102.
- ↑ Jones TA, Otto W, Marz M, Eddy SR, Stadler PF (2009). "線蟲 SmY RNA 的調查". RNA Biol. 6 (1): 5–8. doi:10.4161/rna.6.1.7634. PMID 19106623.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Alfonzo JD, Thiemann O, Simpson L (1997). "動基體線粒體中 U 插入/缺失 RNA 編輯的機制". Nucleic Acids Research. 25 (19): 3751–59. doi:10.1093/nar/25.19.3751. PMC 146959. PMID 9380494.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Pannucci JA, Haas ES, Hall TA, Harris JK, Brown JW (1999). "一些古細菌的 RNase P RNA 具有催化活性". Proc Natl Acad Sci USA. 96 (14): 7803–08. doi:10.1073/pnas.96.14.7803. PMC 22142. PMID 10393902.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Woodhams MD, Stadler PF, Penny D, Collins LJ (2007). "RNase MRP 和真核祖先的 RNA 加工級聯". BMC Evolutionary Biology. 7: S13. doi:10.1186/1471-2148-7-S1-S13. PMC 1796607. PMID 17288571.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Perreault J, Perreault J-P, Boire G (2007). "後生動物中 Ro 相關的 Y RNA:進化和多樣化". Molecular Biology and Evolution. 24 (8): 1678–89. doi:10.1093/molbev/msm084. PMID 17470436.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Lustig AJ (1999). "危機干預:端粒酶的作用". Proc Natl Acad Sci USA. 96 (7): 3339–41. doi:10.1073/pnas.96.7.3339. PMC 34270. PMID 10097039.
- ↑ Brantl S (2002). "反義 RNA 調節和 RNA 干擾". Biochimica et Biophysica Acta. 1575 (1–3): 15–25. PMID 12020814.
- ↑ Brantl S (2007). "順式編碼反義 RNA 採用的調控機制". Curr. Opin. Microbiol. 10 (2): 102–9. doi:10.1016/j.mib.2007.03.012. PMID 17387036.
- ↑ Brouns SJ,Jore MM,Lundgren M 等人。 (2008)。“Small CRISPR RNAs guide antiviral defense in prokaryotes”。科學。321 (5891): 960–4。doi:10.1126/science.1159689。PMID 18703739.
{{cite journal}}: Explicit use of et al. in:|author=(help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Lin S-L,Miller JD,Ying S-Y (2006)。“內含子 microRNA (miRNA)”。生物醫學與生物技術雜誌。2006 (4): 1–13。doi:10.1155/JBB/2006/26818。PMC 1559912。PMID 17057362.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Horwich MD,Li C Matranga C,Vagin V,Farley G,Wang P,Zamore PD (2007)。“果蠅 RNA 甲基轉移酶,DmHen1,修飾生殖系 piRNA 和 RISC 中的單鏈 siRNA”。當代生物學。17 (14): 1265–72。doi:10.1016/j.cub.2007.06.030。PMID 17604629.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Ghildiyal M,Zamore PD (2009)。“小型沉默 RNA:一個不斷擴充套件的宇宙”。自然遺傳學評論。10 (2): 94–108。doi:10.1038/nrg2504。PMC 2724769。PMID 19148191.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Ahmad K,Henikoff S (2002)。“核小體動力學的表觀遺傳學後果”。細胞。111 (3): 281–84。doi:10.1016/S0092-8674(02)01081-4.
- ↑ Vazquez F,Vaucheret H (2004)。“內源性反式作用 siRNA 調節擬南芥 mRNA 的積累”。分子細胞。2006 (16): 1–13。doi:10.1155/JBB/2006/26818。PMC 1559912。PMID 17057362.
- ↑ Desset S,Buchon N,Meignin C,Coiffet M,Vaury C (2008)。“在黑腹果蠅中,COM 基因座透過 Piwi 依賴性和非依賴性途徑指導兩種逆轉錄轉座子的體細胞沉默”。PLoS ONE。3 (2): e1526。doi:10.1371/journal.pone.0001526。PMC 2211404。PMID 18253480.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Boeke JD (2003)。“逆轉錄轉座子的非尋常系統發育分佈:一種假設”。基因組研究。13 (9): 1975–83。doi:10.1101/gr.1392003。PMID 12952870.
- ↑ Flores R,Hernández C,Martínez de Alba AE,Daròs JA,Di Serio F(2005)。“類病毒和類病毒-宿主相互作用”。植物病理學年度評論。43:117–39。 doi:10.1146/annurev.phyto.43.040204.140243。 PMID 16078879.
{{cite journal}}:CS1 維護:作者列表有多個名稱 (link) - ↑ Gopinath SC,Matsugami A,Katahira M,Kumar PK(2005)。“人類拱頂相關非編碼 RNA 與化療藥物米託蒽醌結合”。核酸研究。33(15):4874–81。 doi:10.1093/nar/gki809。 PMC 1201340。 PMID 16150923.
{{cite journal}}:CS1 維護:作者列表有多個名稱 (link)