分子生物學導論/RNA 轉錄及其修飾
真核細胞中mRNA的“生命週期”。RNA 在細胞核中轉錄;經過處理,它被運輸到細胞質中,並被核糖體翻譯。在生命結束時,mRNA 被降解。
在轉錄中,基因的密碼子被 RNA 聚合酶複製到信使 RNA 中。簡單來說,就是從 DNA 形成 RNA 的過程被稱為轉錄。然後,這種 RNA 複製被核糖體解碼,核糖體透過將信使 RNA 與攜帶氨基酸的轉移 RNA 配對來讀取 RNA 序列。由於有 4 種鹼基以 3 個字母的組合存在,因此有 64 種可能的密碼子(43 種組合)。這些密碼子編碼 20 種標準氨基酸,使大多數氨基酸具有不止一種可能的密碼子。還有三個“終止”或“無義”密碼子表示編碼區的結束;它們是 TAA、TGA 和 TAG 密碼子。

轉錄可以簡單地用 4 或 5 個步驟解釋,每個步驟像波浪一樣沿著 DNA 傳播。
DNA 解旋/"解開",因為氫鍵斷裂。
RNA 的遊離核苷酸與互補的 DNA 鹼基配對。
RNA 糖-磷酸骨架形成。(在 RNA 聚合酶的幫助下。)
解開的 RNA+DNA "梯子" 的氫鍵斷裂,釋放新的 RNA。
如果細胞有細胞核,RNA 將被進一步處理,然後透過小的核孔進入細胞質。轉錄過程的主要步驟是
- 前起始複合物的形成
- 轉錄起始
- 啟動子清除
- RNA 的延伸
- 終止
在真核生物中,RNA 聚合酶,以及因此的轉錄起始,需要 DNA 中存在一個核心啟動子序列。啟動子是促進轉錄的 DNA 區域,在真核生物中,它們位於轉錄起始位點上游 -30、-75 和 -90 個鹼基對處。核心啟動子是啟動子內的序列,對於轉錄起始至關重要。RNA 聚合酶能夠在各種特定轉錄因子的存在下與核心啟動子結合。
真核生物中最常見的核心啟動子型別是稱為TATA 盒的短 DNA 序列,位於轉錄起始位點上游 25-30 個鹼基對處。TATA 盒作為核心啟動子,是稱為TATA 結合蛋白 (TBP) 的轉錄因子的結合位點,而 TBP 本身是另一個稱為轉錄因子 II D (TFIID) 的轉錄因子的亞基。在 TFIID 透過 TBP 與 TATA 盒結合後,另外五個轉錄因子和 RNA 聚合酶在一系列階段結合在 TATA 盒周圍,形成前起始複合物。一個轉錄因子,DNA 解旋酶,具有解旋酶活性,因此參與分離雙鏈 DNA 的相反鏈,以便訪問單鏈 DNA 模板。然而,只有低或基礎的轉錄率由前起始複合物單獨驅動。其他被稱為啟用劑和阻遏物的蛋白質,以及任何相關的輔啟用劑或輔阻遏物,負責調節轉錄率。
因此,前起始複合物包含
- 核心啟動子序列,
- 轉錄因子,
- DNA 解旋酶,
- RNA 聚合酶,
- 啟用劑和阻遏物。
本質上,古菌中的轉錄前起始與真核生物的轉錄前起始同源,但複雜程度低得多。[1] 古菌前起始複合物在 TATA 盒結合位點組裝;然而,在古菌中,該複合物僅由 RNA 聚合酶 II、TBP 和 TFB(真核轉錄因子 II B (TFIIB) 的古菌同源物)組成。[2][3]通常,PIC 由六種通用轉錄因子組成:TFIIA (GTF2A1, GTF2A2)、TFIIB (GTF2B)、B-TFIID (BTAF1, TBP)、TFIID (BTAF1, BTF3, BTF3L4, EDF1, TAF1-15, 共 16 個)、TFIIE、TFIIF 和 TFIIH。此外,在組裝過程中的某個時刻,它會與 RNA 聚合酶 II 和全酶的其餘組分結合。
- TATA 結合蛋白 (TBP,TFIID 的亞基)、TBPL1 或 TBPL2 可以結合啟動子或 TATA 盒。大多數基因缺乏 TATA 盒,而是使用起始元件 (INR) 或下游核心啟動子。然而,TBP 始終參與其中,並且被迫在沒有序列特異性的情況下結合。當 TATA 盒不存在時,來自 TFIID 的 TAF 也可能參與其中。TFIID TAF 將序列特異性結合,並迫使 TBP 非序列特異性結合,將 TFIID 的其餘部分帶到啟動子。
- TFIIA 與 TFIID 的 TBP 亞基相互作用,並幫助 TBP 結合包含 TATA 盒的啟動子 DNA。雖然 TFIIA 本身不識別 DNA,但它與 TBP 的相互作用使它能夠穩定並促進 PIC 的形成。
- TFIIB 的 N 端結構域將 DNA 帶到適當的位置,以便進入 RNA 聚合酶 II 的活性位點。TFIIB 部分序列特異性結合,對 BRE 有一些偏好。隨後,TFIID-TFIIA-TFIIB (DAB)-啟動子複合物募集 RNA 聚合酶 II 和 TFIIF。
- TFIIF(兩個亞基,RAP30 和 RAP74,與細菌 σ 因子顯示出一些相似性)和 Pol II 一起進入複合物。TFIIF 有助於加速聚合過程。
- TFIIE 加入正在生長的複合物,並募集 TFIIH。TFIIE 可能參與啟動子處的 DNA 熔化:它包含一個鋅帶基序,可以結合單鏈 DNA。TFIIE 有助於開啟和關閉 Pol II 的“鉗口”狀結構,這使得它能夠沿著 DNA 鏈移動。
- DNA 可能會繞前起始複合物包裹一圈,而 TFIIF 有助於保持這種緊密包裹。在此過程中,DNA 上的扭轉應力可能有助於啟動子處的 DNA 熔化,形成轉錄氣泡。
- TFIIH 和 TFIIJ 一起進入複合物。TFIIH 是一種大型蛋白質複合物,其中包含 CDK7/cyclin H 激酶複合物和 DNA 解旋酶等。TFIIH 具有三種功能:它特異性地結合模板鏈以確保轉錄正確的 DNA 鏈,並透過其解旋酶活性熔化或解開 DNA(依賴於 ATP),以分離兩條鏈。它具有激酶活性,可以在氨基酸絲氨酸處磷酸化 Pol II 的 C 末端結構域 (CTD)。這將 RNA 聚合酶切換為開始產生 RNA。最後,它對於受損 DNA 的核苷酸切除修復 (NER) 至關重要。TFIIH 和 TFIIE 強烈相互作用。TFIIE 影響 TFIIH 的催化活性。如果沒有 TFIIE,TFIIH 不會解開啟動子。
- TFIIH 幫助形成轉錄泡,如果 DNA 模板沒有被變性或處於超螺旋狀態,則可能需要 TFIIH 進行轉錄。
- 然後,介質蛋白會包裹所有轉錄因子和 Pol II。它與增強子相互作用,增強子是位於很遠位置(上游或下游)的區域,有助於調節轉錄。
轉錄前起始複合物 (PIC) 的形成類似於細菌起始中觀察到的機制。在細菌中,σ 因子識別並結合到啟動子序列。在真核生物中,轉錄因子執行此功能。
TBP 是真核轉錄因子 TFIID 的一個亞基。TFIID 是在 RNA 聚合酶 II (RNA Pol II) 的轉錄前起始複合物形成過程中第一個與 DNA 結合的蛋白。TFIID 與基因啟動子區域的 TATA 盒結合,啟動了其他因子募集,這些因子需要 RNA Pol II 開始轉錄。一些被募集的轉錄因子包括 TFIIA、TFIIB 和 TFIIF。這些轉錄因子中的每一個都是由許多蛋白亞基相互作用形成的,表明轉錄是一個受到嚴格調控的過程。TBP 也是 RNA 聚合酶 I 和 RNA 聚合酶 III 所必需的組成部分,據認為,它是所有三種 RNA 聚合酶所必需的唯一共同亞基。[4]
TATA 結合蛋白 (TBP) 是一種轉錄因子,特異性地結合到稱為 TATA 盒的 DNA 序列。此 DNA 序列位於一些真核基因啟動子的轉錄起始位點上游約 35 個鹼基對處。TBP 以及各種與 TBP 相關的因子,構成了 TFIID,TFIID 是一種通用轉錄因子,它反過來構成了 RNA 聚合酶 II 轉錄前起始複合物的一部分。作為轉錄前起始複合物中少數幾個以序列特異性方式結合 DNA 的蛋白之一,它有助於將 RNA 聚合酶 II 定位到基因的轉錄起始位點。然而,據估計,只有 10-20% 的人類啟動子具有 TATA 盒。因此,TBP 可能不是定位 RNA 聚合酶 II 的唯一蛋白。
轉錄因子 II D (TFIID) 是組成 RNA 聚合酶 II 轉錄前起始複合物的幾種通用轉錄因子之一。在轉錄開始之前,由 TFIID、TBP 和至少九種其他多肽組成的轉錄因子 II D (TFIID) 複合物,會與基因核心啟動子中的 TATA 盒結合。TFIID 本身是由幾個稱為 TBP 相關因子 (TAF,有 16 種) 和 TATA 結合蛋白 (TBP) 的亞基組成。在試管中,只有 TBP 對包含 TATA 盒的啟動子進行轉錄是必需的。然而,TAF 會增加啟動子選擇性,尤其是在沒有 TATA 盒序列供 TBP 結合的情況下。TAF 包含在兩個不同的複合物中,即 TFIID 和 B-TFIID。TFIID 複合物由 TBP 和八種以上的 TAF 組成。但是,大部分 TBP 存在於 B-TFIID 複合物中,B-TFIID 複合物由 TBP 和 TAFII170 (BTAF1) 以 1:1 的比例組成。
RNAP 是由 Sam Weiss、Audrey Stevens 和 Jerard Hurwitz 在 1960 年獨立發現的。[5]
RNA 聚合酶 (RNAP) 是一種產生 RNA 的酶。在細胞中,RNAP 需要從 DNA 基因中構建 RNA 鏈作為模板,這個過程稱為轉錄。RNA 聚合酶是生命所必需的,存在於所有生物體和許多病毒中。從化學角度來看,RNAP 是一種核苷酸轉移酶,它在 RNA 轉錄本的 3' 端聚合核糖核苷酸。

真核生物有幾種型別的 RNAP,以它們合成的 RNA 型別為特徵:以下 RNA 聚合酶在真核細胞中非常常見。
1 RNA 聚合酶 I
2 RNA 聚合酶 II
3 RNA 聚合酶 III
4 RNA 聚合酶 IV
5 RNA 聚合酶 V
RNA 聚合酶 I 合成一個前rRNA 45S,它會成熟為 28S、18S 和 5.8S rRNA,這些 rRNA 將構成核糖體的主要 RNA 部分。[6]Pol I 由 8-14 個蛋白亞基 (多肽) 組成。所有 12 個亞基在 PolII 和 Pol III 中都有相同或相關的對應物。rDNA 轉錄僅限於核仁,核仁中存在數百個 rRNA 基因副本,這些副本排列成串聯的頭部到尾部重複序列。
Pol I 轉錄一個大的轉錄本,反覆編碼一個 rDNA 基因。該基因編碼真核生物核糖體的 18S、5.8S 和 28S RNA 分子。轉錄本由 snoRNA 裂解。5S 核糖體 RNA 由 Pol III 轉錄。由於 Pol I 轉錄的簡單性,它是作用最快的聚合酶。當 rRNA 合成受到刺激時,SL1 (選擇性因子 1) 將結合到先前沉默的 rDNA 基因的啟動子,並募集一個前起始複合物,Pol I 將結合到該複合物並開始 rRNA 轉錄。rRNA 轉錄的變化也可以透過轉錄速率的變化來實現。雖然 Pol I 透過哪種確切的機制提高其轉錄速率尚不清楚,但有證據表明,rRNA 合成可以在不改變活躍轉錄的 rDNA 數量的情況下增加或減少。

RNA 聚合酶 II 合成 mRNA 的前體,以及大多數 snRNA 和 microRNA。[7] 這是研究最多的型別,由於轉錄需要高度控制,因此需要一系列 轉錄因子 才能使其結合到啟動子。RNA 聚合酶 II 是一個 550 kDa 的複合體,包含 12 個亞基。真核生物|真核生物核心 RNA 聚合酶 II 首先使用轉錄測定法純化。[8] 純化的酶通常有 10-12 個亞基(人類和酵母中為 12 個),並且不能識別特定啟動子。[9] 許多亞基間的相互作用是已知的。[10] 計算機生成的 POLR2A 基因染色亞基影像:綠色 - RPB1 域 1,藍色 - RPB1 域 2,沙色 - RPB1 域 3,淺藍色 - RPB1 域 4,棕色 - RPB1 域 6,以及 洋紅色 - RPB1 CTD。DNA 導向的 RNA 聚合酶 II 亞基 RPB1 是一種酶,在人類中由 POLR2A 基因編碼。RPB1 是 RNA 聚合酶 II 的最大亞基。它包含一個 C 末端|羧基末端結構域 (CTD),由多達 52 個七肽重複序列 (YSPTSPS) 組成,這些重複序列對於聚合酶活性至關重要。[11] 與其他幾個聚合酶亞基結合,它形成了聚合酶的 DNA 結合域,一個 DNA 模板 轉錄 成 RNA 的凹槽。[12] 它與 RPB8 發生強烈的相互作用。[10] RPB2 (POLR2B) 是第二大亞基,它與至少另外兩個聚合酶亞基結合,在聚合酶內形成一個結構,該結構在酶的活性位點維持 DNA 模板和新合成的 RNA 之間的接觸。[13] 第三大的亞基 RPB3 (POLR2C) 以與 POLR2J 形成異二聚體的形式存在,形成一個核心亞組裝體。RPB3 與 RPB1-5、7、10-12 發生強烈的相互作用。[10] RNA 聚合酶 II 亞基 B4 (RPB4) 由 POLR2D 基因 編碼[14],是第四大的亞基,可能具有壓力保護作用。在人類中,RPB5 由 POLR2E 基因編碼。每個 RNA 聚合酶 II 中存在兩個該亞基的分子。[15] RPB5 與 RPB1、RPB3 和 RPB6 發生強烈的相互作用。[10] RPB6 (POLR2F) 與至少另外兩個亞基形成一個結構,該結構穩定了 DNA 模板上的轉錄聚合酶。[16]POLR2G 編碼 RPB7,它可能在調節聚合酶功能中發揮作用。[17] RPB7 與 RPB1 和 RPB5 發生強烈的相互作用。[10]RPB8 (POLR2H) 與亞基 RPB1-3、5 和 7 相互作用。[10] DNA 模板被轉錄成 RNA 的凹槽由 RPB9 (POLR2I) 和 RPB1 組成。RPB10 是基因 POLR2L 的產物。它與 RPB1-3 和 5 相互作用,並且與 RPB3 發生強烈的相互作用。[10] RPB11 亞基本身由人類中的三個亞基組成:POLR2J (RPB11-a)、POLR2J2 (RPB11-b) 和 POLR2J3[18] (RPB11-c)。與 RPB3 相互作用的還有 RPB12 (POLR2K)。[10]
RNA Pol II 的 C 末端結構域 (CTD)
[edit | edit source]
RNAPII 可以存在於兩種形式:RNAPII0,具有高度磷酸化的 CTD,以及 RNAPIIA,具有非磷酸化的 CTD。RNA 聚合酶 II 的羧基末端結構域 (CTD) 是聚合酶中參與轉錄起始、加帽 RNA 轉錄本 以及與 剪接體 相連以進行 RNA 剪接 的部分。[19] CTD 通常由多達 52 個重複序列 Tyr-Ser-Pro-Thr-Ser-Pro-Ser 組成。[20] 羧基末端重複結構域 (CTD) 對於生命至關重要。僅包含沒有重複序列或最多三分之一重複序列的 RNAPII 的細胞是不可存活的。[21]
CTD 是附加到 RNA 聚合酶 II 最大亞基 RPB1 的 C 末端的一個延伸。它作為許多核因子的靈活結合 支架,由 CTD 重複序列上的 磷酸化 模式決定。每個重複序列都包含一個進化上保守且重複的七肽,Tyr1-Ser2-Pro3-Thr4-Ser5-Pro6-Ser7,它在每個轉錄週期中都經過可逆的磷酸化。[22] 該結構域本質上是非結構化的,但進化上是保守的,並且在 真核生物 中,它包含 25 到 52 個串聯的共識重複七肽。[21] 由於 CTD 通常不需要 通用轉錄因子 (GTF) 介導的起始和 RNA 合成,因此它不構成 RNAPII 的催化本質的一部分,而是執行其他功能。[22][23]
磷酸化主要發生在 CTD 重複序列的 Ser2 和 Ser5 上,儘管這些位置並不等效。磷酸化狀態隨著 RNAPII 在轉錄週期中前進而發生變化:起始 RNAPII 為 IIA 形式,延伸酶為 II0 形式。雖然 RNAPII0 確實包含具有超磷酸化的 CTD 的 RNAP,但由於 Ser2 與 Ser5 殘基的差異磷酸化和/或 CTD 沿長度的重複序列的差異磷酸化,單個 CTD 上的磷酸化模式可能會有所不同。PCTD(RNAPII0 的磷酸化 CTD)透過將加工因子與延伸的 RNAPII 相連,將前 mRNA 加工與轉錄物理連線起來,例如,5'-端加帽、3'-端切割和多腺苷酸化。靠近基因 5' 端的 Ser5 磷酸化 (Ser5PO4) 主要取決於 TFIIH 的激酶活性(酵母中的 Kin28;後生動物中的 CDK7)。轉錄因子 TFIIH 是一種激酶,它會過度磷酸化 RNAP 的 CTD,從而導致 RNAP 複合體從起始位點移開。在 TFIIH 激酶作用之後,Ser2 殘基由酵母中的 CTDK-I(後生動物中的 CDK9 激酶)磷酸化。Ctk1 (CDK9) 補充絲氨酸 5 的磷酸化,因此在中後期延伸中觀察到。CDK8 和環蛋白 C (CCNC) 是 RNA 聚合酶 II 全酶的組成部分,它們磷酸化羧基末端結構域 (CTD)。CDK8 透過靶向通用轉錄起始因子 IIH (TFIIH) 的 CDK7/環蛋白 H 亞基來調節轉錄,從而在介體和基本轉錄機制之間建立聯絡。CTDP1 基因編碼一種磷酸酶,它與轉錄起始因子 TFIIF 的羧基末端發生相互作用,TFIIF 是一種調節 RNA 聚合酶 II 延伸和起始的轉錄因子[24]。
RNA 聚合酶 III
[edit | edit source]RNA 聚合酶 III 合成 tRNA、rRNA 5S 以及其他存在於 細胞核 和 胞質溶膠 中的小 RNA。[25] RNA 聚合酶 III(也稱為 Pol III)轉錄 DNA 以合成核糖體 5S rRNA、tRNA 和其他小 RNA。由 RNA Pol III 轉錄的基因屬於“管家”基因類別,這些基因的表達在所有細胞型別和大多數環境條件下都是必需的。因此,Pol III 轉錄的調控主要與細胞生長和細胞週期的調控相關,因此需要的調控蛋白比 RNA 聚合酶 II 少。在轉錄過程中(由任何聚合酶進行),有三個主要階段:起始;需要在基因的啟動子上構建 RNA 聚合酶複合體。延伸;寫出 RNA 轉錄本。終止;完成 RNA 寫入並拆卸 RNA 聚合酶複合體。
RNA 聚合酶 IV 在植物中合成 siRNA。[26] 聚合酶 IV 專門針對植物基因組,是合成超過 90% 的所有 siRNA 所必需的。RNA 聚合酶在 siRNA 途徑中沉默轉座子和重複 DNA。siRNA 在透過 RNA 指導的 DNA 甲基化防禦基因組免受入侵病毒和轉座因子的攻擊中起著重要作用。聚合酶 IV 和 ROS1 脫甲基酶解鎖並重新濃縮 5S rDNA 染色質,它存在於種子中,並用於植物中成年特徵的發育。聚合酶 IV 參與在植物成熟過程中設定 5S 基因中的甲基化模式。在擬南芥中,聚合酶 IV 與結合蛋白 DCL3 和 RNA 聚合酶 II RDR2 在一個沉默途徑中協同工作,其中聚合酶 IV 會產生 RNA,該 RNA 被 RDR2 改變為 dsRNA,然後被 DCL3 轉換為 siRNA。
在 線粒體 和 葉綠體 中還有其他型別的 RNA 聚合酶。還有參與 RNA 干擾 的 RNA 依賴性 RNA 聚合酶。[28]

真核生物的轉錄起始更加複雜。真核生物的 RNA 聚合酶不會直接識別核心啟動子序列。相反,一組稱為轉錄因子的蛋白質介導 RNA 聚合酶的結合和轉錄的起始。只有在某些轉錄因子附著到啟動子後,RNA 聚合酶才會與之結合。轉錄因子和 RNA 聚合酶的完整組裝體與啟動子結合,形成轉錄起始複合體。古細菌域中的轉錄類似於真核生物中的轉錄。[29]
在細菌中,轉錄始於 RNA 聚合酶與 DNA 中啟動子的結合。RNA 聚合酶是一個核心酶,由五個亞基組成:2 個 α 亞基、1 個 β 亞基、1 個 β' 亞基和 1 個 ω 亞基。在起始開始時,核心酶與一個σ因子相關聯,該σ因子有助於找到啟動子序列下游合適的 -35 和 -10 個鹼基對。
什麼是 σ因子?
σ因子(σ因子)是一種原核生物轉錄起始因子,它使 RNA 聚合酶能夠特異性地與基因啟動子結合。不同的σ因子在響應不同的環境條件時被啟用。每個 RNA 聚合酶分子都包含一個σ因子亞基,在模式細菌大腸桿菌中,它是下面列出的那些之一。大腸桿菌有七個σ因子;σ因子的數量在細菌物種之間有所不同。σ因子以其特徵分子量區分。例如,σ70 指的是分子量為 70 kDa 的σ因子。
轉錄因子對於基因表達的調節至關重要,因此存在於所有生物體中。生物體中發現的轉錄因子的數量隨著基因組大小的增加而增加,更大的基因組往往每個基因擁有更多的轉錄因子。人類基因組中大約有 2600 種蛋白質含有 DNA 結合域,其中大多數被認為充當轉錄因子。因此,基因組中大約 10% 的基因編碼轉錄因子,這使得該家族成為人類蛋白質中最大的單一家族。此外,基因經常被多個用於不同轉錄因子的結合位點包圍,並且這些基因中每一個的有效表達都需要幾個不同轉錄因子的協同作用(例如,參見肝細胞核因子)。因此,大約 2000 種人類轉錄因子子集的組合使用可以輕鬆解釋人類基因組中每個基因在發育過程中的獨特調節。
在分子生物學中,轉錄因子(有時稱為序列特異性 DNA 結合因子)是一種與特定 DNA 序列結合的蛋白質,從而控制遺傳資訊從 DNA 到 mRNA 的移動(或轉錄)。轉錄因子透過促進(作為啟用劑)或阻止(作為抑制劑) RNA 聚合酶(執行從 DNA 到 RNA 的遺傳資訊轉錄的酶)到特定基因的募集,單獨或與其他蛋白質在複合體中執行此功能。
通用轉錄因子或 GTF 緊密參與基因調控過程,大多數是生命所必需的。TATA 結合蛋白 (TBP) 是一種 GTF,它與 TATAA 盒(T=胸腺嘧啶,A=腺嘌呤)結合,該盒是所有基因編碼區域直接上游的核酸基序。TBP 負責招募 RNA Pol II 全酶,這是轉錄起始的最後一步。這些蛋白質是普遍存在的,並與 DNA 的核心啟動子區域相互作用,該區域包含所有 II 類基因的轉錄起始位點。並非所有 GTF 都在轉錄起始中發揮作用;有些是轉錄的第二步(延伸)所必需的。例如,FACT 複合體 (Spt16/Pob3 in S. cerevisiae, SUPT16H/SSRP1 in humans) 的成員促進 RNA Pol II 在基因編碼區域的快速移動。這是透過將組蛋白八聚體移出活躍聚合酶的路徑並因此解壓縮染色質來實現的。
轉錄因子在結構上是模組化的,包含以下 域
DNA 結合域 (DBD),它附著到 DNA 增強子或啟動子的特定序列:所有載體的必要組成部分:用於驅動載體轉基因的轉錄 啟動子 序列)與受調控基因相鄰。與轉錄因子結合的 DNA 序列通常被稱為 反應元件。
反式啟用域 (TAD),它包含其他蛋白質的結合位點,例如 [轉錄共調節因子。這些結合位點通常被稱為 啟用功能 (AFs)。[30]
一個可選的 訊號感知域 (SSD)(例如,配體結合域),它感知外部訊號,並響應這些訊號,將這些訊號傳遞到轉錄複合體的其餘部分,導致基因表達的向上或向下調節。此外,DBD 和訊號感知域可能存在於轉錄複合體中關聯的單獨蛋白質上以調節基因表達。

第一個鍵合成之後,RNA聚合酶必須從啟動子區域脫落。在此期間,RNA轉錄本容易釋放併產生截短的轉錄本。這種現象稱為中止起始,在真核生物和原核生物中都很常見。中止起始持續發生,直到σ因子重新排列,形成轉錄延伸複合物(形成一個移動的35個鹼基對的足跡)。在合成80個核苷酸的mRNA之前,σ因子就會釋放。一旦轉錄本達到大約23個核苷酸,它就不會再滑動,延伸過程就可以開始了。這與大多數轉錄過程一樣,是一個依賴能量的過程,消耗三磷酸腺苷(ATP)。DNA的其中一條鏈,模板鏈(或非編碼鏈),被用作RNA合成的模板。隨著轉錄的進行,RNA聚合酶沿著模板鏈移動,並利用與DNA模板的鹼基配對互補性來建立RNA複製。雖然RNA聚合酶以3'→5'方向沿著模板鏈移動,但編碼鏈(非模板鏈)和新形成的RNA也可以用作參考點,因此轉錄可以被描述為發生在5'→3'方向。這會產生一個從5'→3'方向的RNA分子,它是編碼鏈的精確複製品(除了胸腺嘧啶被尿嘧啶取代,並且核苷酸由一個核糖(5碳)糖組成,而DNA在其糖磷酸骨架中含有脫氧核糖(少了一個氧原子))。與DNA複製不同,mRNA轉錄可以涉及單個DNA模板上的多個RNA聚合酶以及多次轉錄迴圈(特定mRNA的擴增),因此可以從單個基因複製快速產生許多mRNA分子。延伸過程還涉及一個校對機制,可以替換錯誤摻入的鹼基。在真核生物中,這可能對應於轉錄過程中短暫的暫停,使合適的RNA編輯因子能夠結合。這些暫停可能是RNA聚合酶本身固有的,也可能是染色質結構造成的。[31]
轉錄終止
[edit | edit source]
細菌使用兩種不同的策略來終止轉錄。在ρ非依賴性轉錄終止中,當新合成的RNA分子形成一個富含G-C的莖環結構,後面跟著一段U的序列時,RNA轉錄就會停止。當莖環結構形成時,機械應力會破壞弱的rU-dA鍵,現在填充了DNA-RNA雜合體。這會將多聚U轉錄本從RNA聚合酶的活性位點中拉出來,從而有效地終止轉錄。在“ρ依賴性”型別的終止中,一個叫做“ρ”的蛋白質因子會破壞模板和mRNA之間的相互作用,從而將新合成的mRNA從延伸複合物中釋放出來。真核生物中的轉錄終止機制尚未完全瞭解,但涉及到新轉錄本的切割,隨後在其新的3'端新增模板無關的A,這是一個叫做polyadenylation的過程。
ρ依賴性終止
[edit | edit source]ρ因子作用於RNA底物。ρ的關鍵功能是其解旋酶活性,其能量由RNA依賴性的ATP水解提供。ρ的初始結合位點是在正在合成的RNA中,位於實際終止序列上游的一個延伸的(約70個核苷酸,有時為80-100個核苷酸)單鏈區域,該區域富含胞嘧啶,缺乏鳥嘌呤,被稱為rho利用位點或rut。已經發現了多個ρ結合序列。這些序列之間沒有發現一致性,但不同的序列似乎都是特異性的,因為序列中的微小突變會破壞其功能。ρ結合到RNA上,然後利用其ATP酶活性提供能量沿著RNA移動,直到到達RNA-DNA螺旋區域,在那裡它會解開雜合雙鏈結構。RNA聚合酶在終止序列處暫停,這是由於在距離ρ結合位點約100nt處有一個特定位點,被稱為ρ敏感暫停位點。因此,即使RNA聚合酶的速度比ρ快約40nt/秒,但這不會對ρ終止機制造成問題,因為RNA聚合酶允許ρ因子趕上。
ρ非依賴性終止
[edit | edit source]ρ非依賴性終止(也稱為內在終止)是真核生物和原核生物中的一種機制,導致mRNA轉錄停止。在這種機制中,mRNA包含一個可以與自身鹼基配對形成一個長度為7-20個鹼基對的莖環結構的序列,該結構也富含胞嘧啶-鳥嘌呤鹼基對。這些鹼基彼此之間形成三個氫鍵,因此特別牢固。在莖環結構之後是一段尿嘧啶殘基鏈。尿嘧啶和腺嘌呤之間的鍵非常弱。一個與RNA聚合酶結合的蛋白質(nusA)會牢固地結合到莖環結構上,導致聚合酶暫時停滯。這種聚合酶的暫停與多聚尿嘧啶序列的轉錄相一致。弱的腺嘌呤-尿嘧啶鍵使RNA-DNA雙鏈體不穩定,導致其解開並從RNA聚合酶上解離。不以多聚尿嘧啶序列結尾的莖環結構會使RNA聚合酶暫停,但它通常會在短暫的時間後繼續轉錄,因為雙鏈體太穩定,無法解開到足以導致終止的程度。ρ非依賴性轉錄終止是構成順式作用RNA調節元件(如核糖開關)[32]活性的一種常見機制。
mRNA及其修飾
[edit | edit source]pre-mRNA分子經歷三種主要的修飾。這些修飾是在RNA被翻譯之前發生在細胞核中的5'端加帽、3'端polyadenylation和RNA剪接。
mRNA的加帽
[edit | edit source]
5'端帽看起來像RNA分子的3'端(帽子的核糖的5'碳原子是連線的,而3'端是未連線的)。這提供了對5'端外切核酸酶的顯著抵抗力。pre-mRNA的加帽涉及在5'端新增7-甲基鳥苷(m7G)。為了實現這一點,需要去除末端的5'磷酸,這在磷酸酶的幫助下完成。然後,鳥苷轉移酶催化反應,產生二磷酸5'端。二磷酸5'端然後攻擊GTP分子中的α磷原子,以便在5'5'三磷酸鍵中新增鳥嘌呤殘基。酶(鳥嘌呤-N7-)甲基轉移酶(“帽MTase”)從S-腺苷甲硫氨酸轉移一個甲基到鳥嘌呤環上。這種型別的帽子,只有(m7G)在位置上,被稱為帽0結構。相鄰核苷酸的核糖也可以被甲基化,得到帽1。RNA分子下游核苷酸的甲基化產生帽2、帽3結構等等。在這些情況下,甲基被新增到核糖糖的2'OH基團上。帽子保護了初級RNA轉錄本的5'端免受對3'5'磷酸二酯鍵有特異性的核糖核酸酶的攻擊。[33]
起點是未改變的RNA分子的5'端。它具有一個末端核苷酸,後面跟著連線到5'碳原子的三個磷酸基團。
一個末端磷酸基團被去除(透過RNA末端磷酸酶),留下兩個末端磷酸基團。
GTP被新增到末端磷酸基團上(透過鳥苷轉移酶),在此過程中失去了兩個磷酸基團(來自GTP)。這導致了5'到5'三磷酸鍵的形成。
鳥嘌呤的7-氮被甲基化(透過甲基轉移酶)。
其他甲基轉移酶可選擇性地用於進行5'端鄰近核苷酸的甲基化。
5'端帽具有4個主要功能
調節核輸出。
防止外切核酸酶降解。
促進翻譯(參見核糖體和翻譯)。
促進5'端鄰近內含子的切除。
RNA 的核輸出受帽結合複合物 (CBC) 的調節,CBC 專門結合帽化的 RNA。然後,CBC 被核孔複合物識別並輸出。在翻譯的先鋒輪次後到達細胞質後,CBC 被翻譯因子 eIF-4E 和 eIF-4G 取代。然後,該複合物被其他翻譯起始機制(包括核糖體)識別。帽以兩種方式防止 5' 降解。首先,透過在功能上看起來像 3' 末端來防止 5' 外切核酸酶對 mRNA 的降解(如上所述)。其次,CBC 複合物和 eIF-4E/eIF-4G 阻止了脫帽酶對帽的訪問。這增加了 mRNA 的半衰期,這在真核生物中至關重要,因為輸出過程需要大量時間。mRNA 的脫帽由至少由 Dcp1 和 Dcp2 組成的脫帽複合物催化,該複合物必須與 eIF-4E 競爭才能結合帽。因此,5' 帽是活躍翻譯 mRNA 的標誌,細胞利用它來調節 mRNA 半衰期,以響應新的刺激。不需要的 mRNA 被髮送到 P 體中進行暫時儲存或脫帽,其細節仍在解決中。5' 鄰近內含子切除促進的機制尚不清楚,但 5' 帽似乎環繞並與剪接體在剪接過程中相互作用,從而促進內含子切除。
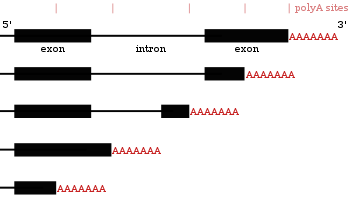
RNA 分子 3' 末端的 pre-mRNA 加工涉及其 3' 末端的裂解,然後新增約 200 個腺嘌呤殘基以形成一個 poly(A) 尾巴。如果在 pre-mRNA 分子的 3' 末端附近存在一個 聚腺苷酸化訊號序列 (5'- AAUAAA-3'),則發生裂解和腺苷酸化反應,該序列緊隨另一個序列,通常為 (5'-CA-3')。第二個訊號是裂解位點。一個 富含 GU 的序列 通常也存在於 pre-mRNA 分子的下游。在合成序列元件後,兩種稱為 蛋白質 的多亞基 裂解和聚腺苷酸化特異性因子 (CPSF) 和 裂解刺激因子 (CStF) 從 RNA 聚合酶 II 轉移到 RNA 分子。這兩個因子結合到序列元件。形成一個包含其他裂解因子和酶 聚腺苷酸聚合酶 (PAP) 的蛋白質複合物。該複合物在聚腺苷酸化序列和由 (5'-CA-3') 序列標記的裂解位點處的富含 GU 的序列之間裂解 RNA。然後,poly(A) 聚合酶使用 ATP 作為前體,向 RNA 分子的新 3' 末端新增約 200 個腺嘌呤單元。隨著 poly(A) 尾巴的合成,它結合了 poly(A) 結合蛋白的多個複製,這保護了 3' 末端免受核糖核酸酶的消化。[34]
聚(A) 結合蛋白或“PABP”
聚(A) 結合蛋白(或“PABP”)是一種 RNA 結合蛋白,它結合到 mRNA 的 poly(A) 尾巴。poly(A) 尾巴位於 mRNA 的 3' 末端。核同種型選擇性地結合到大約 50 個核苷酸並刺激聚腺苷酸聚合酶的活性。哺乳動物聚(A) 結合蛋白的表達在翻譯水平上受反饋機制調節:編碼 PABP 的 mRNA 在其 5' UTR 中含有與聚(A) 結合蛋白結合的富含 A 的序列。這導致翻譯的抑制。真核生物聚(A) 結合蛋白的胞質同種型透過其 C 末端結構域與起始因子 eIF-4G 結合。EIF-4G 與 eIF-4E 結合,另一個起始因子結合到 mRNA 5' 末端的 5' 帽。這種結合形成了真核蛋白合成的特徵性環狀結構。胞質溶膠中的聚(A) 結合蛋白相互作用蛋白競爭 eIF-4G 結合位點。聚(A) 結合蛋白還被證明與終止因子 (eRF3) 相互作用。
可變聚腺苷酸化
許多蛋白質編碼基因具有不止一個聚腺苷酸化位點,因此一個基因可以編碼幾種在 3' 末端不同的 mRNA。由於可變聚腺苷酸化改變了 3' 非翻譯區的長度,因此它可以改變 3' 非翻譯區包含哪些 microRNA 結合位點。microRNA 往往抑制翻譯並促進與其結合的 mRNA 的降解,儘管有一些例子表明 microRNA 會穩定轉錄本。可變聚腺苷酸化還可以縮短編碼區,從而使 mRNA 編碼不同的蛋白質,但這遠不如僅僅縮短 3' 非翻譯區常見。聚(A) 位點的選擇取決於參與聚腺苷酸化的蛋白質的表達。例如,裂解刺激因子 (CStF) 的一個亞基 CstF-64 的表達在巨噬細胞中響應脂多糖(觸發免疫反應的一組細菌化合物)而增加。這導致選擇弱聚(A) 位點,從而產生更短的轉錄本。這去除了防禦相關產物(如溶菌酶和 TNF-α)的 mRNA 3' 非翻譯區中的調節元件。然後,這些 mRNA 具有更長的半衰期併產生更多這些蛋白質。除了聚腺苷酸化機制中的那些之外,其他 RNA 結合蛋白也可以影響聚腺苷酸化位點的使用,就像靠近聚腺苷酸化訊號的 DNA 甲基化一樣。[35]。

剪接是將 pre-mRNA 修飾以去除稱為內含子的某些非編碼序列片段的過程;保留的片段包括蛋白質編碼序列,稱為外顯子。有時 pre-mRNA 資訊可以以幾種不同的方式剪接,允許單個基因編碼多種蛋白質。這個過程稱為可變剪接。剪接通常由稱為剪接體的 RNA-蛋白質複合物執行,但一些 RNA 分子也能夠催化它們自身的剪接。[36]

內含子 對觀察到的內含子分佈的一個合理的假設是,現代真核生物的古代祖先含有大量的內含子,並且控制快速生長的物種中基因組大小的選擇壓力可能導致許多古代內含子的消除。使這個問題複雜化的是,發現許多內含子本身是可移動的遺傳元件,可以插入基因並從基因中刪除。在發現內含子後不久,研究人員提出了相互競爭的理論,這些理論提供了對剪接體內含子的起源和早期進化的替代方案。其他型別的內含子,如自剪接內含子和 tRNA 內含子,沒有受到太多爭議,但請參閱前者。這些通常被稱為“內含子先於” (IE) 和“內含子後於” (IL) 觀點。由沃爾特·吉爾伯特倡導的 IE 模型假設內含子非常古老,並且在原核生物和真核生物的最早理論祖先(原生物)中大量存在。在這個模型中,內含子隨後從原核生物中丟失,使它們能夠獲得生長效率。該理論的一個核心預測是,早期的內含子是促進代表蛋白質結構域的外顯子重組的媒介。該模型無法解釋在相關基因之間觀察到的某些內含子位置變異。
IL 模型假設內含子是在真核生物和原核生物分化後,最近插入到最初不含內含子的連續基因中。在這個模型中,內含子可能起源於轉座因子。該模型基於觀察到的剪接體內含子僅限於真核生物。然而,關於原核生物-真核生物祖先中內含子的存在以及隨後的真核生物進化過程中內含子的丟失-獲得存在相當大的爭議。內含子及其內含子-外顯子結構的進化可能在很大程度上獨立於編碼序列的進化。
內含子最初是在腺病毒的蛋白質編碼基因中發現的,但現在已知它們存在於所有生物界中各種各樣的基因中。不同基因組中內含子的頻率在生物有機體的整個範圍內差異很大。例如,內含子在高等脊椎動物(例如人類和小鼠)的核基因組中極為常見,其中蛋白質編碼基因幾乎總是包含多個內含子,而內含子在一些真核微生物(例如麵包酵母(釀酒酵母))的核基因中很少見。相反,脊椎動物的線粒體基因組完全沒有內含子,而真核微生物的線粒體基因組可能包含許多內含子。

每個剪接體由五個稱為snRNP的小核RNA蛋白(發音為“snurps”)和一系列非snRNP相關蛋白因子組成。構成核剪接體的snRNP分別命名為U1、U2、U4、U5和U6,並參與多個RNA-RNA和RNA-蛋白相互作用。snRNP的RNA成分富含尿嘧啶(尿嘧啶核苷酸的核苷類似物)。剪接體的典型組裝在每個hnRNA上重新進行。hnRNA包含特定的序列元件,這些元件在剪接體組裝過程中被識別和利用。這些元件包括5'端剪接位點、分支點序列、多嘧啶區和3'端剪接位點。剪接體催化內含子的去除以及側翼外顯子的連線。內含子通常在其5'端剪接位點具有GU核苷酸序列,在其3'端剪接位點具有AG。3'剪接位點可以透過稱為多嘧啶區(PPT)的可變長度多嘧啶進一步定義,多嘧啶區具有招募因子到3'剪接位點和可能招募因子到分支點序列(BPS)的雙重功能。BPS包含第一個剪接步驟所需的保守腺苷。一組含量較少的snRNP,U11、U12、U4atac和U6atac,連同U5,是所謂的次級剪接體的亞基,該剪接體剪接一類罕見的pre-mRNA內含子,稱為U12型。這些snRNP形成U12剪接體,位於細胞質中。從II類內含子的第一個晶體結構中獲得的新證據表明,剪接體實際上是一種核酶,它使用雙金屬離子機制進行催化。
剪接體活性位點形成模型涉及在hnRNA底物上以有序的、逐步的方式組裝離散的snRNP顆粒。hnRNA的首次識別涉及U1 snRNP與hnRNA的5'端剪接位點以及其他非snRNP相關因子結合,形成承諾複合物或哺乳動物中的早期(E)複合物。[38][39] 承諾複合物是與hnRNA結合在剪接途徑中的ATP無關的複合物。[40] U2 snRNP透過與E複合物成分U2AF(U2 snRNP輔助因子)以及可能與U1 snRNP相互作用而被招募到分支區域。在一個ATP依賴性反應中,U2 snRNP與分支點序列(BPS)緊密結合,形成複合物A。在U2 snRNP和hnRNA分支區域之間形成的雙鏈結構將分支腺苷突出,將其指定為第一個轉酯化的親核試劑。[41]
U2 snRNA中存在假尿嘧啶殘基,幾乎與分支位點相對,導致U2 snRNP結合後RNA-RNA雙鏈結構的構象發生改變。具體來說,由假尿嘧啶誘導的雙鏈結構的改變將突出腺苷的2'OH置於有利位置,以便進行第一步剪接。[42] U4/U5/U6三聚體snRNP被招募到組裝的剪接體中,形成複合物B,並在經過幾輪重排後,複合物C(剪接體)被啟用以進行催化。[43][44] 尚不清楚三聚體snRNP是如何被招募到複合物A中的,但這個過程可能是透過蛋白-蛋白相互作用和/或U2 snRNA與U6 snRNA之間的鹼基配對相互作用來介導的。
U5 snRNP透過U5 snRNA的不變環[45]與5'和3'剪接位點的序列相互作用,而U5蛋白成分與3'剪接位點區域相互作用。[46]
在招募三聚體snRNP後,在第一步催化步驟之前發生了幾輪RNA-RNA重排,並且在催化活性剪接體中發生了進一步的重排。許多RNA-RNA相互作用是相互排斥的;然而,尚不清楚是什麼觸發了這些相互作用,以及這些重排的順序。第一次重排可能是U1 snRNP從5'剪接位點上移位以及形成U6 snRNA相互作用。眾所周知,U1 snRNP只與完全形成的剪接體[47]弱結合,並且U1 snRNP對在包含短5'外顯子和5'剪接位點的模型底物寡核苷酸上形成U6-5'剪接位點相互作用具有抑制作用。[48] U2 snRNP與分支點序列(BPS)的結合是RNA-RNA相互作用置換蛋白-RNA相互作用的一個例子。在招募U2 snRNP後,承諾複合物中的分支結合蛋白SF1被置換,因為U2 snRNA和SF1的結合位點是相互排斥的事件。
在U2 snRNA中,存在其他相互排斥的重排,發生在競爭性構象之間。例如,在活性形式中,莖環IIa是被偏愛的;在非活性形式中,環與下游序列之間的相互排斥相互作用占主導地位。[44] 尚不清楚U4是如何從U6 snRNAm上移位的,儘管RNA參與了剪接體的組裝,並且可能發揮瞭解開U4/U6並促進形成U2/U6 snRNA相互作用的作用。U4/U6莖環I和II的相互作用分離,U6的釋放的莖環II區域自身摺疊形成一個分子內莖環,U4不再需要參與進一步的剪接體組裝。釋放的U6莖環I區域與U2 snRNA配對,形成U2/U6螺旋I。然而,螺旋I結構與U2 snRNA的內部5'莖環區域的3'半部分是相互排斥的。
snRNP的RNA成分與內含子相互作用,並可能參與催化。已經鑑定出兩種型別的剪接體(主要剪接體和次級剪接體),它們包含不同的snRNP。主要剪接體剪接包含5'剪接位點處的GU和3'剪接位點處的AG的內含子。它由U1、U2、U4、U5和U6 snRNP組成,並在細胞核中活躍。此外,還需要一些蛋白質,包括U2AF和SF1,以組裝剪接體。
E複合物-U1與5'剪接位點的GU序列結合,以及輔助蛋白/酶ASF/SF2、U2AF(在Py-AG位點結合)、SF1/BBP(BBP=分支結合蛋白);
A複合物-U2與分支位點結合,並水解ATP;
B1複合物-U5/U4/U6三聚體結合,U5在5'位點與外顯子結合,U6與U2結合;
B2複合物-U1被釋放,U5從外顯子轉移到內含子,U6在5'剪接位點結合;
C1複合物-U4被釋放,U6/U2催化轉酯化,使內含子的5'端與內含子上的A連線並形成套索結構,U5與3'剪接位點處的外顯子結合,5'位點被切割,導致套索結構的形成;
C2複合物-U2/U5/U6與套索結構保持結合,3'位點被切割,外顯子使用ATP水解連線起來。剪接的RNA被釋放,套索結構被解開。
這種型別的剪接被稱為規範剪接或套索途徑,它佔剪接的99%以上。相反,當內含子側翼序列不遵循GU-AG規則時,就會發生非規範剪接(見下文“次級剪接體”)。**次級剪接體**
次級剪接體是一種核糖核蛋白複合物,它催化從植物、昆蟲、脊椎動物和一些真菌(米根黴)的真核信使RNA中去除(剪接)一類非典型剪接體內含子(U12型)。這個過程被稱為非規範剪接,與U2依賴的規範剪接相反。U12型內含子在人類細胞中佔所有內含子的不到1%。然而,它們存在於執行基本細胞功能的基因中。次級剪接體與主要剪接體非常相似,然而,它剪接出具有不同剪接位點序列的罕見內含子。雖然次級剪接體和主要剪接體包含相同的U5 snRNP,但次級剪接體具有不同的但功能類似的snRNP,分別用於U1、U2、U4和U6,它們分別被稱為U11、U12、U4atac和U6atac。與主要剪接體一樣,它只存在於細胞核中[49]。跨剪接跨剪接是一種剪接形式,它連線兩個不在同一RNA轉錄本中的外顯子
自我剪接
[edit | edit source]自我剪接發生在形成核酶的罕見內含子中,透過RNA獨自執行剪接體的功能。存在三種類型的自我剪接內含子,I類、II類和III類。I類和II類內含子執行類似於剪接體的剪接,不需要任何蛋白質。這種相似性表明I類和II類內含子可能與剪接體存在進化關係。自我剪接也可能非常古老,並且可能存在於蛋白質出現之前的RNA世界中。兩個轉酯化反應的特點是I類內含子剪接的機制:遊離鳥苷核苷(或位於內含子中)或核苷酸輔因子(GMP、GDP、GTP)的3'OH攻擊5'剪接位點處的磷酸鹽。5'外顯子的3'OH成為親核試劑,第二個轉酯化反應導致兩個外顯子的連線。II類內含子剪接的機制(與I類內含子類似的兩個轉酯化反應)如下:內含子中特定腺苷的2'OH攻擊5'剪接位點,從而形成套索結構。5'外顯子的3'OH觸發了3'剪接位點的第二個轉酯化反應,從而將外顯子連線在一起。
第一類內含子 第一類內含子分佈於細菌、低等真核生物和高等植物中。然而,它們在細菌中的出現似乎比在低等真核生物中更零散,並且在高等植物中變得普遍。第一類內含子中斷的基因存在顯著差異:它們中斷細菌基因組中的 rRNA、mRNA 和 tRNA 基因,以及低等真核生物的線粒體和葉綠體基因組,但在低等真核生物的核基因組中只入侵 rRNA 基因。在高等植物中,這些內含子似乎僅限於葉綠體和線粒體的少數 tRNA 和 mRNA 基因。內含子早期理論和內含子晚期理論都在解釋第一類內含子的起源方面找到了證據。一些第一類內含子編碼同源內切酶 (HEG),它催化內含子的移動。有人提出,HEG 將內含子從一個位置移動到另一個位置,從一個生物體移動到另一個生物體,從而解釋了自私的第一類內含子的廣泛傳播。到目前為止,除了從前體中剪接自身以防止宿主死亡外,尚未確定第一類內含子的任何生物學作用。少數第一類內含子也被發現編碼一類稱為成熟酶的蛋白質,這些蛋白質促進內含子剪接。
第一類內含子的剪接透過兩個連續的酯轉移反應進行。外源鳥苷或鳥苷核苷酸 (exoG) 首先停靠在位於 P7 的活性 G 結合位點,其 3'-OH 與位於 P1 的 5' 剪接位點的磷酸二酯鍵對齊,導致上游外顯子產生一個遊離的 3'-OH 基團,並且 exoG 連線到內含子的 5' 端。然後,內含子的末端 G (omega G) 交換 exoG 並佔據 G 結合位點,以組織第二酯轉移反應,P1 中上游外顯子的 3'-OH 基團與 P10 中的 3' 剪接位點對齊,導致相鄰的上游和下游外顯子的連線和催化內含子的釋放。人們提出蛋白質聚合酶和磷酸酶中看到的雙金屬離子機制被第一類和第二類內含子用來處理磷醯基轉移反應,這在最近解析的 Azoarcus 第一類內含子高解析度結構中得到了明確證明。
第二類催化內含子
第二類催化內含子存在於真菌、植物和原生生物的細胞器的 rRNA、tRNA 和 mRNA 中,也存在於細菌的 mRNA 中。它們是大型自剪接核酶,具有 6 個結構域(通常標記為 dI 到 dVI)。此模型和比對僅代表 V 和 VI 結構域。第二類內含子的一個子集還在內含子 ORF 中編碼必需的剪接蛋白。因此,這些內含子的長度可以長達 3kb。剪接以與核前 mRNA 剪接幾乎相同的方式進行,包含兩個轉酯化步驟。VI 結構域中凸起腺苷的 2' 羥基攻擊 5' 剪接位點,然後上游外顯子的 3' OH 對 3' 剪接位點進行親核攻擊。蛋白質機器需要體內剪接,長距離內含子-內含子和內含子-外顯子相互作用對於剪接位點定位很重要。第二類內含子進一步細分為 IIA 和 IIB 組,它們在剪接位點共有序列和 VI 結構域中凸起腺苷(形成套索的潛在分支點)與 3' 剪接位點的距離方面存在差異。
第三類內含子
Montandon,P. 和 Stutz,E. (1984) 以及 Hallick,R.B. 等人。(1988 年和 1989 年) 報告了在眼蟲葉綠體中發現的一種新型內含子的例子。1989 年,David A.Christopher 和 Richard B.Hallick 提出標題,第三類內含子,以識別這種新類別,其具有以下特徵:第三類內含子比其他自剪接內含子類別短得多,在 Christopher 和 Hallick 已知的內含子中,長度在 95 到 110 個核苷酸之間,並且在葉綠體中被發現。另一方面,Christopher 和 Hallick 宣告:“相比之下,最小的眼蟲葉綠體第二類內含子……是 277 個核苷酸。”它們靠近剪接位點的保守序列與第二類內含子的序列相似,但保守位置更少。它們沒有對映到第二類內含子的保守二級結構中。(事實上,Christopher 和 Hallick 無法在第三類內含子中識別任何保守的二級結構元件。)它們通常與參與翻譯和轉錄的基因相關聯。它們非常富含 A+T。1994 年,發現了長度為其一個數量級的第三類內含子,這表明長度本身並不是第三類內含子剪接的決定因素(Copertino DW., Hall ET.)。第三類內含子的剪接透過套索和環狀 RNA 的形成進行。第三類內含子和核內含子之間的相似性包括保守的 5' 邊界序列、套索形成、缺乏內部結構以及使用替代剪接邊界的 ability。

動物中觀察到的 RNA 編輯系統可能是從單核苷酸脫氨酶進化而來的,這些酶導致了包括 apobec-1 和 adar 基因在內的更大的基因家族。這些基因與參與核苷酸代謝的細菌脫氨酶具有高度相似性。大腸桿菌的腺苷脫氨酶不能脫氨 RNA 中的核苷;該酶的反應袋太小,無法讓 RNA 鏈結合。然而,在相應的 human analog 基因 APOBEC-1 和 ADAR 中,氨基酸變化使該活性位點變寬,從而允許脫氨。在錐蟲線粒體中觀察到的插入編輯與核苷轉化過程無關。其他研究表明,參與其中的酶是從不同來源招募和改造的。但是,透過 gRNA 和 mRNA 之間的相互作用而進行的核苷酸插入的特異性類似於動物和棘阿米巴線粒體中的 tRNA 編輯過程。此外,真核 rRNA 的指導 RNA 分子介導的核糖甲基化可能提供了 RNA 編輯和修飾之間的另一個聯絡。因此,大量研究表明,RNA 編輯可能在物種形成的特定譜系中進化,因為它們的機制存在細微的差異。資料不支援 RNA 編輯在 RNA 世界中存在,因為其機制與當時可能存在的任何假設過程無關。因此,RNA 編輯似乎是在後期進化而來的,以彌補基因序列的變化並增加變異性。
在來自布氏錐蟲線粒體的動力體中發現了透過新增和刪除尿嘧啶進行 RNA 編輯。RNA 編輯始於未編輯的初級轉錄物與引導 RNA (gRNA) 的鹼基配對,引導 RNA 包含與插入/刪除點周圍區域互補的序列。新形成的雙鏈區域然後被包封在編輯體中,編輯體是一個大型多蛋白複合物,催化編輯。編輯體在引導 RNA 和未編輯轉錄物之間的第一個錯配核苷酸處開啟轉錄物並開始插入尿苷。插入的尿苷將與引導 RNA 鹼基配對,只要引導 RNA 中存在 A 或 G,插入就會繼續,並在遇到 C 或 U 時停止。插入的核苷酸會導致移碼,並導致翻譯的蛋白質與其基因不同。
編輯體複合物 編輯體機制涉及在引導 RNA 和未編輯轉錄物之間錯配點的內切核酸酶切割。下一步由複合物中的一個酶催化,即末端 U 轉移酶,它從 UTP 在 mRNA 的 3' 端新增 Us。開啟的末端被複合物中的其他蛋白質固定到位。另一種酶,U 特異性外切核酸酶,去除未配對的 Us。在編輯使 mRNA 與 gRNA 互補後,RNA 連線酶重新連線編輯的 mRNA 轉錄物的末端。因此,編輯體只能沿初級 RNA 轉錄物以 3' 到 5' 的方向進行編輯。該複合物一次只能作用於一個引導 RNA。因此,需要廣泛編輯的 RNA 轉錄物將需要多個引導 RNA 和編輯體複合物。
透過脫氨進行編輯
C-U 編輯 編輯涉及胞嘧啶脫氨酶,它將胞嘧啶鹼基脫氨成尿嘧啶鹼基。C 到 U 編輯的一個例子是人類的載脂蛋白 B 基因。Apo B100 在肝臟中表達,而 Apo B48 在腸道中表達。B100 形式具有 CAA 序列,該序列在腸道中被編輯為 UAA,這是一個終止密碼子。它在肝臟中沒有被編輯。
A-I 編輯 A 到 I 編輯發生在雙鏈 RNA (dsRNA) 的區域。作用於 RNA 的腺苷脫氨酶 (ADAR) 是參與腺苷到肌苷的親水性脫氨 (A 到 I 編輯) 的 RNA 編輯酶。A 到 I 編輯可以是特異性的(在 dsRNA 的片段內編輯單個腺苷)或混雜的(最多 50% 的腺苷被編輯)。特異性編輯發生在短雙鏈體中(例如,在 mRNA 中形成的,其中內含子序列與互補的外顯子序列配對),而混雜編輯發生在更長的雙鏈體區域中(例如,前 miRNA 或初級 miRNA、由轉基因或病毒表達產生的雙鏈體、由配對的重複元件產生的雙鏈體)。A 到 I 編輯有很多影響,源於 I 在翻譯和形成二級結構時都表現得像 G。這些影響包括編碼能力的改變、改變的 miRNA 或 siRNA 靶標群體、異染色質形成、核隔離、細胞質隔離、Tudor-SN 的內切核酸酶切割、miRNA 和 siRNA 加工的抑制以及改變的剪接[50]。
- ↑ Littlefield, O., Korkhin, Y. 和 Sigler, P.B. (1999)。"TBP/TFB/啟動子複合物定向組裝的結構基礎"。PNAS。96 (24): 13668–13673。doi:10.1073/pnas.96.24.13668。PMC 24122。PMID 10570130.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (link) - ↑ Hausner, W; Thomm, M (2001)。"古細菌轉錄起始過程中的事件:開放複合物的形成和 DNA-蛋白質相互作用"。細菌學雜誌。183 (10): 3025–3031。doi:10.1128/JB.183.10.3025-3031.2001。PMC 95201。PMID 11325929.
{{cite journal}}: |author= 和 |last1= 同時指定了多個引數 (help) - ↑ Qureshi, SA; Bell, SD; Jackson, SP (1997)。"嗜熱球菌屬 Sulfolobus shibatae 轉錄所需的因子"。EMBO 雜誌。16 (10): 2927–2936。doi:10.1093/emboj/16.10.2927。PMC 1169900。PMID 9184236.
{{cite journal}}: |author= 和 |last1= 同時指定了多個引數 (help) - ↑ TATA 結合蛋白
- ↑ Jerard Hurwitz (2005)。"RNA 聚合酶的發現"。生物化學雜誌。280 (52): 42477–85。doi:10.1074/jbc.X500006200。PMID 16230341.
{{cite journal}}: 未知引數 |month= 被忽略 (help) - ↑ Grummt I. (1999)。"RNA 聚合酶 I 調節哺乳動物核糖體基因轉錄"。核酸研究進展分子生物學。62: 109–54。doi:10.1016/S0079-6603(08)60506-1。PMID 9932453.
- ↑ Lee Y (2004)。"microRNA 基因由 RNA 聚合酶 II 轉錄"。EMBO J。23 (20): 4051–60。doi:10.1038/sj.emboj.7600385。PMID 15372072.
{{cite journal}}: 未知引數 |coauthors= 被忽略 (建議使用 |author= ) (help); 未知引數 |month= 被忽略 (help) - ↑ Sawadogo M, Sentenac A (1990)。"RNA 聚合酶 B (II) 和通用轉錄因子"。生物化學年評。59: 711–54。doi:10.1146/annurev.bi.59.070190.003431。PMID 2197989.
{{cite journal}}: 引用中存在空值或未知引數: |month= (help) - ↑ Myer VE, Young RA (1998). "RNA 聚合酶 II 全酶和亞複合物" (PDF). J. Biol. Chem. 273 (43): 27757–60. doi:10.1074/jbc.273.43.27757. PMID 9774381.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ a b c d e f g h Acker J, de Graaff M, Cheynel I, Khazak V, Kedinger C, Vigneron M (1997). "人 RNA 聚合酶 II 亞基之間的相互作用". J Biol Chem. 272 (27): 16815–21. doi:10.1074/jbc.272.27.16815. PMID 9201987.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護:多個名字:作者列表 (連結) - ↑ Brickey WJ, Greenleaf AL (1995). "果蠅 RNA 聚合酶 II 的羧基末端重複結構域的體內功能研究". Genetics. 140 (2): 599–613. PMC 1206638. PMID 7498740.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ "Entrez Gene:POLR2A 聚合酶(RNA)II(DNA 指導)多肽 A,220kDa".
- ↑ "Entrez Gene:POLR2B 聚合酶(RNA)II(DNA 指導)多肽 B,140kDa".
- ↑ Khazak V, Estojak J, Cho H, Majors J, Sonoda G, Testa JR, Golemis EA (1998). "新型 RNA 聚合酶 II(pol II)亞基 hsRPB4 與其伴侶 hsRPB7 以及 pol II 相互作用的分析". Mol Cell Biol. 18 (4): 1935–45. PMC 121423. PMID 9528765.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護:多個名字:作者列表 (連結) - ↑ "Entrez Gene:POLR2E 聚合酶(RNA)II(DNA 指導)多肽 E,25kDa".
- ↑ "Entrez Gene:POLR2F 聚合酶(RNA)II(DNA 指導)多肽 F".
- ↑ "Entrez Gene:POLR2G 聚合酶(RNA)II(DNA 指導)多肽 G".
- ↑ "POLR2J3 聚合酶(RNA)II(DNA 指導)多肽 J3".
- ↑ Brickey WJ, Greenleaf AL (1995). "果蠅 RNA 聚合酶 II 的羧基末端重複結構域的體內功能研究". Genetics. 140 (2): 599–613. PMC 1206638. PMID 7498740.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Meinhart A, Cramer P (2004). "RNA 聚合酶 II 羧基末端結構域被 3'-RNA 加工因子識別" (摘要). 自然. 430 (6996): 223–6. doi:10.1038/nature02679. PMID 15241417.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ a b Corden JL (1990). "RNA 聚合酶 II 的尾巴". 生物學趨勢科學. 15: 383–7. doi:10.1016/0968-0004(90)90236-5.
{{cite journal}}: 引用為空未知引數:|month=(幫助) - ↑ a b Phatnani HP, Greenleaf AL (2006). "RNA 聚合酶 II CTD 的磷酸化和功能". 基因發育. 20 (1): 2922–36. doi:10.1101/gad.1477006. PMID 17079683.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ http://en.wikipedia.org/wiki/RNA_polymerase_II_holoenzyme
- ↑ http://en.wikipedia.org/wiki/RNA_polymerase_II_holoenzyme
- ↑ Willis IM. (1993). "RNA 聚合酶 III. 基因,因子和轉錄特異性". 歐洲生物化學雜誌. 212 (1): 1–11. doi:10.1111/j.1432-1033.1993.tb17626.x. PMID 8444147.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Herr AJ, Jensen MB, Dalmay T, Baulcombe DC (2005). "RNA 聚合酶 IV 導向內源 DNA 的沉默". 科學. 308 (5718): 118–20. doi:10.1126/science.1106910. PMID 15692015.
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Wierzbicki AT, Ream TS, Haag JR, Pikaard CS (2009). "RNA 聚合酶 V 轉錄引導 ARGONAUTE4 到染色質". Nat. Genet. 41 (5): 630–4. doi:10.1038/ng.365. PMC 2674513. PMID 19377477.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護:多個名稱:作者列表 (連結) - ↑ Makeyev EV, Bamford DH (2002). "參與轉錄後基因沉默的細胞 RNA 依賴性 RNA 聚合酶具有兩種不同的活性模式". 分子細胞. 10 (6): 1417–27. doi:10.1016/S1097-2765(02)00780-3. PMID 12504016.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Mohamed Ouhammouch, Robert E. Dewhurst, Winfried Hausner, Michael Thomm, and E. Peter Geiduschek (2003). "透過招募 TATA 結合蛋白來啟用古細菌轉錄". 美國國家科學院院刊. 100 (9): 5097–5102. doi:10.1073/pnas.0837150100. PMC 154304. PMID 12692306.
{{cite journal}}: CS1 維護:多個名稱:作者列表 (連結) - ↑ Wärnmark A, Treuter E, Wright AP, Gustafsson J-Å (2003). "核受體的啟用功能 1 和 2:轉錄啟用的分子策略". Mol. Endocrinol. 17 (10): 1901–9. doi:10.1210/me.2002-0384. PMID 12893880.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ 轉錄 (遺傳學)
- ↑ http://en.wikipedia.org/w/index.php?title=Intrinsic_termination&oldid=428278551
- ↑ 5' 帽子
- ↑ Hames & Hooper 2006, p. 225
- ↑ http://en.wikipedia.org/w/index.php?title=Polyadenylation&oldid=422375377
- ↑ 信使 RNA
- ↑ 次要剪接體
- ↑ Jamison SF, Crow A, and Garcia-Blanco MA (1992 年 10 月 1 日). "哺乳動物提取物中的剪接體組裝途徑". 分子與細胞生物學. 12 (10): 4279–87. PMC 360351. PMID 1383687.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Seraphin B. and Rosbash M. (1989). "識別功能性 U1 snRNA 前信使 RNA 複合物,這些複合物致力於剪接體組裝和剪接". 細胞. 59 (2): 349–58. doi:10.1016/0092-8674(89)90296-1. PMID 2529976.
- ↑ Legrain P, Seraphin B, Rosbash M (1988 年 9 月 1 日). "酵母前信使 RNA 早期投入剪接體途徑". 分子與細胞生物學. 8 (9): 3755–60. PMC 365433. PMID 3065622.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Query, C. C., M. J. Moore, and P. Sharp (1994). "前信使 RNA 剪接中的分支親核試劑選擇:對凸起雙鏈體模型的證據". 基因發育. 8 (5): 587–97. doi:10.1101/gad.8.5.587. PMID 7926752.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Newby M. I. and Greenbaum, N. L. (2002). "透過保守的假尿嘧啶對剪接體分支位點識別基序進行雕刻". 自然結構生物學. 9 (12): 958–65. doi:10.1038/nsb873. PMID 12426583.
- ↑ Burge, C.B.; 等 (1999). "剪接體對 mRNA 的前體進行剪接". 在 Gesteland, R.F., Cech, T.R., Atkins, J.F. (編). RNA 世界. 冷泉港實驗室出版社. pp. 525–60. ISBN 0879693800.
{{cite book}}: 在:|author=中明確使用等 (help)CS1 maint: 多個名稱:編輯者列表 (link) - ↑ a b Staley JP, Guthrie C (1998). "剪接體的機械裝置:電機、時鐘、彈簧和其他東西". 細胞. 92 (3): 315–26. doi:10.1016/S0092-8674(00)80925-3. PMID 9476892.
- ↑ Newman AJ,Teigelkamp S 和 Beggs JD (1995)。"酵母剪接體中光活化交聯監測 5' 和 3' 剪接位點 snRNA 相互作用"。RNA。1 (9):968–80。 PMC 1369345。 PMID 8548661.
- ↑ Chiara MD,Palandjian L,Feld Kramer R,Reed R (1997)。"證據表明 U5 snRNP 在哺乳動物中識別催化步驟 II 的 3' 剪接位點"。EMBO J。16 (15):4746–59。 doi:10.1093/emboj/16.15.4746。 PMC 1170101。 PMID 9303319.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Moore, M. J. 和 Sharp, P. A. (1993)。"來自前 mRNA 剪接立體化學的剪接體中兩個活性位點的證據"。自然。365 (6444):364–8。 doi:10.1038/365364a0。 PMID 8397340.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Konforti BB,Koziolkiewicz MJ,Konarska MM (1993)。"破壞 5' 剪接位點與 U1 snRNA 5' 端之間的鹼基配對是剪接體組裝所必需的"。細胞。75 (5):863–73。 doi:10.1016/0092-8674(93)90531-T。 PMID 8252623.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Will CL,Lührmann R (2005 年 8 月)。“U12 依賴性剪接體對一類罕見內含子的剪接”。生物化學。386 (8):713–24
- ↑ http://en.wikipedia.org/w/index.php?title=RNA_editing&oldid=424324287
