分析化學發光/化學發光成像
化學發光成像結合了化學發光的靈敏檢測與定位和量化發光的能力,但最重要的是,它提供了被分析物的平行測定。數字影像由數千個畫素組成,每個畫素由一個獨立的感測器生成,檢測和測量落在其上的光。這使得可以同時測量多個樣品或被分析物以進行高通量篩選。
化學發光成像顯微鏡比熒光更簡單、更準確地檢測標記探針。它可能成為快速、早期診斷各種疾病的重要工具。整個動物體內化學發光成像使得即時監測病理和生物現象成為可能,我們可以預期在藥物發現、生物技術和醫學領域取得重大突破。[1]
過去二十年,我們在從分析訊號中形成影像的能力方面取得了穩步進展。成像利用化學發光的靈敏度和特異性、低背景和寬動態範圍來量化和定位被分析物,直到透過單光子發射實現的水平。早期系統由一個低光真空管裝置[2] 連線到光學顯微鏡。CCD (電荷耦合器件) 和 CMOS (互補金氧半導體) 影像感測器利用不同的技術,這兩項技術都在 1960 年代後期和 1970 年代發明,用於以數字方式捕捉影像。兩種型別的成像器都將光轉換為電荷,並將其處理為電子訊號,就像數碼相機一樣。它們都有各自的優勢和劣勢。就大多數方面而言,CCD 技術與 CMOS 技術相當。成本也類似。
對於化學發光成像,當被分析物空間分佈至關重要時,必須生成一張發光影像以充分表達資料。這可以透過 CCD 來實現,它必須具有高光收集效率。CCD 將光亮度轉換為電幅度訊號。CCD 是在積體電路 (IC) 或晶片上形成的半導體柵極陣列。柵極分別收集、暫時儲存和傳輸電荷,它代表影像的畫素。當光照射到 CCD 感測器時,每個畫素會產生一個小的電荷,每個電荷透過光電效應轉換為電壓並作為模擬訊號輸出,模擬訊號可以透過額外的電路轉換為數字資訊。所有畫素都可以用於光捕獲。CCD 相機,例如數碼相機,包括位於光學系統焦平面的 CCD 成像器 IC 和安裝在印刷元件上的控制電路。捕捉到的影像資料儲存在儲存介質中,例如快閃記憶體或 IC 儲存卡,並可以顯示在顯示器上,例如液晶顯示器 (LCD)。CCD 歷來提供最高的影像質量(以量子效率和噪聲衡量)。增強型 CCD (ICCD) 相機透過光學方式連線到影像增強器。在影像增強器中,來自光源的光子落在光電陰極上,從而產生光電子。透過施加在光電陰極和 MCP 之間的電壓,光電子被加速朝向微通道板 (MCP)。電子透過 MCP 被倍增,並被加速朝向磷光屏,磷光屏將它們轉換回光子,光子透過光纖或透鏡引導到 CCD。ICCD 相機允許高速幀率和即時視覺化,其侷限性是放大產生的噪聲增加。非增強型慢掃描 CCD 相機,冷卻以降低熱噪聲,允許在較長時間內積分訊號,適用於穩態訊號。
CMOS 影像感測器已經成為 CCD 感測器的替代品。它們由包含畫素感測器陣列的積體電路 (IC) 組成,每個畫素包含光電探測器、放大器和用於將電荷(代表光強度)轉換為電壓的附加電路。放大、噪聲校正和數字化通常也在晶片上進行。這些其他功能增加了設計複雜性,並減少了可用於光捕獲的區域。與 CCD 感測器不同,每個畫素都進行自己的轉換,因此均勻性較低,這會影響影像質量。但該晶片需要的晶片外電路更少。“金氧半導體”一詞意味著電晶體結構具有在氧化物絕緣體頂部的金屬柵極電極,而氧化物絕緣體又在半導體頂部。CMOS 感測器用一個 p 型器件來補充每個 n 型電晶體,將一對柵極和漏極連線起來。因為理想情況下,除門輸入被切換時外,電流不會流動,這極大地降低了功耗,並避免了過熱,這是所有 IC 中的一個主要問題。與 CCD 相比,CMOS 可以用更少的元件實現,消耗更少的功率,並提供更快的讀出速度。CMOS 成像器還提供更高的整合度(晶片上更多功能)和更小的尺寸。
可以使用 CMOS 感測器晶片作為化學發光檢測的微型接觸成像器和定量光度計。已研究了其在透過與玻璃蓋玻片上製造的 1 毫米直徑孔中的專用試劑反應,檢測 ATP 的化學發光檢測中的適用性,該玻璃蓋玻片直接放置在成像感測器上。[3] 環境光被排除在外。對於每個孔,化學發光強度在一個 1 x 100 畫素的感興趣區域內平均,並在 200 毫秒的曝光時間內積分。它與 0.1-1 毫摩爾/dm−3 範圍內的 ATP 濃度很好地相關。檢測限(<1 納摩爾 ATP)不如使用更昂貴的 CCD 相機獲得的那麼好,但有可能得到改善。當檢測系統的成本是一個必須最佳化的因素時,例如在“即時”檢測或診斷中,CMOS 晶片適合用於液滴微流控或晶片實驗室裝置。
適用於發光成像的相機應能夠在 10−6 lux 的亮度下形成影像(1 lux = 550 nm 光的 1/621 W m−3)。最靈敏的相機可以探測到單個光子,效率約為 20%,平均噪聲水平為 2 x 10−11 lux = 8 個光子 s−1 cm−2。可用的超低光成像系統包括與具有高數值孔徑 (NA) 物鏡的顯微鏡一起使用的成像光子探測器 (IPD)。高 NA 鏡頭比低 NA 鏡頭收集的光更多。收集的光聚焦到 IPD 上。光子被記錄並存儲為由 IPD 處理器建立的時間和空間座標列表。影像可以重建為任何所需時間間隔內的點陣。這允許在任何時間間隔內進行連續記錄;1 小時內 100 個光子/秒可以儲存在 1 MB 的記憶體中(以影像形式儲存每幀需要 0.3 MB)。化學發光影像基於少量光子,尤其是在曝光時間很短的情況下;雖然 10 分鐘的曝光時間為每秒 100 個光子可以建立一個 60000 個光子的影像,但 1 秒的曝光時間僅提供 100 個光子,因此影像僅包含散佈在影像區域的 100 個點[4] 一個高解析度(高達 1392 x 1040)單光子計數相機系統適用於極低光子發射應用,例如某些化學發光應用。該系統包括一個帶有資料採集和影像處理軟體的控制單元。幀速率可達 100 Hz。
光子計數相機設計的概念化在 DELTA 相機中得到了很好的體現;該相機最初是為天文學設計的,它在各種高解析度問題中具有優勢。它是一種高靈敏度陣列探測器,可以提供光子事件的空間和時間座標,其持續計數率優於每秒一百萬個[5] 它具有平面場、非常高的解析度(對於原型:空間 512 x 591 畫素,時間 2.6 μs)和高通量。每個光子都會產生一個增強的磷光影像,該影像在二維場中的位置與光子相同。該影像聚焦到三個一維 CCD 上,這些 CCD 將其位置記錄為三個相互垂直的座標軸上的座標。軟體將這些座標轉換為正交軸上的 (x, y) 座標,時鐘訊號將事件的時間 (t) 新增到生成 (x, y, t) 座標,這些座標被列出並存儲;由於過度公差或同時光子事件造成的偽影也從資料中去除。
a(iv). 化學發光成像系統
[edit | edit source]一個高解析度 CCD 相機(高達約 6.0 兆畫素),冷卻到約 -70 °C,可以提供最優質的影像、更好的精度、更長的曝光時間(高達 24 小時)、最小的暗噪聲和增強的穩定性。應該有一個防光暗室和一個可調高度的樣品平臺,該平臺具有一個數字計數器,用於在特定的可重複位置進行精確定位。另一種選擇是先進的電機化機器人相機,它可以上下移動,允許相機靠近樣品放置,效能優於標準變焦鏡頭,視野更廣,操作更輕鬆、更快捷,靈敏度更高。這些優勢對於微弱的樣品尤其有用。影像採集和分析軟體為凝膠、板和膜的簡單影像捕獲和分析以及菌落計數提供了全面的工具。影像可以增強,使用者首選項可以定義,報告可以生成,資料可以匯出。一些系統包括一個頂部白光,因此化學發光可以疊加在反射光影像上(所謂的“即時影像”),並結合了熒光、化學發光和比色應用的功能。
並非所有化學發光反應都適合成像;主要要求,尤其是對於成像顯微鏡,是微米級定位[1] 壽命短的激發態物質很適合,可以最佳化條件(尤其是反應物濃度)以最小化激發產物的擴散。由達到穩態產生的輝光型動力學促進了測量過程。酶標記被廣泛使用。
D6b. 高通量篩選 (HTS)
[edit | edit source]成像非常適合高通量篩選。具有極高樣品通量的檢測方法示例包括生物利用度汞的測定,該測定已使用在汞誘導型啟動子控制下表達熒光素酶的大腸桿菌在尿液中測定。通量超過每小時 5000 個樣品,檢測限為 10-13 mol dm−3。可以使用乙醯膽鹼酯酶、膽鹼氧化酶和辣根過氧化物酶 (HRP) 檢測乙醯膽鹼酯酶抑制劑。用每小時 180-360 個樣品的通量進行魯米諾化學發光的動力學分析。
b(i). 微陣列
[edit | edit source]使用平面場校正透鏡的成像可以用於讀取微孔板(高達 4 塊 384 孔板),速度快於比色計,但比色計的靈敏度更高,並且能夠測量快速、閃光型反應。抗體或基因探針的微陣列可以點在 96 孔微孔板上,並使用酶標記的檢測試劑和化學發光底物進行檢測。用 CCD 相機對整個板成像以測量每個孔的光發射。該原理已應用於細胞因子的夾心式酶聯免疫吸附測定 (ELISA) 和基於雜交的 mRNA 測定,每個孔最多有 16 個點;16 x 96 陣列包含 1536 個點,可以使用標準板及其相關的樣品處理裝置進行高通量多分析物檢測。
針對人乳頭瘤病毒 (HPV) 基因型的寡核苷酸探針已用於一種多分析物化學發光成像檢測方法,用於同時測定多達 7 種 HPV DNA。在存在地高辛標記核苷酸 (dUTP) 的情況下,透過聚合酶鏈反應 (PCR) 進行擴增,然後使用新型聚苯乙烯微孔板進行 ELISA,該微孔板具有 24 個主孔(包含地高辛標記 PCR 產物)的陣列,每個孔又分成 7 個子孔(包含固定化的探針)。地高辛標記隨後用過氧化物酶標記抗體和化學發光底物檢測。使用超靈敏 CCD 相機進行成像[6] 結果與傳統的比色 PCR-ELISA 相當。
b(ii). 微陣列
[edit | edit source]透過對陣列密度高達每平方釐米數百個點的化學發光進行高解析度成像,可以進行數千次同時測定。基於陣列的基因表達分析就是一個很好的例子。基於抗原-抗體或配體-受體相互作用的蛋白質分析越來越多地應用於臨床和研究工作以及藥物發現。除了用於蛋白質表達譜分析外,還有一些高通量蛋白質微陣列可以檢測多達 35 種細胞因子。將特異性抗體點在膜上,然後與樣品一起孵育,捕獲的分析物透過增強化學發光使用 HRP 標記的抗體和 HRP 底物進行檢測。用於腫瘤標記物平行 ELISA 的蛋白質晶片可以發現可以提高診斷敏感性和特異性的模式[7] 晶片上固定了 12 種針對不同腫瘤標記物的單克隆抗體,透過將晶片與血清樣品一起孵育進行捕獲。HRP 偶聯的二抗用於透過化學發光成像進行檢測。該晶片已成功應用於癌症診斷和對高危無症狀人群進行篩查。
b(iii). 小型分析裝置
[edit | edit source]小型分析儀器使用極小的樣品量,因此需要非常靈敏的檢測技術;化學發光成像具有所需的高解析度和高靈敏度。分析方法包括使用鍍金表面或玻璃毛細管對多個樣品中除草劑 2,4-D 進行 ELISA 測定,以及在五分鐘內對牛奶中最多十種抗生素進行測定:將樣品與混合單克隆抗體一起孵育,然後使用 HRP 標記的二抗和合適的化學發光底物進行檢測。可以在包含一排垂直玻璃通道的三維晶片中進行多次雜交。特異性基因探針固定在通道內壁上。這透過提供比二維微陣列中可用的更大的探針固定區域來增強訊號。樣品流過通道,並透過酶標記抗體和化學發光底物檢測分析物。發射物種的橫向擴散被微通道壁阻止;這提高了影像的解析度。微型分析儀器的化學發光成像也適用於多重分析(同時對不同分析物或不同樣品進行定量),方法是將化學發光在每個分析物或樣品的不同目標區域上進行積分。
化學發光成像檢測與 CCD 相機可用於發生在凝膠和膜上的反應。這允許在寬動態範圍內進行強度測量,並且存在軟體可用於計算影像特定區域的總髮射量以進行分析目的。影像可以儲存在磁碟上或打印出來。
電泳是帶電分子的移動,因此是分離,在電場中;聚丙烯醯胺凝膠電泳 (PAGE) 特別適合分離低濃度分子。分離的分子可以透過電印跡轉移到硝酸纖維素膜上 - 電泳方向垂直於凝膠表面;這也被稱為蛋白質印跡,用於檢測組織勻漿或提取物樣品中的特定蛋白質。透過類似的程式,Southern 印跡識別複雜混合物中的特定 DNA 序列,Northern 印跡定位 RNA。在蛋白質印跡中,電印跡之後是免疫染色,其中特定蛋白質透過標記抗體識別。DNA 和 RNA 可以透過與標記探針雜交以類似方式識別。
斑點印跡是一種免疫技術,用於用抗體檢測混合物或組織裂解液等樣品中的特定蛋白質。它基於蛋白質印跡,但蛋白質在 SDS-PAGE 上沒有分離。一種這樣的分析方法是檢測 B19 細小病毒。將樣品點在膜上後,與地高辛偶聯的 DNA 探針雜交併用 HRP 或 AP 標記的地高辛抗體處理,化學發光成像比使用比色法提供了十倍的檢測限。
細胞色素可以透過使用十二烷基硫酸鈉 (SDS-PAGE) 的 PAGE 分離並轉移到硝酸纖維素膜上;細胞色素 c(包含催化血紅素基團)透過過氧化物酶-魯米諾化學發光檢測。[8] CCD 成像產生的檢測靈敏度是 3,3',5,5'-四甲基聯苯胺染色方法的 50 倍。需要不到 1 毫升的細菌培養物樣品。類似的分析方法基於魯米諾/過氧化氫化學發光,使用過硫酸銨增強,檢測 PAGE 後 15 μL 樣品中的血紅蛋白表型。[9] 其他含鐵蛋白,如過氧化氫酶和鐵蛋白,也可以被檢測到。與傳統的染色方法相比,所提出的檢測方法非常快(幾分鐘對幾小時)。
MIPs 具有與分析物形狀、大小和功能互補的人工識別位點,因此它優先於其他密切相關的結構被選擇。它們比抗體、酶和生物受體更便宜、更耐用,並且可以在這些生物分子不可用時使用。識別位點是圍繞合適的模板(最好是分析物本身)製造的,該模板在聚合後被提取。
通常,當模板分子和功能單體在有機溶劑中混合時,模板和單體之間會透過極性相互作用形成絡合物。與交聯劑的聚合固定了極性基團的位置。用合適的溶劑去除模板會留下特定的識別位點。選擇功能單體以促進與模板的氫鍵形成,以獲得良好的選擇性和可逆性。當 MIP 暴露於與聚合中使用的條件相同的條件下時,會發生最佳結合,因為它取決於印跡腔的形狀以及配位功能基團的空間位置。這兩者都取決於條件,並受聚合物溶脹的影響,這可以被利用來實現吸附分子的快速且可控的釋放,然後進行檢測。
聚合物的分子印跡已與化學發光成像檢測相結合,以實現苯丙氨酸 (Phe) 的丹磺醯衍生物的手性識別。[10] 使用沉澱聚合(產生均勻的微球)以丹磺醯-L-Phe 為模板合成 MIP 微球,並將微球使用聚乙烯醇 (PVA) 作為粘合劑固定在微孔板(96 孔)上。分析物被選擇性地吸附到 MIP 微球上。洗滌後,使用過氧草酸酯化學發光 (POCL) 分析對結合部分進行定量,POCL 分析是一種對所有熒光和熒游標記分析物通用的方法,其量子產率高於大多數其他化學發光系統。在存在丹磺醯-Phe 的情況下,雙(2,4,6-三氯苯基)草酸酯與過氧化氫 (H2O2) 反應產生化學發光發射。訊號由高度靈敏的冷卻 CCD 檢測和定量。使用軟體對構成點的所有畫素的強度進行求和,以確定板中每個孔的影像的強度。化學發光強度隨著樣品中 L-對映異構體的比例而增加。因此,可以透過比較混合物的強度以及相同濃度下純 D-和 L-對映異構體的強度來確定手性組成。結果表明,基於 MIP 的化學發光成像對於快速手性識別非常有用,並且由於該方法可以在 30 分鐘內同時進行許多獨立測量,因此可以實現高通量篩選。
已經開發出一種簡單、靈敏和特異的方法,用於激動黴素這種血管擴張劑的高通量檢測。[11] 所提出的方法基於具有 MIP 識別的化學發光成像分析,提供選擇性。
使用沉澱聚合以甲基丙烯酸 (MAA) 為功能單體,三羥甲基丙烷三甲基丙烯酸酯 (TRIM) 為交聯劑,激動黴素為模板製備分子印跡微球。在沒有模板的情況下製備非印跡聚合物 (NIP) 以用作對照。使用 0.1% PVA 作為粘合劑將微球包覆在 96 孔微孔板中。與樣品孵育後,透過 POCL 確定聚合物結合的激動黴素量。使用冷卻高解析度 CCD 相機測量發射的光。每個孔的影像的強度如 c(i) 小節中所述確定。
在最佳條件下,相對化學發光強度與激動黴素濃度之間存線上性關係,範圍為 0.02 到 10 μg ml−1。檢測限為 0.006 μg ml−1。該方法透過測量加標尿液樣品中的激動黴素濃度進行驗證。在 MIP 存在的情況下,對尿液中許多正常成分的高耐受性被證明比在 NIP 存在的情況下大得多。基於 MIP 的化學發光成像對激動黴素具有高度選擇性和靈敏度,並結合了高樣品通量和經濟性(50 μl/孔)。[12]
化學發光成像的目標分子包括抗原、DNA 序列、酶和代謝物。細胞、組織或整個動物的化學過程也可能成為目標。使用的方法包括成像顯微鏡、免疫組織化學 (IHC)、原位雜交 (ISH);也可以使用其他化學或酶促反應。化學發光影像疊加在可見光影像上,並透過背景扣除、對比度增強、偽彩色和對定義區域進行定量進行處理;絕對定量需要可重複的條件、校準系統和合適的樣品特性。
化學發光成像顯微鏡使用普通顯微鏡,並優化了光收集。透過簡單的鏡頭耦合系統,光損失最小化;無需蓋玻片。顯微鏡或至少樣品被置於暗箱中,以排除環境光,並有一個電機驅動的微米級載物臺,允許自動調節。將樣品與化學發光試劑孵育,直到獲得穩態發射。物鏡具有與可接受的焦散和景深相相容的最高數值孔徑 (NA)。使用乾式而非油浸式物鏡,並提供足夠的放大倍率和空間解析度,以定位單細胞或組織切片中的分析物;[13] HRP 的檢測限約為 500 個分子/μm2。[14]
化學發光顯微鏡已成為生物醫學研究的標準工具。光子探測器已連線到顯微鏡,並允許對細胞和組織中的化學發光探針和報告基因進行成像。光子計數技術允許連續成像數天,而不會建立過大的檔案。然而,熒光成像比化學發光成像具有更好的空間解析度,並且使多次測定更容易。
鈣可以透過使用光蛋白水母素來確定細胞質和細胞器中的鈣,水母素是一種從水母Aequorea victoria中提取的細胞內鈣指示劑。天然水母素由一個多肽 (apo-水母素) 組成,它與一個疏水性輔基 (水母螢) 共價結合。使用水母素[3] 對遊離細胞質鈣進行成像的原理是,水母素分子在與鈣結合時的構象變化,導致水母螢被氧化為水母醯胺,同時產生二氧化碳併發射藍光 (466 nm)。水母素無法穿透細胞的質膜。微注射是確定大型細胞中細胞質鈣的首選方法。對於小細胞,apo-水母素 cDNA 的克隆和轉染使微注射變得不必要,從而大大簡化了鈣記錄。基因表達的 apo-水母素不含水母螢,因此不發射光。透過將標本浸泡在水母螢中將其重建為水母素。透過將訊號轉運序列整合到多肽鏈中,apo-水母素可以靶向特定的細胞器。
水母素靈敏度高且具有特異性,儘管單個細胞中含有低濃度,但會產生微弱的化學發光。強度與細胞體積成正比,因此與直徑的立方成正比。小細胞存在問題,因為水母素的量很少。在直徑為 10 μm 的細胞中,靜息鈣濃度導致每小時發射不到一個光子 - 因此必須使用熒光。但是,可以使用光子計數相機透過化學發光對升高的鈣濃度或大量細胞進行成像。天然水母素可以準確測量 Ca2+ 濃度,範圍為 0.5 到 10 μmol dm−3,適用於瞬時變化,但對於更高的濃度,已經構建了一種突變體形式,透過提高其解離常數並降低其對鈣的親和力,將工作範圍擴充套件到 100 到 1000 μmol dm−3。它比鈣特異性熒光探針具有優勢,因為它可以長時間進行即時測量;這是可能的,因為由於水母素濃度低 (約 5 nmol dm−3),不會干擾細胞內環境 (包括 Ca2+ 緩衝能力),但它的解析度較差,並且會因高鈣濃度而迅速消耗。然而,水母素化學發光具有出色的信噪比和極低的背景噪聲。
使用水母素進行化學發光鈣成像是探索性研究的首選方法,因為它非常靈敏,可以檢測到廣泛的鈣濃度。化學發光反應相對於鈣濃度的動力學階數為 2.1 或更高,這提供了固有的對比度增強。與熒光不同,它不需要分析師進行預先預測或假設,從而排除了預期範圍之外的鈣訊號。但它無法與熒光方法的高空間解析度相媲美。此外,化學發光顯微鏡使用較大的景深,尚未實現光學切片。
在Aequorea victoria中,化學發光鈣結合蛋白 (水母素) 與 GFP 相關。已經構建了鈣敏感的生物發光報告基因,這些基因融合了 GFP 和水母素,以提高鈣誘導的生物發光的量子產率。[15] GFP 與遊離水母素的共表達不會產生相同的效果。透過在 GFP 和水母素之間包含不同長度的肽間隔子來改變構建體;在所有情況下,都發射了更多光,並且構建體在細胞質中更加穩定,並且對鈣的敏感性高於單獨的重組 apo-水母素。
共振 (非輻射) 能量從水母螢的激發氧化產物傳遞到 GFP 髮色團取決於它們的相對位置。因此,肽間隔子是靈活的,並且長度可變。在將報告基因引入細胞 (轉染) 後 48 小時測量不同構建體發射的光的綠色:藍色比率 (500 nm:450 nm)。透過 GFP 與水母素的共價連線,綠色:藍色比率增加,當新增連線子時,綠色:藍色比率進一步增加;隨著連線子變長,最大發射波長增加,光譜頻寬減小。由於連線子使更合乎需要的構型成為可能,因此分子內能量轉移的效率得到了提高,達到與體內共振能量轉移相當的水平。
使用 GFP-水母素融合體,可以在單個細胞中檢測到生理鈣訊號。對細胞進行轉染,然後用水母螢重建水母素。結果是鈣誘導的光子發射,可以使用冷卻的 ICCD 相機檢測,積分時間僅為一秒。以前,細胞質水母素僅透過使用光電倍增管檢測 Ca2+ 活性,光電倍增管更靈敏,但缺乏任何空間解析度,或者透過使用靶向熒光探針,這些探針反應更快。在使用轉基因中,水母素報告 Ca2+ 活性,而 GFP 增強生物發光,這可能導致對完整動物中整合的神經迴路以及特定亞細胞區室中的鈣振盪進行即時成像。水母素和 GFP 增強探針以及合成熒光染料可以靶向內質網 (ER);[16] 內質網是細胞質中的一種膜網路,參與細胞物質的合成、修飾和轉運;這使內質網的作用得以澄清。
如果樣品的酶活性得以保留,並且樣品處於底物可以進入活性位點的狀態,則可以透過化學發光成像定位酶活性。透過將化學發光底物直接應用於酶,可以獲得最佳的空間解析度,例如,可以透過二氧雜環丁烷磷酸酯檢測鹼性磷酸酶。與化學發光耦合的酶反應可用於代謝物定位,但解析度較低。可以在衝擊冷凍的組織活檢中以飛摩爾級和微米級解析度確定代謝物。在組織中儘快冷凍,以停止酶活性並固定代謝物。然後將標本放置在溫度可控的顯微鏡載物臺上,並新增化學發光試劑。發射強度在溫度升高到足以記錄的水平後立即記錄,並轉換為代謝物濃度。
測量[17] 快速冷凍組織中代謝物(如 ATP、葡萄糖和乳酸)的空間分佈是基於酶促反應,將代謝物與螢光素酶連線,隨後產生光發射。使用陣列,冰凍切片以可重複的方式與酶接觸,誘導切片中發出與代謝物濃度成正比的光,具有高空間解析度。ATP 的分佈與細胞活力之間存在密切相關性;腫瘤和正常組織之間也存在分佈差異。使用基於螢光素酶的化學發光成像,已在動脈壁冰凍切片中以顯微水平和高空間解析度確定了 ATP、葡萄糖、糖原和乳酸。[18] 這是一種測量能量代謝物的強大工具。它已被用於量化動脈環中區域性代謝物濃度。在缺氧體外條件下,能量代謝物的分佈是不均勻的。氧氣和營養物質的擴散距離可能很長,並且可能使血管容易在能量代謝中形成區域性缺陷,這可能導致動脈粥樣硬化。
e(ii). 螢光素酶在活細胞和生物體中的表達
[edit | edit source]螢光素酶是在氧氣和螢光素(新增連結)存在下發出光的酶。它們已被用於基因表達的即時低光成像;編碼序列已透過螢光素酶標記的基因探針檢測到。[19] 這些標籤包括細菌 lux 和真核螢光素酶 luc 和 ruc 基因。不同的螢光素酶在發射訊號的穩定性/可變性方面有所不同。在許多啟動子搜尋和靶向基因表達實驗中,螢光素酶一直充當報告基因。例如,螢光素酶的光子計數 CCD 成像已被用於顯示單個胰島β細胞的啟動子活性以及人類免疫缺陷病毒 (HIV) 和鉅細胞病毒的調節。螢光素酶成像也被用於體內追蹤細菌和病毒感染,以及視覺化動物模型中腫瘤細胞的增殖。受感染的細胞在百萬分之一的細胞發生率下很容易檢測到。單個細菌細胞,無論是轉化的還是自然發光的,也已被成像,並且由於代謝活性的波動,隨著時間的推移,表達的變化已被證明。低光 CCD 成像本身是一種非侵入性技術,可用於觀察(見小節 b(iv)。凝膠和膜的記錄 新增連結)細胞內基因表達和小型測定,如原位雜交 (ISH) 以及免疫測定、凝膠和印跡 [新增連結]、DNA 探針和體內成像(見第 D6h 節,新增連結)。對於長曝光的高解析度成像,慢掃描液氮冷卻 CCD 相機更可取,但對於較短的曝光時間,光子計數 CCD 相機更好。ICCD 相機可以檢測到大於 1 Hz 的頻率閃爍。
e(iii). 生物發光成像的其他應用
[edit | edit source]生物發光成像已應用於實驗生物醫學研究,例如壞死的發生,以及生物學的其他領域。[20] 它也特別用於臨床腫瘤學中的腫瘤活檢。與免疫組織化學、放射自顯影或原位雜交相結合,它可能特別強大。已證明對於鱗狀細胞癌,原發病灶中乳酸的積累與高轉移風險相關。透過這種方式,代謝圖譜表明惡性程度和腫瘤的預後;它促進了許多基礎研究。
e(iv). 確定代謝物的其他方法
[edit | edit source]存在許多其他確定活細胞和組織中代謝物的示例,包括代謝物產生的即時成像。使用與膽鹼氧化酶和辣根過氧化物酶偶聯的反應,已在大鼠冠狀腦切片中檢測到內源性乙醯膽鹼酯酶 (ACE) 活性。[21] 試劑經過最佳化,最大限度地減少了發射物質的擴散,從而實現了清晰的定位和非常低的背景。這種成像測定比體外系統更具預測性;並且可以用於確定 ACE 分佈的病理生理變化或體內 ACE 抑制劑的作用,這對於篩選候選藥物可能有用。
透過與魯米諾和過氧化氫反應釋放來自細胞培養物和活組織的一氧化氮 (NO) 已被視覺化,以產生光子,這些光子使用與光子計數相機耦合的顯微鏡計數,從而對釋放時間過程和擴散曲線有了新的認識。[22] 該方法允許積分時間為分鐘級,以提高信噪比。然而,這種方法的高靈敏度也使其能夠在幾秒鐘內生成影像,從而允許生成即時動態影像。這種方法已經證明了對 NO 形成進行即時成像的潛力,具有高時間和空間解析度。由於 NO 的半衰期短,以前對這種現象知之甚少。
D6f. 原位雜交 (ISH) 和免疫組織化學 (IHC)
[edit | edit source]ISH 和 IHC 是一種將分析物定位在各種合適的樣本中的技術,例如細胞塗片,或冷凍或石蠟包埋切片。化學發光檢測不需要任何特殊的樣本製備,但為了可重複性,需要從 3 到 5 μm 的精確控制的切片厚度。與比色法或熒光法相比,加入化學發光檢測 (CL-IHC 和 CL-ISH) 可提高靈敏度。這將可靠且準確的空間分佈的定量評估新增到探針的特異性中。化學發光檢測酶標記的“理論”檢測限為 10−21 到 10−18 摩爾;作為 ISH 的檢測器,化學發光幾乎與35S 放射自顯影一樣靈敏,為放射性物質的使用提供了一種無毒的替代方法。[23]
可以透過與互補核酸探針雜交來實現細胞核心酸序列(例如,染色體中基因的位置)的定位。兩種型別的原位雜交分別涉及核 DNA 和細胞 RNA;它們在概念上相似,但在實踐細節上有所不同。該技術通常在為光學顯微鏡製備的樣本上進行。據稱,評估化學發光影像幾乎不需要顯微鏡培訓。

圖 D6.1 – 執行原位雜交操作的流程圖。(所有孵育均在室溫下進行)。
f(i). 人乳頭瘤病毒 (HPV) 的 CL-ISH 測定
[edit | edit source]ISH 涉及核酸探針與樣本中內源性或外源性 (病毒/細菌) DNA 或 RNA 的雜交。該過程總結在圖 D6.1 中。透過間接標記提高靈敏度,其中標記物與生物特異性化學發光試劑結合,例如,生物素與鏈黴親和素結合;熒光素或地高辛與其各自的抗體結合,化學發光試劑具有共價結合的訊號基團(通常是 AP 或 HRP)。HPV 的 ISH 可以使用地高辛標記的基因探針,然後使用 HRP 標記的抗地高辛抗體和化學發光試劑進行成像。[24] 為了定位病毒,化學發光影像(其強度由偽彩色表示)疊加到透射光影像上。ISH 也已使用生物素標記的 HPV 互補 DNA 探針,並透過 HRP 標記的二抗檢測,對三株人類癌細胞系和 40 例人類宮頸癌前病變和癌前病變活檢標本進行檢測;化學發光由 ICCD 相機檢測。[15] 在僅 10 分鐘的光子積累後,在細胞系塗片以及連續組織切片上,化學發光與 35S 放射自顯影法獲得的結果相當。
CL-ISH 是定量的,因為化學發光是與標記物的酶活性成正比的,並且與每個細胞的基因複製數成正比。在對鉅細胞病毒的單獨研究中,化學發光與感染細胞的數量成正比(在病毒複製後)。
f(ii). 鉅細胞病毒的 CL-ISH
[edit | edit source]早期的鉅細胞病毒 DNA 在感染的人類成纖維細胞中的 ISH 檢測[13] 使用了二氧雜環丁烷標記的探針和 AP 標記的抗二氧雜環丁烷抗體。使用低光成像發光計,使用 1,2-二氧雜環丁烷檢測到 400 amol 的 AP。化學發光強烈而穩定,使單細胞內定量成為可能,空間解析度為 1 μm,背景非常低。已開發出多重 CL-ISH 檢測方法,其中具有不同酶標記的探針檢測不同的靶標。此類技術的一個例子是使用以下方案定位同一標本中單純皰疹病毒和鉅細胞病毒的 DNA。將更快的 HRP/魯米諾新增到標本中,並對化學發光進行成像,對標本進行短暫洗滌,然後新增 AP/二氧雜環丁烷,並記錄第二個化學發光影像。如果先新增 AP,則需要更長時間的洗滌。
f(iii). 單個感染細胞中細小病毒 B19 核酸的 CL-ISH
[edit | edit source]人類細小病毒 B19 是多種疾病的病原體。CL-ISH 具有高解析度,可提供病毒核酸在感染後不同時間單細胞培養物中的精確定位和定量檢測,從而對感染過程進行客觀評估,其靈敏度高於由觀察者小組評估的比色 ISH 檢測。CL-ISH 提高的靈敏度可檢測到每個樣本中更多的陽性細胞,從而可以更早地診斷。
已開發出一種肽核酸 (PNA),它具有比其他 DNA 探針更高的特異性和更快、更強的結合能力。該檢測基於使用生物素標記的 PNA 探針,該探針透過鏈黴親和素連線的鹼性磷酸酶 (AP) 檢測,使用眾所周知的生物素-鏈黴親和素親和力
PNA–生物素 + 鏈黴親和素–AP → PNA–生物素–鏈黴親和素–AP
金剛烷基 1,2-二氧雜環丁烷磷酸鹽 + AP → 激發片段產物 → 光
產生的化學發光訊號使用連線到具有高透射光學元件的落射熒光顯微鏡的超靈敏氮冷 CCD 相機進行定量和成像,並對化學發光的採集進行了修改。使用模擬感染細胞作為陰性對照,建立了閾值訊號(代表探針的非特異性結合和內源性鹼性磷酸酶活性)。在 B19 病毒感染週期後,可以準確地監測感染細胞的百分比,該百分比在感染後 24 小時達到峰值。化學發光檢測的優點(高檢測能力和寬線性範圍)允許對感染的單個細胞中病毒核酸進行定量分析,顯示出感染後隨著時間的推移而持續增加。此類研究可能是評估和診斷病毒感染以及測量感染細胞病毒載量的有力工具。[25]
f(iv). 具有化學發光檢測 (CL-IHC) 的 IHC
[edit | edit source]IHC 涉及使用抗體,這些抗體與內源性、病毒或細菌抗原(通常是蛋白質)結合,隨後透過酶偶聯抗體檢測。CL-IHC 透過 HRP 標記的抗體和魯米諾/H2O2 檢測甲狀腺組織中的上皮,具有足夠的解析度和比比色法或熒光法更高的靈敏度。CL-IHC 還可以有利地應用於幽門螺桿菌感染的胃活檢標本中白介素 8 (IL-8) 的定位,幽門螺桿菌是一種與胃潰瘍相關的生物體。它顯示出比其他檢測系統更高的靈敏度,可以顯示粘膜中 IL-8 濃度的變化以及上皮細胞中高濃度區域。

圖 D6.2 - 免疫組織化學操作流程圖。(所有孵育都在室溫下進行)。
f(v). 宮頸癌中的 HPV 和 p16(INK4A) 標記
[edit | edit source]宮頸癌(宮頸上皮內瘤變,CIN)分為低度(CIN1)或高度(CIN2 或 CIN3)以便預測早期病變進展的風險,併為手術干預做出決定。基於組織學判斷的不精確在於,不同的觀察者對同一個活檢標本分配不同的級別。克服這一難題的一種方法是根據分析化學重新定義診斷標準。
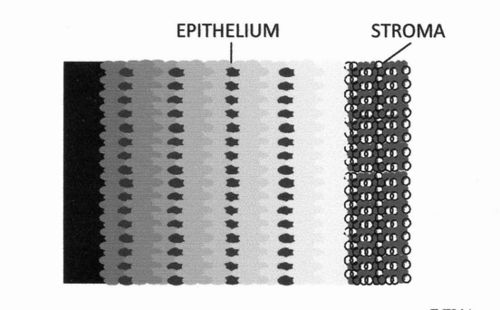
圖 D6.3 - 宮頸癌活檢組織切片中 p16INK4A 定位的示意圖。顏色越淺,化學發光發射越強。(實際的化學發光影像顯示在參考文獻 27 中的圖 1 中,該圖是該圖的依據)。
已使用具有化學發光檢測 (CL-IHC) 的免疫組織化學檢測方法(見圖 D6.2)定量評估 p16INK4A 蛋白的過表達及其在宮頸癌和非癌性宮頸病變樣本上皮中的定位。圖 D6.3 顯示化學發光(以及 p16INK4A 蛋白含量)通常從左到右增加。高度病變在上皮中通常發出比低度病變更強烈的化學發光訊號,並且顯示出 p16INK4A 蛋白不同的分佈。根據化學發光訊號的強度和參與 p16INK4A 過表達的上皮百分比,獲得了表達評分,該評分很好地區分了不同的病變。確定了區分低度和高度的臨界值。不同 CIN 等級的平均評分之間的差異具有統計學意義。[26]

圖 D6.4 - 宮頸活檢組織切片中 p16INK4A 和 HPV DNA 共定位的示意圖。(A)透射光顯微照片影像,(B)CL-IHC 影像,顏色越淺,p16INK4A 越多,(C)CL-ISH 影像,顏色越淺,HPV DNA 越多,(D)CL-ISH 影像用藍色、黃色和紅色偽彩色表示化學發光強度的增加。(B)、(C)和(D)顯示疊加在透射光影像上的影像,以顯示訊號的定位。(實際的化學發光影像顯示在參考文獻 27 中的圖 3 和 4 中,該圖是該圖的依據)。
透過 CL-IHC 確定 p16INK4A 過表達使用 AP 作為酶標記,然後在緩衝液中洗滌後,使用 HRP 作為標記來確定 HPV DNA 透過 CL-ISH[24](見圖 D6.1 和部分 f(i) 新增連結)以避免兩種檢測方法之間的干擾。[27] 為了避免連續組織切片的非等效性,兩種檢測方法在同一個樣本上進行。由於 ISH 中的高溫步驟會使透過 IHC 測定的 p16 蛋白變性,因此這兩種檢測方法不能以相反的順序進行。化學發光的高檢測能力可以更好地區分病變為非癌性、CIN1 或高度 CIN。這可能成為一種客觀而準確的診斷檢測方法。
f(vi). 惡性黑色素瘤中的黏膜人乳頭瘤病毒
[edit | edit source]高風險 (HR) 人乳頭瘤病毒 (HPV) 與癌症密切相關。它已在原發性黑色素瘤和色素性皮膚斑點 (胎記、痣) 中發現,但在正常皮膚中很少報道,正常皮膚通常感染其他相對無害的 HPV 毒株。皮膚癌中的 HPV DNA 已透過聚合酶鏈反應 (PCR) 檢測到。為了理解 HPV 與原發性黑色素瘤之間的關係,有必要了解 HPV 是否侷限於癌細胞而不是腫瘤活檢中存在的正常皮膚細胞,多少比例的細胞攜帶病毒,或者是否可能是病毒從健康皮膚汙染腫瘤表面造成的。由於 PCR 方法僅測量總 DNA,因此不適合確定這一點。

圖 D6.5 - 對經過 HPV DNA 的 FL-ISH 和腫瘤標記物 HMB-45 的 CL-IHC 聯合處理的組織切片的示意圖。大的彩色點代表細胞。紅色假彩色分配給化學發光訊號,黃色分配給熒光訊號,不同的訊號強度由不同的色調錶示。HPV 和 HMB-45 的共定位由組合的假彩色橙色表示。
為了定位 HR-HPV,已經開發出一種快速、特異且非常敏感的方法,該方法將酶增強型熒光原位雜交 (FL-ISH,見圖 D6.1 新增連結) 用於檢測 HPV 核酸 (16 型和 18 型,這兩種型別最有可能導致癌症) 與化學發光免疫組織化學 (CL-IHC,見圖 D6.2 新增連結) 方法相結合,用於在腫瘤黑色素細胞標記物 HMB-45 的同一部分中順序檢測。有必要使用相同的切片,因為黑色素瘤細胞在標本中分佈不均勻。HMB-45 測定是黑色素瘤細胞分化的指標,在診斷病理學中被廣泛使用。FL-ISH 和 CL-IHC 的數字影像分別記錄,分配不同的假彩色 (見圖 D6.5),並使用特定軟體進行影像分析合併。結果表明,HPV 核酸和黑色素瘤標記物在同一活檢切片中的共定位非常明顯 (約佔標本總髮光面積的 70%)。在較小的區域,檢測到沒有 HMB-45 的 HPV (佔總量的 9.5%) 或沒有 HPV 的 HMB-45 (佔總量的 20.5%)。這表明病毒核酸特異性存在於黑色素瘤細胞中,並支援 HPV 在惡性黑色素瘤中可能發揮著積極作用。[28]
D6g. 熒光報告器的化學發光成像
[edit | edit source]熒光檢測對於原位雜交和免疫組織化學仍然具有重要價值,特別是因為與化學發光相比,它具有更高的空間定位精度。然而,化學發光可以被用作一種激發熒光探針和標記的替代方法,而不是光激發。本節將考慮該原理的兩個示例。
g(i). 過氧草酸酯化學發光
[edit | edit source]使用基於成像晶片的裝置,已報道了對水性環境中草醯胺 I 水性過氧草酸酯化學發光 (POCL) 的檢測[29],用於熒游標記的分析物,並且已被證明至少與使用直接熒光檢測一樣靈敏,直接熒光檢測需要光源進行激發。使用 CCD 相機記錄從 1000 倍範圍內的分析物濃度發出的化學發光強度,研究了硝酸纖維素膜上熒游標記免疫球蛋白的 POCL 檢測靈敏度。金黃色葡萄球菌腸毒素 B (SEB) 及其抗體的 POCL 也用於使用 CCD 相機演示免疫和親和檢測。SEB 透過免疫夾心分析法檢測,其中 SEB 被固定在硝酸纖維素膜上的綿羊多克隆抗體捕獲,隨後被捕獲的小鼠單克隆抗體捕獲,隨後透過熒游標記的抗小鼠抗體檢測。生物素標記的抗 SEB 抗體的親和檢測使用熒游標記的鏈黴親和素。
使用與 CMOS 彩色成像晶片接觸成像 (新增連結),已經證明了使用兩種不同熒游標記標記的牛血清白蛋白的 POCL 的同時檢測。將蛋白質點在固定到蓋玻片上的膜盤上,該蓋玻片放置在晶片的感測表面上。它們在 8 秒曝光後分別以紅色和綠色斑點可見;混合的標記樣本發出黃色光。該程式可能適用於讀取微陣列。
g(ii). 生物發光共振能量轉移 (BRET)
[edit | edit source]一種自發光的熒光報告器,包括與 AP 結合的染料,已“原則上”證明了使用 CCD 相機或 CMOS 彩色晶片進行成像檢測,從而有可能對熒光訊號進行成像,而無需外部光源或複雜的 光學器件。[30] 它基於生物發光共振能量轉移 (BRET),一個例子是使用 GFP 來增強來自光蛋白水母蛋白的發光 (見部分 d(iii) 新增連結)。BRET 的效率透過最小化生物發光能量供體和熒光受體之間的距離來提高,並且還發現它取決於共軛物中 AP 與熒光團的比率、所使用的熒光染料以及化學發光底物。化學發光檢測成本低廉,適用於低濃度和行動式,但發光產物的擴散導致空間解析度差。BRET 是解決此問題的潛在解決方案,但尚未應用於實際分析問題。
在演示中,固定在 CMOS 表面上的抗體捕獲了一個生物素標記的目標分子,然後該目標分子與鏈黴親和素標記的 AP-染料共軛物結合。AP 用於產生光,捕獲的陣列影像顯示在計算機監視器上。還透過使用 CCD 相機獲得了影像。AP 的化學發光底物在 450 nm 處發射;來自此發射的能量被轉移到熒光染料。這導致了在目標分子位置的第二個波長更長的光發射 (580 nm),避免了化學發光產物擴散的問題。透過這種方式,與傳統的化學發光檢測相比,影像空間解析度得到了極大提高。被染料吸收的更短波長的第一個發射被高通濾波器去除。
D6h. 全器官和全生物體成像
[edit | edit source]使用遠離光發射位置的相機可以對發生在器官和生物體內部的事件進行成像。該技術可應用於研究廣泛的現象,例如腫瘤生長、轉移和藥物療效,透過注射和成像重組發光腫瘤細胞進行評估[31],它可用作腫瘤位置的探針。分子成像技術的另一個應用是表達螢火蟲熒光素酶 (Fluc) 報告基因的移植胚胎心肌成纖維細胞的非侵入性監測。[32] 還對發光大腸桿菌 (表達熒光素酶和底物合成所需酶) 在大鼠腸道中的運動進行了成像。[33]

圖 D6.6 - 轉基因菸草葉片中發光素酶表達的示意圖,在黑色背景下成像。光發射由白色或灰色區域表示。(該圖基於參考文獻 34 圖 1 中再現的影像)
用於標記細胞、病原體和基因的熒光素酶是可被外部檢測到的內部指示劑。已經生產出轉基因生物,其中Renilla reniformis 熒光素酶基因在菸草 (Nicotiana tabaca)、番茄 (Lycopersicon exculentum) 和馬鈴薯 (solanum tuberosum) 中穩定發揮作用。在將葉片、切片和幼苗 (見圖 D6.6) 浸入 3 μmol dm−3 2-苄基熒光素溶液中僅僅幾秒鐘後,使用低光影片相機對強光發射進行成像;在該濃度下,底物無毒,沒有發現其他異常。[34]
熒光素酶成像能夠對複雜的基因啟用效應進行建模和觀察,並在活體動物中觀察。[19] 用於特定生物過程的發光報告器在細胞生物學中已被廣泛使用;在整個動物模型中,包括髮光的轉基因動物作為疾病模型,它們在藥物發現和開發中非常有用。完整器官的體內成像也有助於加深對生物過程的理解。將該技術應用於感染性疾病的活體動物模型,為疾病過程、治療效果和病原體可能逃避宿主防禦的新機制提供了見解。[35] 感染的進展和治療效果透過發光標記物進行評估,例如發光病原體。快速、便捷的高通量篩選體內對藥代動力學、毒理學和靶標驗證有效。時空模式的研究有助於表徵藥物的作用部位和時間。在基因治療和評估基因疫苗的遞送和有效性方面也可能存在臨床應用。
使用體內成像有幾個優點。在連續監測中,每隻動物都作為自己的對照,與在不同時間分析的一組動物進行比較相比,引入的變異性更小;此外,實驗中使用的動物更少。使用兩種或多種報告器在同一動物中,多重體內檢測也是可能的。化學發光成像透過生物發光與培養細胞計數 (例如,大腸桿菌) 的相關性得到驗證。這類研究增加了資料量,並可以指導隨後生化或組織學分析的組織取樣。
也有一些缺點。紅外線和紅外線 (590-800 nm) 光穿透組織良好,但藍綠光 (400-590 nm) 通常是生物發光發射的主要部分,衰減很強。然而,熒光素酶是最常用的報告基因,並且具有廣泛的發射,包括紅光。空間解析度 (3-5 mm) 比磁共振成像或計算機斷層掃描更差。
一些病理過程會自發地產生光。這是由於與氧化現象相關的弱自發光子發射,例如從活體動物中去除的整個器官中的氧自由基 (OFR) 形成(新增連結)。OFR 已在經歷過缺血(血液供應阻塞)和再灌注(血液供應恢復)的大鼠肝臟中成像,顯示了超氧陰離子在肝臟表面的空間和時間分佈,以及抗氧化劑對它們的影響,抗氧化劑可以去除 OFR 並可以透過此模型進行篩選。衰老、乙醇消耗和脂肪沉積對肝臟 OFR 形成的作用也已評估。該系統可用於監測器官移植的儲存情況,並測試儲存器官的藥物和程式。
- ↑ a b Roda A, Guardigli M, Pasini P, Mirasoli M, Michelini E, Musiani M, 生物和化學發光成像在分析化學中的應用,Anal. Chim. Acta,2005 年,541,25-36。
- ↑ Roda A, Pasini P, Baraldini M, Musiani M, Gentilomi G, Robert C, 使用光學顯微鏡-攝像機發光儀對酶標記探針進行化學發光成像,Anal. Biochem. 1998,257(1),53-62。
- ↑ a b Vykoukal D M, Stone G P, Gascoyne P R C, Alt E U 和 Vykoukal J, 使用低成本影像感測器陣列對整合微系統進行生物測定定量檢測,Angew. Chem. Int. Ed.,2009 年,48,7649-7654。
- ↑ Creton R, Kreiling J A, Jaffe L F, 鈣的化學發光成像,顯微鏡研究與技術,1999 年,46(6),390-397。
- ↑ S. Morel 和 L. Koechlin, DELTA 光子計數相機概念,Astron. Astrophys. Suppl. Ser.,1998 年,130,395-401。
- ↑ Roda A, Mirasoli M, Venturoli S, Cricca M, Bonvicini F, Baraldini M, Pasini P, Zerbini M, Musiani M, 用於同時多分析物檢測的微量滴定板格式,以及用於分型人乳頭瘤病毒 DNA 的 PCR-化學發光酶免疫測定法,Clin. Chem.,2002 年,48(10),1654-1660。
- ↑ Sun Z H, Fu X L, Zang L, Yang X L, Liu F Z, Hu G X, 用於平行分析多種腫瘤標誌物的蛋白質晶片系統及其在癌症檢測中的應用,抗癌研究,2004 年,24(2C),1159-1165。
- ↑ Feissner R, Xiang Y B, Kranz R G, 基於化學發光的檢測 C 型細胞色素亞皮摩爾水平的方法,Anal. Biochem.,2003 年,315(1),90-94。
- ↑ Huang G M, Ouyang J, Delanghe J R, Baeyens W R G, Dai Z X, 聚丙烯醯胺凝膠電泳後觸珠蛋白表型的化學發光影像檢測,Anal. Chem.,2004 年,76(11),2997-3004。
- ↑ Wang L, Zhang Z J, Huang L G, 基於化學發光成像的分子印跡聚合物用於丹磺醯苯丙氨酸的手性識別,Anal. Bioanal. Chem.,2008 年,390(5),1431-1436。
- ↑ Holthoff E L 和 Bright F V, 化學感測中的分子模板材料,Anal. Chim. Acta,2007 年,594,147-61。
- ↑ Wang L, Zhang Z J, 基於分子印跡聚合物作為識別材料的化學發光成像測定二嘧達莫,Sensors and Actuators B-Chemical,2008 年,133(1),40-45。
- ↑ a b Roda A, Pasini P, Musiani M, Girotti S, Baraldini M, Carrea G, Suozzi A, 使用基於攝像機的發光儀對宏觀和微觀樣品上生物特異性反應進行化學發光低光成像,Anal. Chem.,1996 年,68(7),1073-1080。
- ↑ Creton R, Jaffe L F, 化學發光顯微鏡作為生物醫學研究工具,Biotechniques,2001 年,31(5),1098。
- ↑ a b Baubet V, Le Mouellit H, Campbell A K, Lucas-Meunier E, Fossier P, 嵌合綠色熒光蛋白-水母素作為單細胞水平的生物發光 Ca2+ 報告基因,Proc. Natl. Acad. Sci.,2000 年,97(13),7260-7265。
- ↑ Solovyova N, Verkhratsky A, 神經元內質網中游離鈣的監測:現代方法概述,J. Neurosci. Meth.,2002 年,122(1),1-12。
- ↑ Mueller-Klieser W, Walenta S, 使用定量生物發光和單光子成像對生物組織中代謝物進行地理定位,Histochem. J.,1993 年,25(6),407-420。
- ↑ Levin M, Leppanen O, Evaldsson M, Wiklund O, Bondjers G, Bjornheden T , 繪製動脈壁內 ATP、葡萄糖、糖原和乳酸濃度,動脈粥樣硬化、血栓形成和血管生物學,2003 年,23(10),1801-1807。
- ↑ a b Greer LF, Szalay AA, 螢光素酶在活細胞和生物體中的表達,發光,2002 年,17(1),43-74。
- ↑ Walenta S, Schroeder T, Mueller-Klieser W, 使用生物發光進行代謝定位:基礎和臨床相關性,生物分子工程,2002 年,18(6),249-262。
- ↑ Pasini P, Musiani M, Ruso P, Valenti P, Aicardi G, Crabtree J E, Baraldini M, Roda A, 生物分析中的化學發光成像,J. Pharm. Biomed. Anal.,1998 年,18,555。
- ↑ Wiklund N P, Iversen H H, Leone A M, Cellek S, Brundin L, Gustafsson L E, Moncada S, 細胞培養和活組織中一氧化氮形成的視覺化,Acta Physiologica Scandinavica,1999 年,167(2),161-166。
- ↑ Lorimier P, Lamarcq L, Negoescu A, Robert C, LabatMoleur F, GrasChappuis F, Durrant I, Brambilla E, 在癌細胞系和人類宮頸上皮內瘤變中,比較 S-35 和化學發光用於 HPV 原位雜交,組織化學與細胞化學雜誌,1996 年,44(7),665-671。
- ↑ a b 參見參考文獻 1 中的圖 3 和 4。
- ↑ Bonvicini F, Mirasoli M , Gallinella G, Zerbini M, Musiani M, Roda A, 用於定量化學發光原位雜交成像細胞細小病毒 B19 複製動力學的基於 PNA 的探針,分析師,2007 年,132(6),519-523。
- ↑ Venturoli S, Ambretti S, Mirasoli M, Santini D, Zerbini M, Roda A, Musiani M , 化學發光定量免疫組化 p16INK4A 定位作為宮頸上皮內瘤變的標誌物,國際婦科病理學雜誌,2008 年,27(4),575-581。
- ↑ Mirasoli M, Guardigli M, Simoni P, Venturoli S, Ambretti S, Musiani M, Roda A, p16INK4A 和 HPV DNA 的多重化學發光顯微鏡成像作為宮頸腫瘤的生物標誌物,Anal. Bioanal. Chem.,2009 年,394,981-987。
- ↑ Ambretti S, Venturoli S, Mirasoli M, La Placa M, Bonvicini F, Cricca M, Zerbini M, Roda A, Musiani M, 使用熒光原位雜交和化學發光免疫組化相結合的方法評估惡性黑色素瘤中粘膜人乳頭瘤病毒的存在,英國皮膚病學雜誌,2007 年,156(1),38-44。
- ↑ Filanoski B, Rastogi SK, Cameron A, Cameron E, Mishra NN, Maki W, Maki G, 使用 CCD 相機和 CMOS 裝置進行非酶促水性過氧草酸酯化學發光免疫檢測,發光,2008 年,23(5),296-302。
- ↑ Filanoski B, Rastogi SK, Cameron E, Mishra NN, Maki W, Maki G, 用於生物分子檢測的新型均相生物發光共振能量轉移元件,使用 CCD 相機或 CMOS 裝置,發光,2008 年,23(1),22-27。
- ↑ Soling A, Rainov NG, 體內生物發光成像 - 應用於癌症研究,Expert Opin. Biol. Ther.,2003 年,3,1163。
- ↑ Wu J C, Chen I Y, Sundaresan G, Min J J, De A, Qiao J H, Fishbein M C, Gambhir S S, 使用光學生物發光和正電子發射斷層掃描對活體動物中的心臟細胞移植進行分子成像,迴圈,2003 年,108,1302。
- ↑ 參見參考文獻 1 中的圖 5。
- ↑ Mayerhofer R, Wang G, Hua D, Escher A, Illes K, Langridge W H R, Szalay A A, 視覺化不同螢光素酶對轉基因生物發出的光,在 Campbell A K, Kricka L J, Stanley P E(編輯)中,生物發光和化學發光:基礎和應用方面。第八屆生物發光和化學發光國際研討會論文集 1994 [奇切斯特,威利。1995 年],607-612。
- ↑ Doyle TC, Burns SM, Contag CH, 體內生物發光成像,用於感染的綜合研究,細胞微生物學,2004 年,6(4),303-317。
