生物化學/酶
酶是大分子,在大多數生物體的生化反應中充當有機催化劑,其功能對維持和維持生命活動至關重要。必須注意,活生物體中發生的某些化學轉化的反應速率極低,因此需要催化才能維持細胞發育和分裂的合理時間。大多數功能性酶是蛋白質,如胰蛋白酶、延胡索酸酶或木瓜蛋白酶。一小部分酶由 RNA 組成,被稱為核酶,例如錘頭核酶,負責在 RNA 分子的特定位點進行切割和連線,或原核生物 50S 核糖體亞基的 23S rRNA 的肽醯轉移酶活性。酶發揮作用的一般機制是降低開始反應所需的能量,也稱為活化能。產生某些酶的微生物或單獨提取和純化的酶具有極其廣泛的用途:乙醇生產(釀酒酵母、運動發酵單胞菌)、法醫學(限制性內切酶)和聚合酶鏈式反應等。酶的用途不僅僅是科學的。這些多樣的分子構成了釀造和製藥等行業的重要組成部分;僅在健力士啤酒釀造過程中使用酶就為愛爾蘭經濟帶來了超過十億歐元的價值。
模型酶是單體球狀蛋白質。大多數關於酶促反應性質的研究都是針對胰蛋白酶、糜蛋白酶或澱粉酶進行的。與所有蛋白質一樣,酶需要正確的摺疊才能正常工作,因此容易因變性而失活。酶活性的關鍵是稱為活性位點的結構。多肽鏈氨基酸殘基之間的相互作用導致它們形成具有定義的大小、形狀和序列的結構。活性位點和結構域的區別在於後者能夠識別(識別位點)和處理定義的分子。無論分子與識別位點之間的相互作用是空間的(基於形狀)、疏水的(糜蛋白酶)還是離子的(胰蛋白酶),它總是特異性和暫時的。抑制劑通常利用與活性位點的特異性共價結合,從而永久地使酶失活。
形成了關於活性位點的兩個理論。鎖鑰理論認為活性位點和底物的大小和形狀相匹配——底物是鑰匙,活性位點是鎖。完美匹配的分子結合會誘導酶的構象變化,從而導致催化。第二種誘導契合理論認為活性位點和底物具有不同的、不匹配的結構。當底物遇到活性位點時,它會誘導活性位點假設某種構象,無論是透過去除結構水分子,還是使氨基酸殘基之間的相互作用產生應力。
酶發揮作用的機制是降低特定酶催化的反應的活化能。每種酶都完全特定於反應物;它只對一個特定的反應起作用,這是由於每種酶都有獨特的活性位點。酶的活性位點具有獨特的 3D 形狀,以及獨特的靜電荷和疏水性模式。在這裡,特定的底物——酶作用的物質——會暫時與酶結合,形成酶底物複合物,或 ESC。然後反應發生,反應產物與酶分離,此時產物可以被利用。然後酶能夠重複該反應數千次,儘管可能需要每隔一段時間更換一次。
酶的活性細胞中酶活性的控制可以透過改變細胞的內部環境來增強或減少酶的產生。這被稱為酶誘導和抑制。酶抑制劑或酶誘導劑將與酶結合,並降低或提高酶的活性。抑制劑阻止底物進入活性位點。它可以是可逆的或不可逆的。酶活性是分隔的;這意味著一種酶活性的降低會降低另一種酶的生產力,因為它們是相關的。一些酶會被體內的環境因素啟用,例如人體 pH 值的降低會改變流感病毒血凝素的活性。因此,反應的潛在能量勢壘越低,具有足夠能量的反應物就越多,因此反應發生的速率就越快。所有催化劑,包括酶,都透過與反應物形成過渡態來發揮作用,其自由能低於未催化反應中發現的自由能。
酶圖
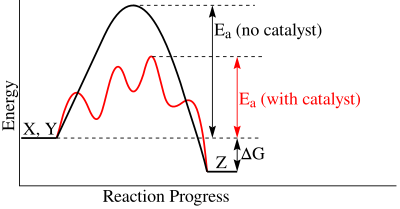
酶不會改變反應的平衡。酶只會催化或加速反應速率,透過穩定過渡態,並且不參與化學反應。過渡態是反應座標上最高的活化能 (Ea),其中分子僅部分反應。使用催化劑(酶)時,活化能會降低。當不使用酶時,反應的活化能要高得多,這將導致反應進行的時間長得多。為了有效地促進反應,酶與過渡態互補,而不是與底物互補。催化劑存在於反應物中,也出現在最終產物中。
1. 酶對熱敏感,會被過量的熱量變性(或被過量的冷量失活),即它們的活性位點會永久變形,因此酶無法形成酶底物複合物。這就是你煎雞蛋時發生的事情,蛋清(蛋白,一種蛋白質,不是酶)會被變性。2. 酶在細胞中產生,但能夠在細胞外發揮作用。這使得酶能夠被固定化,而不會殺死它們。3. 酶對 pH 值敏感,它們進行反應的速率取決於反應發生位置的 pH 值,例如胃中的胃蛋白酶的最適 pH 值約為 pH2。而唾液澱粉酶的最適 pH 值約為 7。4. 酶是可重複使用的,一些酶每秒能夠催化數十萬次反應,例如過氧化氫酶作用於過氧化氫。5. 酶只催化一個反應,例如轉化酶只在葡萄糖溶液透過酶珠時產生葡萄糖和果糖(見固定化)。6. 酶的反應速率受其飽和點的限制。飽和本質上是指酶無法再加快反應速度以補償底物濃度增加(將平衡推向產物)的點。在圖形上,這表現為水平漸近線,也稱為最大速度。每種酶對給定底物都有自己的最大速度。透過測量不同底物濃度下產物形成的速率,可以確定酶的最大速度的一種方法。7. 酶能夠反向工作,這作為產物生成量的截止點。如果反應物過量,反應將繼續進行併發生逆轉,因此不會發生產物過載或積聚。酶是分解物質的催化劑,透過短暫地與物質結合。過氧化氫,它們將其分解成水和氧氣的速度比自然發生的速度快得多。在體內,它們被用來分解食物並啟動消化過程。它們是蛋白質,受物質的 pH 值和溫度的影響。最後需要注意的是,酶的濃度顯然會影響其工作效率。它們是底物特異性的,這由鎖鑰假說說明。
酶可以透過兩種方式固定化,首先是將它們化學結合到某種剛性結構上,其次是將酶物理放置在不溶性支撐結構上,例如凝膠或珠子。第二種酶固定化方法更為常見,成本更低,但確實會降低酶催化反應的能力。
酶固定化的步驟
1. 配製 5% w/v 的海藻酸鈉溶液,並靜置過夜,以充分混合。
2. 將酶,或在這種情況下,細胞(例如酵母)新增到海藻酸鈉溶液中,並充分混合。此時混合物會變得非常濃稠,應靜置 20 分鐘以消除溶液中的氣泡;此類氣泡會增加珠子的表面積,使其效率降低。
3. 取一支注射器,並用海藻酸鈉/細胞基質填充它。
4. 配製 2% w/v 的氯化鈣溶液。
5. 將注射器垂直於氯化鈣溶液上方約 20 釐米處,並將海藻酸鈉溶液滴入其中,嘗試製作儘可能小的珠子,直徑約 3-4 毫米。
6. 從氯化鈣溶液中取出並丟棄任何海藻酸鈉細絲或漂浮的珠子。
7. 用去離子水沖洗珠子。
8. 使用支架在彼此上方設定兩個分液漏斗,將珠子放入底部漏斗,並將濃葡萄糖放入頂部。
9. 讓葡萄糖流過珠子,並抽出產物。
產物是一種酒精,不應攝入,因為無法確定它是乙醇還是甲醇,後者是有毒的。
直到最近,酶的命名都是任意的,例如,唾液澱粉酶(澱粉酶),這並不能告訴我們酶作用於什麼,相反,生物學家設計了一種酶命名方法,其中酶以“-ase”結尾;例如 DNA 解旋酶,它們還包含了關於酶作用於什麼的線索;DNA 解旋酶的作用是分離 DNA 鏈中的核苷酸。其他常見的酶包括蛋白酶、脂肪酶、胃蛋白酶、澱粉酶和溶菌酶。
Berg, Jeremy M. 生物化學 第6版。紐約,W. H. Freeman and Company,2007。