生物醫學工程理論與實踐/神經工程
另請參見 維基百科,神經工程.
神經工程是生物醫學工程的一個學科,它利用工程技術來理解、修復、替代或增強神經系統。
神經工程是一個高度跨學科的領域,融合了神經科學、電子工程、臨床神經學、材料科學、奈米技術、計算機工程等等。該領域的主要目標是更好地理解和模擬神經系統的功能和功能障礙,並設計出適當的增強和/或替代神經系統功能障礙的部分。
神經工程將廣泛的工程和基礎科學原理與廣泛的生物學和醫學科學結合在一起。它將基礎和應用工程與科學研發與基礎和應用神經科學聯絡起來。
古埃及人和羅馬人使用電(以電魚的形式)用於治療目的。在 1790 年代,義大利醫生路易吉·伽伐尼在用靜電機的火花使青蛙肌肉抽搐時,證明了神經衝動的電氣基礎。[1]:67–71 科學界同行普遍接受了伽伐尼的觀點;但亞歷山德羅·伏特證明了電不是來自動物組織,而是來自金屬(黃銅和鐵)在潮溼環境中的接觸。另一方面,在另一個實驗中,伽伐尼透過用一隻青蛙的神經觸碰另一隻青蛙的暴露肌肉來引起肌肉收縮。他首次證明了生物電存在於活組織中。吉約姆·杜申(1806 年 9 月 17 日,法國布洛涅-比揚庫爾 - 1875 年 9 月 15 日,法國巴黎)恢復了伽伐尼的研究。他是第一個描述幾種神經和肌肉疾病的人,並且在推進治療這些疾病的方法方面,創造了電診斷和電療法。
在 20 世紀中葉,電記錄作為觀察神經元功能的視窗變得流行起來

質膜內外不同電荷分佈產生膜電位(也稱為跨膜電位或膜電壓)。建立和維持靜息膜電位的兩種力量是被動(透過通道擴散)和主動(鈉鉀泵)[2]。相對於神經元膜的胞質側,靜息電位的典型值範圍為-70 到 -80 毫伏。與肌肉一樣,神經元利用膜電位變化作為通訊訊號來接收、整合和傳送資訊。膜電位的差異可以由離子的滲透性和膜兩側的離子濃度產生。離子通道的開放和關閉可以引起靜息電位的偏離。如果內部電壓變得更負(例如,從 -70 毫伏到 -80 毫伏),則稱為超極化;如果內部電壓變得不太負(例如,從 -70 毫伏到 -60 毫伏),則稱為去極化。在可興奮細胞中,明顯大的去極化會導致動作電位(長距離訊號)。但是,離子濃度通常不會快速變化。因此,梯度電位是由神經元膜的被動電學特性造成的。
可興奮膜之間存在細胞間通訊。它們不會隨著距離的增加而減弱,被稱為“神經衝動”或“尖峰”。神經元產生的動作電位的時序稱為其“尖峰序列”。刺激透過開啟位於軸突上的特定電壓調節門控通道來改變神經元膜的滲透性。軸突只能產生動作電位。
動作電位的產生(由去極化引起)遵循三個連續的變化
1. 鈉離子通透性增加,膜電位相反。
2. 鈉離子通透性降低。
3. 鉀離子通透性增加,發生復極化。
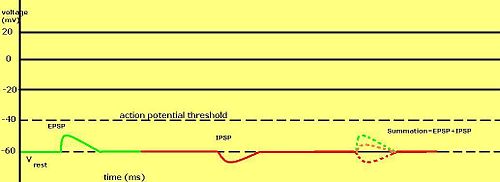
神經元樹突中的電壓脈衝具有不同的強度。神經元樹突的刺激(由另一個神經元或作為特殊受體)會產生梯度電位。刺激可以透過多種方式發生,例如化學刺激(神經遞質等)、機械刺激(某些疼痛感受器、毛髮感受器等)、光刺激(光感受器)以及其他一些方式。無論如何,這些刺激都會帶來相同的結果。樹突上的某些受體蛋白離子通道被啟用並開啟。這會導致離子的流入(或流出)。根據進入(或離開)的離子,它會導致去極化(變得不那麼負面,-70 到 -60mV,一種可能導致動作電位的興奮性反應)或超極化(變得更負面,-70 到 -80mV,一種抑制性反應,使動作電位更難發生)。受體蛋白離子通道被刺激得越多,訊號就越強或越強烈。對受體蛋白離子通道的輕微刺激通常會開啟通道並接受離子。
然而,要使軸突起始段發生達到閾值的去極化,通常需要開啟多個去極化受體蛋白離子通道。因此,梯度電位會累積。離子通道的總極化效應會加在一起。一個通道不能刺激動作電位,需要多個通道協同工作才能使膜去極化到足以引起動作電位的程度。梯度電位(或受體電位)是膜區域的短壽命去極化或超極化。這些變化會導致區域性電流流動,這些電流流動會隨著距離的增加而減弱。
梯度電位與刺激強度成正比,是刺激強度或強度的直接反映。刺激越強烈,開啟的離子通道越多,電壓變化(超極化或去極化)就越大,電流傳播的距離就越遠。
當離子湧入時會發生刺激極化。這些離子會聚集在受刺激區域附近。從那裡,過量的離子會向各個方向輻射出去,極化相鄰的膜。當這種極化像波浪一樣傳播時,它會在其身後留下一個曾經極化的膜的尾跡,該膜非常快地恢復到靜息膜電位。
就像我們家裡的電氣系統中的電線一樣,神經細胞以稱為神經通路的形式相互連線。與我們家裡的電線不同,神經細胞不會接觸,而是在突觸處彼此靠近。在突觸處,兩個神經細胞被突觸間隙隔開。傳送神經元稱為突觸前細胞,而接收神經元稱為突觸後細胞。神經細胞透過突觸從突觸前細胞傳遞到突觸後細胞,以神經遞質的形式傳送化學資訊,並且是單向的。
使用神經遞質的突觸傳遞過程如下
- 神經遞質的合成和儲存
- 神經遞質釋放
- 神經遞質突觸後受體
- 神經遞質失活
在神經元中合成的神經遞質分為兩大類:**小分子神經遞質**和**神經肽**。**小分子神經遞質**在軸突末梢內合成(例如乙醯膽鹼 (ACh))。這些分子合成所需的一些前體被選擇性轉運蛋白攝取到末梢膜上。其他是神經元內細胞過程的副產品,因此很容易獲得。**神經肽**在大小和合成方式上都不同於小分子神經遞質。神經肽的長度通常在 3 到 36 個氨基酸之間。因此,它們比小分子神經遞質更大。由於它們需要簡單的酶促反應,因此小神經遞質在軸突末梢內產生,而神經肽在細胞體中產生,因為它們的合成需要肽鍵形成。神經肽的合成類似於細胞內任何分泌蛋白的過程。首先,在細胞核內,發生特定肽編碼序列的 DNA 基因轉錄,它用作模板構建相應的信使 RNA 鏈。mRNA 然後移動到核糖體,在那裡開始翻譯過程。在翻譯過程中,mRNA 的序列充當程式碼,將相應的氨基酸序列串在一起,這些氨基酸序列將成為末梢處所需的神經肽。在該分子可以被運輸到末梢並釋放到突觸間隙之前,它必須在內質網 (ER) 中進行加工,在高爾基體中進行包裝,並在儲存囊泡中沿軸突運輸到末梢。
一旦合成,小分子和神經肽類神經遞質都儲存在軸突末梢內的囊泡中,直到動作電位到達並釋放它們。大多數小分子神經遞質儲存在直徑為 40~60 奈米的微小囊泡中。儲存神經肽的囊泡更大,直徑在 90 到 250 奈米之間。
含有神經遞質的囊泡儲存在神經元的末梢,在**活性區**或活性區附近。這些囊泡透過對肌動蛋白絲、微管和細胞骨架的各種成分進行結合的 Ca2+敏感囊泡膜蛋白固定在適當位置。當動作電位到達突觸前神經元的末梢時,突觸前膜中的電壓依賴性鈣 (Ca2+) 通道開啟,Ca2+ 湧入。這種鈣離子流入會觸發一系列事件,最終將神經遞質從儲存囊泡中釋放到突觸間隙。
釋放到突觸間隙後,神經遞質會與突觸後細胞膜上的受體蛋白進行交流,導致膜上的離子通道開啟或關閉。當這些通道開啟時,會發生去極化,涉及另一個動作電位的啟動。識別神經遞質的突觸後受體有兩種型別:稱為配體門控離子通道的離子型受體和稱為 G 蛋白偶聯受體的代謝型受體。
在突觸後受體識別神經遞質分子後,它會被釋放回突觸間隙。一旦進入突觸,它必須被化學失活或快速去除,以避免對突觸後細胞的持續刺激和動作電位的過度放電。
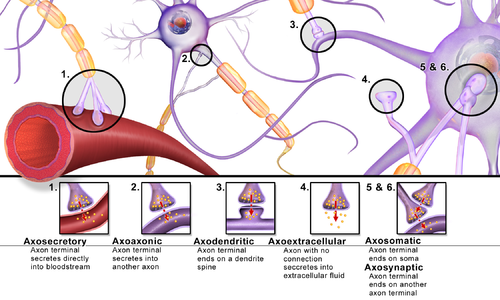
-
乙醯膽鹼代謝
-
兒茶酚胺和痕量胺生物合成
-
GABA 能突觸
神經遞質是大腦化學物質,在整個大腦和身體中傳遞資訊。神經元之間資訊的傳遞是透過神經遞質跨越稱為突觸的小間隙運動來實現的。神經遞質從突觸前神經末梢的一個神經元釋放。神經遞質劑包括激動劑、拮抗劑、降解抑制劑、攝取抑制劑、消耗劑、前體以及受體功能的調節劑[3]。神經遞質可分為氨基酸、肽類和單胺類。
- 小分子神經遞質物質:乙醯膽鹼 (ACh)、多巴胺 (DA)、去甲腎上腺素 (NE)、血清素 (5-HT)、組胺、腎上腺素、氨基酸、γ-氨基丁酸 (GABA)、甘氨酸、穀氨酸、天冬氨酸
- 神經活性肽(部分列表):緩激肽、β-內啡肽、腦啡肽、降鈣素、膽囊收縮素、腦啡肽、強啡肽、胰島素、胃泌素、P物質、神經降壓素、胰高血糖素、促胰液素、生長抑素、胃動素、加壓素、催產素、催乳素、促甲狀腺激素、血管緊張素 II
- 睡眠肽:加拉寧、促甲狀腺激素釋放激素、促性腺激素釋放激素、生長激素釋放激素、促黃體生成素、血管活性腸肽
- 可溶性氣體:一氧化氮 (NO)、一氧化碳
表: 選定的神經遞質及其功能
工作原理
[edit | edit source]神經調節和神經增強
[edit | edit source]神經調節被國際神經調節學會定義為“透過向身體的目標部位傳遞電刺激或化學物質來改變神經活動”。它是為了使神經功能正常化或調節而進行的。神經調節是神經系統中多種神經遞質控制各種神經元群體(一個神經元使用不同的神經遞質連線到多個神經元)的過程。神經調節可能涉及電磁刺激,例如強磁場重複經顱磁刺激、非常小的電流或可能是光遺傳學。[4]神經調節使用醫療裝置技術來增強或抑制神經系統的活動,以治療疾病。這些技術包含可植入的和不可植入的裝置,這些裝置傳遞電氣、化學或其他物質,以可逆地改變大腦和神經細胞的活動。[4]
神經肌肉電刺激 (NMES)
[edit | edit source]神經肌肉電刺激可以廣泛地分為功能性或治療性。治療性神經肌肉刺激是指使用刺激癱瘓的肌肉來最大程度地減少特定的損害,如運動無力、痙攣、活動範圍受限和心血管衰竭。功能性神經肌肉刺激 (FNS)是指使用刺激以精確的順序啟用癱瘓的肌肉,以幫助完成日常生活活動 (ADL) 或為關節提供穩定性,以維持原始的生物力學特性和功能。提供 FNS 的裝置或系統被稱為神經假體。[5]
神經再生
[edit | edit source]
神經再生是指神經組織、細胞或細胞產物的再生或修復[6]。再生過程中發生的步驟可以分為以下主要事件:瓦勒氏變性、軸突再生/生長和神經再支配[7]。從其他角度看,神經再生包含神經發生、神經可塑性和神經修復——將活細胞作為治療方法進行移植[8]。考慮到範圍和速度,周圍神經系統 (PNS) 和中樞神經系統 (CNS) 的神經再生機制非常不同。
周圍神經系統再生
[edit | edit source]周圍神經損傷根據對神經和周圍結締組織的損傷程度在 Seddon 分類中進行分類[9]。神經損傷的最低程度,即暫時中斷傳導,而沒有軸突連續性損失,稱為神經傳導阻滯[10]。第二種程度稱為軸突斷裂,與軸突及其髓鞘覆蓋層的相對連續性喪失有關,但它保留了神經的結締組織框架(包囊組織、外鞘和內鞘得到保留)。[11]。最後一種程度稱為神經斷裂,是整個神經纖維的完全斷裂或破壞[12]。
與中樞神經系統不同,周圍神經系統可以再生[13]。瓦勒氏變性發生在神經再生之前。在瓦勒氏變性期間,雪旺細胞和巨噬細胞相互作用以從遠端損傷部位去除髓鞘和受損的軸突。當無神經支配的雪旺細胞增殖並且剩餘的結締組織基底膜形成內鞘管時,形成班氏帶。班氏帶對於引導再生軸突很重要[14]。
在神經元胞體處,發生色溶現象,其中細胞核移動到胞體的周邊,內質網破裂並分散。神經損傷改變了細胞的代謝功能。該細胞試圖產生用於生長和修復的分子,而不是產生用於突觸傳遞的分子。這些因素包括 GAP-43、微管蛋白和肌動蛋白。當細胞準備好進行軸突再生時,色溶現象會逆轉[15]。
軸突再生以生長錐的形成為特徵[16]。生長錐位於稱為軸突和樹突的結構上的神經細胞的最尖端。它們包括肌動蛋白絲 (F-肌動蛋白) 的束,這些絲為它們提供了形狀和支撐。生長錐與雪旺細胞產生的分子(如層粘連蛋白和纖連蛋白)相互作用[14]。
與周圍神經系統再生不同,中樞神經系統再生不會伴隨廣泛的再生。它受到神經膠質細胞和細胞外環境的抑制性影響的限制。中樞神經系統 (CNS) 的再生是可能的,新的神經元,由內源性幹/祖細胞增殖或外源性幹/祖細胞(具有替代丟失組織的潛力)的給藥下生成,將分化、存活並整合到現有的神經網路中,以及軸突再生[17]。由於一些研究報道了成人神經幹細胞的存在[18][19][20],基於神經組織工程的神經可塑性和神經幹細胞的概念導致了神經修復作為 CNS 神經退行性疾病替代療法的想法[17] [21] 。
神經影像包含各種技術,可以直接或間接成像神經系統的結構、功能/藥理學。它是醫學、神經科學和心理學中一個相對較新的領域[22]。專門從事臨床環境中神經影像的執行和解釋的醫生是神經放射科醫生。
神經影像分為兩類
- 結構影像,涉及神經系統的結構和對大體積 (大尺度)顱內疾病(如腫瘤)和損傷的診斷。
- 功能影像用於診斷更精細尺度 (例如阿爾茨海默病) 的代謝性疾病和病變,以及用於神經學和認知心理學研究以及構建腦機介面。
另請參閱 人工神經網路
神經網路(人工神經網路:ANN)是一種資訊處理正規化,其靈感來自動物中樞神經系統(如大腦)處理資訊的方式。這種正規化的關鍵要素是資訊處理系統的獨特結構。它由大量高度互連的神經元組成,這些神經元可以計算輸入值。第一個人工神經元是由神經生理學家沃倫·麥卡洛克和邏輯學家沃爾特·皮茨於 1943 年開發的[23]。許多重要的研究得到了廉價的計算機模擬的推動。在馬文·明斯基和西摩爾·派珀特發表機器學習研究之後,神經網路研究放緩[24] (1969)。他們發現了處理神經網路的計算機器的兩個關鍵問題。第一個問題是單層神經網路無法處理異或電路。第二個問題是計算機不夠複雜,無法有效地處理大型神經網路所需的長時間執行。直到計算機擁有更大的處理能力,神經網路研究才有所放緩。另一個關鍵的後期進展是反向傳播演算法,它有效地解決了異或問題 (Werbos 1975)[25]。

人工神經元是一個數學函式,作為生物神經元的模型。人工神經元是人工神經網路中的組成單元。對於給定的人工神經元,假設有m + 1 個輸入,具有訊號x0 到xm 和權重w0 到wm。通常,x0 輸入將是值 +1,這使其成為wk0 = bk 的偏差輸入。這僅留下了m 個實際輸入到神經元:從x1 到xm。
kth 神經元的輸出是
其中 (phi) 是傳遞函式[26]。輸出類似於生物神經元的軸突,其值透過突觸傳播到下一層的輸入。它也可以作為輸出向量的一部分退出系統。其傳遞函式權重是計算出來的,閾值是預先確定的。侷限性在於簡單的類神經網路,例如 McCulloch-Pitts 模型,有時被表達為“卡通模型”,因為它們試圖反映一個或多個神經生理學觀察結果,但不考慮真實性。 [27]
神經介面
[edit | edit source]神經介面系統透過刺激或記錄神經組織,在神經系統和外部世界之間提供直接的通訊途徑,以幫助患有感覺、運動或其他神經功能障礙的人。這些研究被稱為實驗神經科學的一個新分支,被稱為腦機介面 (BMI)、腦機介面 (BCI)、神經假體或神經介面系統 (NIS)。每個裝置中的電子封裝啟用一組微小的電極,這些電極與身體中的健康神經元接觸。電極發出的訊號繞過大腦或神經系統受損的區域,以恢復功能、阻斷疼痛或預防癲癇發作。儘管電刺激系統已廣泛用於臨床應用,但記錄和破譯神經訊號的神經接口才剛剛開始用於臨床系統,以幫助有殘疾的人。成功的 神經介面示例包括人工耳蝸[28][29],它為重度聽力障礙的人提供聲音感,以及深部腦刺激器 (DBS) [30],它有助於預防癲癇患者和帕金森病患者的癲癇發作。
自 1990 年代後期以來,神經介面研究在使用神經元尖峰的閉環控制的基礎上取得了顯著發展。Chapin 及其同事展示了一隻大鼠透過從感覺運動皮層的多電極記錄控制一維進食器的能力[31]。此後,大量研究(Carmena 等人,2003 [32]、Musallam 等人,2004 [33]、Santhanam 等人,2006 [34]、Taylor 等人,2002 [35] 等)證明了靈長類動物的閉環控制是可行的。常見的閉環神經介面系統由四個部分組成:(1)提取神經訊號的記錄陣列,(2)將這些神經訊號轉換為一組命令訊號的解碼演算法,(3)由這些命令訊號控制的輸出裝置,以及(4)以視覺和潛在的其他感覺方式進行的感覺反饋。
神經植入物必須設計得儘可能小,以便在靠近大腦、眼睛或耳蝸的特定區域進行微創手術。這些植入物透過無線方式與其假體對應物通訊。此外,目前透過皮膚的無線能量傳輸來接收能量。通常,植入物附近的組織對溫度升高非常敏感。這意味著功耗必須最小,以避免組織損傷。 [36]

輸入電極
[edit | edit source]

顱內電極由植入在聚合物或矽上的導電電極陣列組成,或者由一根帶有一個暴露的尖端和絕緣層的導線電極組成,該絕緣層用於不需要刺激或記錄的部分。
目前的可植入微電極無法根據慢性尺度記錄單單元或多單元活動。Lebedev 和 Nicolelis 回顧了該領域真正改進技術以達到臨床實施水平的具體需求。簡而言之,他們評論中的 4 個要求是
硬體
[edit | edit source]晶片已在晶片上整合了不同程度的資料壓縮[39],包括尖峰排序(Chae 等人,2009 年)。雖然許多系統功耗過高,無法從電池植入物供電,但 Sarpeshkar 等人已經制造了放大器和模數轉換器,其功耗低於每 20 ksps 通道 9 uW[40]。雖然可用積體電路的小面積和低功耗足以處理大部分神經資料通道,但仍需解決一些問題。例如,植入物可以在體內停留多長時間?塗有 6 um 聚醯亞胺 C 的電子裝置已被證明可以工作長達 276 天[41]。Plexon、Tucker Davis、NeuroLynx 等商業系統依賴於密封在焊接鈦外殼中的密封式饋通聯結器,電子裝置位於其中。但是,使用數百個電極和高密度微型密封式饋通的腦機介面尚不存在。
解碼器流程
[edit | edit source]效能評估
[edit | edit source]神經機器人學
[edit | edit source]神經機器人學是神經科學與機器人學的一部分,涉及對像大腦啟發演算法這樣的具身自主神經系統科學和技術的學習和應用。神經機器人學從“大腦是具身的,身體是嵌入環境中的”這一理念出發。模擬環境可能會對模型產生無意的偏差。此外,真實環境是不可預測的、多模式的和嘈雜的;這種環境的人工設計很難模擬。因此,大多數神經機器人需要與現實世界互動,而不是模擬環境。 [42]

存在許多類別的神經生物學啟發機器人裝置。三種常見的神經機器人用於研究運動控制、記憶和動作選擇。
- 運動控制和運動
- 學習和記憶系統
- 價值系統和動作選擇
運動控制和運動
[edit | edit source]神經機器人已被證明對研究動物運動和運動控制以及開發機器人控制器非常有效。機器人的運動控制是根據運動系統作用機制的一系列神經啟發理論設計的。中樞模式發生器的神經模型,即能夠驅動重複行為的運動神經元簇,已被用於脊椎動物腿式運動,例如四足行走機器人 [43] [44]。另一種運動控制方法是使用預測控制器將笨拙、容易出錯的運動轉化為平滑、準確的運動。利用這些想法,設計的機器人可以避開障礙物 [45][46],產生準確的視覺 [47] 以及生成自適應手臂運動 [48][49][50]。
學習和記憶系統
[edit | edit source]設計用於測試動物記憶系統理論的機器人。目前,許多研究都集中在大鼠的記憶系統,即海馬體,研究定位細胞,這些細胞在特定已學習的空間位置會特異性地放電。 [51][52]
價值系統和動作選擇
[edit | edit source]動作選擇研究涉及對動作及其結果的負面或正面反饋。大腦中此類研究的例子包括多巴胺能、膽鹼能和去甲腎上腺素能系統,這些系統中的神經遞質,如多巴胺或乙醯膽鹼,會對有益的神經訊號進行正向強化。 [53][54][55]。一項關於這種相互作用的研究涉及達爾文 VII 機器人,它使用視覺、聽覺和模擬味覺輸入來“食用”導電金屬塊。隨機選擇的好的金屬塊上有條紋圖案,而壞的金屬塊上有圓形圖案。味覺感是透過金屬塊的導電性模擬的。Doya 的團隊一直在研究“賽博老鼠”中多種神經調節劑的影響,例如在環境中自主移動的兩輪機器人。 [56]。這些機器人可以為了自我保護和自我複製而移動,例如搜尋地板上的電池組併為其充電,然後透過其紅外通訊埠將此資訊傳達給其他機器人。包括研究多巴胺等神經調節劑如何影響決策,神經機器人學家一直在研究基底神經節作為調解動作選擇的模型。 [57]。Prescott 及其同事在一個機器人中嵌入了一個基底神經節模型,該機器人必須從依賴於環境的幾個動作中進行選擇。
神經組織再生
[edit | edit source]外周神經系統的手術連線
[edit | edit source]在外周神經系統中,如果損傷較小,神經可以自行再生。然而,對於像近端和遠端神經末端之間的小間隙,可以透過手術重新連線斷裂的神經,將神經的兩端縫合在一起。縫合神經時,神經的每個束都會重新連線,將神經連線起來。這種方法不適用於較長距離的間隙,因為神經末端需要保持張力。這種張力會阻斷神經再生。 [58]
外周神經系統的組織移植
[edit | edit source]組織移植使用神經或其他材料來橋接斷裂神經的兩端。組織移植分為自體組織移植、異體組織移植和無細胞移植。自體組織移植是指將同一身體的不同部位的組織轉移到另一個部位。 [59]。這些自體神經移植是目前外周神經移植的標準,因為它具有高度的生物相容性,但也存在一些問題,例如從患者身上獲取神經以及為將來使用而儲存大量自體移植。異體組織移植和無細胞移植(含有基於 ECM 的材料)是指不來自患者的組織,而是可以從屍體或動物身上獲取。由於它們不來自患者,因此很容易獲得,但這些組織在潛在的疾病傳播方面存在一些困難。目前,正在研究提高異體組織移植功效的方法。 [58]
神經引導通道
[edit | edit source]
與自體移植相比,神經引導導管是一種人工引導軸突再生以幫助神經再生的方法,是神經損傷的臨床治療方法之一。由於供體組織的有限性和自體移植中的功能恢復,神經組織工程研究已將重點放在生物人工神經引導導管上,作為替代療法。類似的技術也正在研究用於脊髓神經修復,但中樞神經系統的神經再生會面臨挑戰,因為其軸突在其原生環境中不會再生。 [60] 引導方法可以減少神經的瘢痕形成,從而提高神經在重新連線後傳遞動作電位的功能。在這種方法中,使用了兩種型別的材料:天然材料和合成材料。
生物材料通常具有良好的生物相容性,並且可以很容易地降解,因為它來自自然界。然而,不幸的是,它在控制機械效能和降解速率方面存在侷限性。此外,天然材料始終有可能引起免疫反應或含有微生物。 [61]。在天然材料的生產過程中,大規模純化過程會產生意想不到的結果。 [62] 困擾天然聚合物的一些其他問題是,由於可能發生塌陷、瘢痕形成和早期重新吸收,它們無法支撐跨越長病變間隙的生長。 [62] 具有促進神經修復潛力的生物材料包括聚唾液酸(PSA)、膠原蛋白、蜘蛛絲纖維、蠶絲絲素蛋白、殼聚糖、文石、海藻酸鹽、透明質酸、糖胺聚糖、層粘連蛋白、殼聚糖等。
合成材料也為組織再生提供另一種方法。合成聚合物可能是不可降解的或可降解的。但是,對於神經組織工程,更傾向於使用可降解材料,因為長期影響(如炎症和瘢痕)會損害神經功能。可以根據目的控制聚合物的機械效能和降解速率,並且消除了對免疫原性的擔憂。 [61] 目前,許多不同的合成材料正在神經組織工程中使用。但是,問題在於這些材料缺乏生物相容性和生物活性。這意味著這些聚合物並不完美,不能促進細胞附著、增殖和分化。 [63] 目前,研究最常用的材料主要集中在可生物降解的聚酯上,例如聚乳酸、聚乙醇酸、聚己內酯、聚乙二醇(FDA 批准)的共聚物或共混物,可生物降解的聚氨酯、其他聚合物以及可生物降解的玻璃也在研究中。合成材料的其他潛力包括導電聚合物和生物修飾聚合物,以促進細胞軸突生長並維持軸突通道。 [58]


可以在體外人工建立組織,然後將其移植到損傷部位。這種方法可以治療具有較大空腔的損傷,這些損傷需要大量的神經組織進行替換和再生。神經組織可以在體外用神經幹細胞或祖細胞在 3D 支架中生長,形成胚狀體 (EBs)。這些 EBs 由幹細胞球體組成,其中內部細胞是未分化的神經細胞,周圍細胞則分化程度更高。3D 支架用於將組織移植到損傷部位並構建人工組織和腦組織之間的合適介面。支架應該是可生物降解的並且具有生物相容性。它需要適合損傷部位,靠近現有組織並支援生長中的細胞和組織。結合使用幹細胞和支架可以提高幹細胞在損傷部位的存活率,從而提高治療的有效性。[64]
表。支架的製備
| 支架的製備 | 特性 |
|---|---|
| CAD/CAM 技術 | 示例 |
| 靜電紡絲 | 示例 |
| 乳化/冷凍乾燥 | 示例 |
| 氣體發泡 | 示例 |
| 奈米纖維自組裝 | 示例 |
| 紡織技術 | 示例 |
| 熱誘導相分離 (TIPS) | 示例 |
| 奈米纖維自組裝 | 示例 |

增強神經組織再生的分子,包括藥物、稱為形態發生的生長因子和 miRNA,也可以直接注射到受損的 CNS 組織的損傷部位。腦部藥物遞送策略可以廣泛地分為侵入性(基於神經外科)、藥理學或生理學。基於神經外科的策略包括腦室內藥物輸注、腦內植入物和 BBB 破壞。基於藥理學的策略包括使用微球、奈米球等顆粒,這些顆粒可以透過乳化、噴霧乾燥、分散等方法制備。 [65][66]

神經增強或人類增強可用於治療疾病和殘疾,也可用於增強人類特徵和能力。[68] 在某些圈子裡,"人類增強技術"與新興技術或融合技術或超人類主義同義。[69] 從其他觀點來看,"人類增強"與人類基因工程大致同義,[70][71] 它通常是指將奈米技術、生物技術、資訊科技和認知科學 (NBIC) 相結合以改善人類生活的普遍應用。[69] 深部腦刺激已被證明可以為目前使用這種療法治療帕金森病、原發性震顫、肌張力障礙、慢性疼痛、重度抑鬱症和強迫症的患者提供治療益處。[72] 人類增強帶來的倫理問題是神經工程師在開發技術時需要解決的問題。一些有爭議的想法是,人類增強可以維持或修改他們自己的思想和身體。[73] 此外,人們擔心,一些增強會為那些能夠並願意使用它們的人創造不公平的身體或精神優勢,並會加劇"有"和"無"之間的差距。 [74][75][76][77] 但是,一些支持者提倡"人類增強技術",並更喜歡用"賦能"來代替"增強"。[78] 他們試圖為這些技術的獨立安全測試辯護和發展,併為這些技術提供負擔得起、普遍的獲取途徑。[79]

深部腦刺激 (DBS) 是一種神經外科手術,它將一種稱為腦起搏器的微型醫療器械植入體內,該器械透過植入的電極向大腦特定區域傳送電脈衝,用於治療運動障礙和情感障礙。美國食品藥品監督管理局 (FDA) 於 2002 年批准 DBS 作為治療帕金森病的療法,[80] 2003 年批准治療肌張力障礙,[81] 2009 年批准治療強迫症 (OCD)。[82] DBS 也被用於治療各種情感障礙,包括重度抑鬱症,但這些 DBS 應用尚未獲得 FDA 批准。
深部腦刺激系統由三個部分組成:植入式脈衝發生器 (IPG)、導線和延長線。IPG 是一種由電池供電的神經刺激器,封裝在鈦外殼內,它向大腦傳送電脈衝以干擾目標部位的神經活動。導線 是一種盤繞的金屬線,由聚氨酯等生物相容性但不可降解的聚合物絕緣,帶有四個鉑或銥電極,並放置在大腦的一個或兩個不同核團中。導線透過延長線連線到 IPG。它是一根絕緣線,從頭部下方穿過皮膚,沿著頸部側面,耳後到達 IPG,IPG 被放置在鎖骨下方或某些情況下放置在腹部。[83] 導線放置在大腦中的位置取決於要解決的症狀型別。IPG 可以由神經科醫生、護士或經過培訓的技術人員校準。[84]
所有這三個部分都透過手術植入大腦。導線植入可能需要區域性麻醉或全身麻醉("睡眠 DBS")。在頭骨中鑽一個直徑約 14 毫米的孔,並插入探針電極。在使用區域性麻醉的清醒手術過程中,患者的反饋決定了永久電極的最佳放置位置。在睡眠手術過程中,術中 MRI 指導用於確定電極的位置。 [85] 通常,IPG 和延長線在全身麻醉下安裝。[86]
- Bronzino, Joseph D. (2006 年 4 月)。生物醫學工程手冊,第三版. [CRC 出版社]. ISBN 978-0-8493-2124-5.
- Villafane,Carlos,CBET。(2009 年 6 月)。生物醫學:從學生的角度,第一版。[Techniciansfriend.com]。 ISBN 978-1-61539-663-4.
{{cite book}}: CS1 maint: 多個名字:作者列表 (link)
- ↑ Whittaker,E. T. (1951),以太和電的理論史。第 1 卷,Nelson,倫敦
- ↑ Franco R, Bortner CD, Cidlowski JA (2006 年 1 月)。“電基因離子轉運和質膜去極化在凋亡中的潛在作用”。J. Membr. Biol. 209 (1): 43–58。 doi:10.1007/s00232-005-0837-5。 PMID 16685600.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (link) - ↑ 美國國立醫學圖書館 - 醫學主題詞,神經遞質
- ↑ a b “國際神經調節學會主頁”. 檢索於 2013 年 10 月 1 日.
- ↑ Joel A. DeLisa, Bruce M. Gans, Nicholas E. Walsh (2005),物理醫學與康復:原理與實踐,Lippincot Williams & Wilkins,第 1405 頁
- ↑ 維基百科,神經再生
- ↑ 創傷和沃勒變性
- ↑ Enciu AM 等人。神經退行性疾病中的神經再生,BMC 神經學 2011,11:75
- ↑ “周圍神經損傷”.
- ↑ Otto D. Payton & Richard P. Di Fabio 等人。物理治療手冊。丘吉爾·利文斯通公司。 ISBN 0-443-08499-8
- ↑ “神經損傷分類”.
- ↑ Otto D. Payton & Richard P. Di Fabio 等人。物理治療手冊。丘吉爾·利文斯通公司。 第 24 頁。 ISBN 0-443-08499-8
- ↑ Fenrich,Keith;Gordon,Tessa (2004)。“周圍神經系統和中樞神經系統中的軸突再生 - 當前問題和進展”。加拿大神經科學雜誌。31 (2): 142–156。 ISSN 0317-1671.
- ↑ a b Campbell,William W. (2008 年 8 月 31 日)。“周圍神經損傷的評估和管理”。臨床神經生理學。119 (9): 1951–1965。 doi:10.1016/j.clinph.2008.03.018。 PMID 18482862.
- ↑ Burnett,Mark G.;Zager,Eric L. (2004)。“周圍神經損傷的病理生理學:簡要回顧”。Medscape Today:神經外科重點。 ISSN 1092-0684. 檢索於 2013 年 8 月 11 日.
- ↑ Yoo,S (2010)。“軸突 mRNA 轉運的動力學及其對周圍神經再生的意義”。實驗神經學。1. 223: 19-27。 doi:10.1016/j.expneurol.2009.08.011。 PMC 2849851. 檢索於 2014 年 4 月 1 日.
{{cite journal}}: 未知引數|coauthors=被忽略 (|author=建議) (help) - ↑ a b Johansson BB:大腦和脊髓的再生和可塑性。J Cereb Blood Flow Metab 2007,27:1417-1430
- ↑ McKay R:中樞神經系統中的幹細胞。Science 1997,276:66-71。
- ↑ Morshead CM,Reynolds BA,Craig CG,McBurney MW,Staines WA,Morassutti D,Weiss S,van der Kooy D:成年哺乳動物前腦中的神經幹細胞:腦室下區細胞的相對靜止亞群。Neuron 1994,13:1071-1082。
- ↑ Shihabuddin LS,Palmer TD,Gage FH:尋找神經祖細胞:治療神經退行性疾病的前景。Mol Med Today 1999,5:474-480
- ↑ D. Kacy Cullen 等人,神經組織工程學用於神經再生和生物混合介面微系統體內研究(第二部分),生物醫學工程關鍵評論,第 39 卷,2011 年第 3 期,第 241-259 頁
- ↑ Filler, Aaron (2009 年 7 月 12 日)。“計算機影像在神經疾病診斷和神經外科中的歷史、發展和影響:CT、MRI 和 DTI”。《自然預印本》。doi:10.1038/npre.2009.3267.4.
- ↑ McCulloch,Warren;Walter Pitts(1943)。“神經活動中固有思想的邏輯演算”。《數學生物物理學報》。5(4):115–133。doi:10.1007/BF02478259.
- ↑ Minsky,M.;S. Papert(1969)。《計算幾何導論》。麻省理工學院出版社。ISBN 0-262-63022-2.
- ↑ Werbos,P.J.(1975)。《超越迴歸:行為科學預測和分析的新工具》。
- ↑ 維基百科,人工神經元
- ↑ F. C. Hoppensteadt 和 E. M. Izhikevich(1997)。《弱連線神經網路》。施普林格。第 4 頁。ISBN 978-0-387-94948-2.
- ↑ Gifford RH, Shallop JK, Peterson AM。語音識別材料和天花板效應:對人工耳蝸植入計劃的考慮。聽力學和神經耳鼻喉科。2008;13:193–205.
- ↑ Wilson BS, Dorman MF。人工耳蝸:光輝的過去和燦爛的未來。聽力研究。2008;242:3–21.
- ↑ Arle JE, Alterman RL。帕金森病的外科手術選擇。北美醫學臨床。1999;83:483–98. vii.
- ↑ Chapin JK, Moxon KA, Markowitz RS, Nicolelis MA。使用運動皮層中同時記錄的神經元即時控制機械臂。自然神經科學。1999;2:664–70.
- ↑ Carmena JM, Lebedev MA, Crist RE, O'Doherty JE, Santucci DM 等。學習透過腦機介面控制靈長類動物的伸手和抓取。公共科學圖書館生物學。2003;1:1–16.
- ↑ Musallam S, Corneil BD, Greger B, Scherberger H, Andersen RA。神經假肢的認知控制訊號。科學。2004;305:258–62.
- ↑ Santhanam G, Ryu SI, Yu BM, Afshar A, Shenoy KV。高效能腦機介面。自然。2006;442:195–98.
- ↑ Taylor DM, Tillery SI, Schwartz AB。三維神經假肢裝置的直接皮層控制。科學。2002;296:1829–32.
- ↑ Daniel Garrison。"最小化體內體感測器熱效應". 檢索於 2010 年 5 月 5 日.
- ↑ Lebedev, M.A., 腦機介面:過去、現在和未來。神經科學趨勢,2006。29(9): p. 11.
- ↑ Nicolelis, M.A.L., 重構印記:同步、多位點、多單神經元記錄。神經元,1997。18: p. 9.
- ↑ O'Driscoll, S.;Meng, T.H.;Shenoy, K.V. 和 Kemere, C.(2006)。神經元到矽:可植入假肢處理器 IEEE ISSCC(談話):552-553。
- ↑ Sarpeshkar, R. 等人。(2008)。用於腦機介面的低功耗電路 IEEE Trans BioCAS 2(3): 173-183
- ↑ Sharma, A. 等人。(2011)。基於猶他州斜坡電極陣列的全整合無線神經介面的長期體外功能穩定性和記錄壽命 J. Neural Eng. 8: 1-7
- ↑ Chiel, H. J., & Beer, R. D. (1997). 大腦擁有身體:適應性行為源於神經系統、身體和環境的相互作用。[社論材料]。神經科學趨勢,20(12),553-557。
- ↑ Ijspeert, A. J., Crespi, A., Ryczko, D., 和 Cabelguen, J. M. (2007). 從游泳到行走:由脊髓模型驅動的蠑螈機器人。科學 315, 1416-1420。
- ↑ Kimura, H., Fukuoka, Y., 和 Cohen, A. H. (2007). 受生物啟發的四足機器人的適應性行走。Philos Transact A Math Phys Eng Sci 365, 153-170
- ↑ McKinstry, J. L., Edelman, G. M., 和 Krichmar, J. L. (2006). 預測運動控制的小腦模型在基於大腦的裝置中得到驗證。美國國家科學院院刊 103, 3387-3392
- ↑ Porr, B., 和 Worgotter, F. (2003). 各向同性序列順序學習。神經計算 15, 831-864
- ↑ Dean, P., Mayhew, J. E., Thacker, N., 和 Langdon, P. M. (1991). 模擬機器人攝像機-頭部系統中的掃視控制:用於高效學習逆運動學的網路結構。生物控制論 66, 27-36
- ↑ Dean, P., Mayhew, J. E., Thacker, N., 和 Langdon, P. M. (1991). 模擬機器人攝像機-頭部系統中的掃視控制:用於高效學習逆運動學的網路結構。生物控制論 66, 27-36
- ↑ Eskiizmirliler, S., Forestier, N., Tondu, B., 和 Darlot, C. (2002). 應用於由 McKibben 人工肌肉驅動的單關節機器人手臂控制的小腦通路模型。生物控制論 86, 379-394
- ↑ Hofstotter, C., Mintz, M., 和 Verschure, P. F. (2002). 小腦在行動:模擬和機器人研究。歐洲神經科學雜誌 16, 1361-1376。
- ↑ O'Keefe, J., 和 Nadel, L. (1978). 海馬體作為認知地圖(牛津:克拉倫登出版社)。
- ↑ Mataric, M. J. (1998). 基於行為的機器人學作為合成人工行為和分析自然行為的工具。[回顧]。認知科學趨勢,2(3),82-87。
- ↑ Aston-Jones, G., 和 Bloom, F. E. (1981). 行為大鼠中含有去甲腎上腺素的藍斑神經元對非有害環境刺激表現出明顯的反應。J Neurosci 1, 887-900
- ↑ Hasselmo, M. E., Hay, J., Ilyn, M., 和 Gorchetchnikov, A. (2002). 神經調節、θ 節律和大鼠空間導航。神經網路 15, 689-707
- ↑ Schultz, W., Dayan, P., 和 Montague, P. R. (1997). 預測和獎勵的神經基礎。科學 275, 1593-1599。
- ↑ Doya, K., 和 Uchibe, E. (2005). 網路齧齒動物專案:探索自我保護和自我複製的適應機制。適應性行為 13, 149 - 160。
- ↑ Prescott, T. J.,Montes Gonzalez, F. M.,Gurney, K.,Humphries, M. D. 和 Redgrave, P.(2006)。基底神經節的機器人模型:行為和內在處理。神經網路 19,31-61
- ↑ a b c Schmidt,Christine;Jennie Leach(2003 年 6 月)。“神經組織工程:修復和再生的策略”。《生物醫學工程年度評論》。5:293-347。
- ↑ 免費詞典,自體移植
- ↑ Schmidt,C. E.;Leach,J. B.(2003 年 8 月)。“神經組織工程:修復和再生的策略”。《生物醫學工程年度評論》。5:293-347。doi:10.1146/annurev.bioeng.5.011303.120731。PMID 14527315。
- ↑ a b Lavik,E.;Langer,R.(2004 年 7 月)。“組織工程:現狀和展望”。《應用微生物生物技術》。65(1):1-8。doi:10.1007/s00253-004-1580-z。PMID 15221227。
- ↑ a b Cai,J.(2005 年 11 月)。“含有微絲支架的可滲透引導通道增強軸突生長和成熟”。《生物材料研究雜誌 A 部分》。75A(2):374-386。doi:10.1002/jbm.a.30432。PMID 16088902。
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Wu,Y.(2006)。“自組裝 IKVAV 肽奈米纖維促進 PC12 細胞粘附”。《華中科技大學學報(醫學版)》。26(5):594-596。doi:10.1007/s11596-006-0530-7。PMID 17219978。
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Forraz,N.;Wright,K. E.;Jurga,M.;McGuckin,C. P.(2013)。“中樞神經系統修復的實驗療法:幹細胞和組織工程”。《組織工程與再生醫學雜誌》7:523-536。doi:10.1002/term.552。
- ↑ William M Pardridge,腦部藥物遞送,《腦血流和代謝雜誌》(1997)17,713-731
- ↑ Menei P,Montero-Menei C,Venier MC,Benoit JP,使用聚(乳酸-共-乙醇酸)微球將藥物遞送至大腦,《藥物遞送專家意見》(2005 年 3 月)2(2):363-76
- ↑ "''融合技術''"。Wtec.org. Retrieved 2012-05-18.
- ↑ 增強技術小組(1998)。“小組成員的著作”. Retrieved 2007-02-02.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ a b Roco,Mihail C. 和 Bainbridge,William Sims,eds.(2004)。融合技術以提高人類績效。施普林格。ISBN 1-4020-1254-3。
{{cite book}}:|author=has generic name (help)CS1 maint: multiple names: authors list (link) - ↑ Agar,Nicholas(2004)。自由優生學:為人類增強辯護。ISBN 1-4051-2390-7。
- ↑ Parens,Erik(2000)。增強人類特質:倫理和社會影響。喬治城大學出版社。ISBN 0-87840-780-4。
- ↑ Kringelbach ML,Jenkinson N,Owen SLF,Aziz TZ(2007)。“深部腦刺激的翻譯原則”。《自然評論神經科學》。8:623-635。PMID 17637800。
- ↑ Ford, Alyssa (2005年5月至6月). "人類:混音". Utne 雜誌. 檢索於 2007-03-03.
- ↑ 莫尼,帕特·羅伊 (2002). "超越克隆:讓健康的人'更好'". 檢索於 2007-02-02.
{{cite journal}}: 引用期刊需要|journal=(幫助) - ↑ 福山,弗朗西斯 (2002). 我們後人類的未來:生物技術革命的後果. 法勒·斯特勞斯和吉魯. ISBN 0-374-23643-7.
- ↑ 生物技術與人類未來研究所. "人類 '增強'". 檢索於 2007-02-02.
{{cite journal}}: 引用期刊需要|journal=(幫助) - ↑ 邁克爾·豪斯凱勒,更好的人類?:理解增強專案,敏銳,2013,ISBN 978-1-84465-557-1.
- ↑ 更好,更好,最好:人類對增強的追求 邀請研討會總結報告。由科學自由、責任和法律計劃召開。美國科學促進會。2006 年 6 月 1 日至 2 日。作者:埃尼塔·A·威廉姆斯。編輯:馬克·S·弗蘭克爾。
- ↑ 休斯,詹姆斯 (2004). 公民賽博格:為什麼民主社會必須應對未來的改造人類. 西景出版社. ISBN 0-8133-4198-1.
- ↑ 美國衛生與公眾服務部.FDA 批准植入式腦刺激器來控制震顫。 檢索於 2006 年 10 月 18 日。
- ↑ '腦起搏器' 治療肌張力障礙。 KNBC 電視臺,2003 年 4 月 22 日。檢索於 2006 年 10 月 18 日。
- ↑ FDA 批准針對嚴重強迫症的深部腦刺激器的人道主義器械豁免。
- ↑ 美國國立神經疾病和中風研究所. 帕金森病深部腦刺激資訊頁面。 檢索於 2006 年 11 月 23 日。
- ↑ Volkmann J, Herzog J, Kopper F, Deuschl G. "深部腦刺激器程式設計簡介". 運動障礙. 2002 17, S181–187. PMID 11948775.
- ↑ Starr PA, Martin AJ, Ostrem JL, Talke P, Levesque N, Larson PS. 使用高場介入性磁共振成像和頭骨安裝瞄準裝置的丘腦底核深部腦刺激器植入:技術和應用精度。神經外科雜誌. 2010 年 3 月;112(3):479-90. doi: 10.3171/2009.6.JNS081161. PMID 19681683
- ↑ 深部腦刺激,匹茲堡大學神經外科系。檢索於 2008 年 5 月 13 日。