化學之友/物質
要進行機械分離,物質需要手動或使用磁鐵進行分離([1]p.38)。
一些混合物可以透過靜置使其沉澱到容器底部來分離。這種方法通常很慢,但可以透過旋轉容器來加快速度([1]p.39)。
將空氣吹入化合物,使其部分起泡並浮到頂部。然後將頂部部分撇去([1]p.38)。
如果你有一個非均相混合物,其中包含混合的固體,你可以將其倒入過濾器中以將固體與液體分離([1]p.38)。

你可以在溶液中加入一種物質,這種物質可溶於溶液中的某些元素,但不能溶於所有元素([1]p.39)。
分餾是透過在不同溫度下沸騰液體化合物來實現的。組成部分在不同的溫度下汽化,因此可以將其分離([1]p.39)。
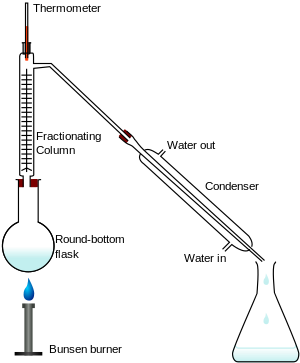
在固體溶解於液體的化合物中,冷卻會形成固體元素的晶體。這在鹽水或糖水中自然發生([1]p.39)。
將混合物溶解在溶劑中。溶劑透過多孔材料(如濾紙),並且化合物的元素在多孔材料中以不同的速率分離。這會產生不同元素的環或線([1]p.39)。
萬物皆由元素構成。我們主要由碳、氫、氧、氮、鈣和磷組成[2]。元素包含:質子、電子和中子。中子和質子停留在原子核中,而電子繞著原子核執行。
當兩種或多種元素以確定的比例組合在一起時,它們被稱為化合物[3]。水(H2O)和鹽(NaCl)都是化合物,因為它們是由一種以上的元素組成的。
在均相混合物中,你看不到單獨的成分。字首“homo”表示相同。均相混合物通常被稱為溶液,或者當顆粒稍大時被稱為膠體。均相混合物中的顆粒肉眼不可見,除了某些膠體,這些膠體的顆粒在直射光下可能可見[4]。不鏽鋼和青銅等金屬是均相混合物。
非均相混合物
[edit | edit source]非均相混合物是指不同成分可以用肉眼看到的混合物,“hetero”表示不同。懸浮液是非均相混合物,當靜置時,會分離成不同的成分。混合蔬菜、海灘沙和油醋混合物都是非均相混合物的例子 [4]。
元素
[edit | edit source]元素分類
[edit | edit source]有幾種方法可以寫出分子的名稱。元素週期表上的每種元素都有一個名稱和一個符號。例如,你可以用兩種方式寫出氫元素。你可以直接寫出名稱“氫”,也可以寫出它的符號“H”。符號是一個或兩個(在某些情況下是三個)字母。第一個字母大寫,第二個字母小寫。
命名離子化合物
[edit | edit source]當元素在離子化合物中結合在一起時,有一種特殊的寫法。假設有一個鋅和氧的化合物。它的名稱是“氧化鋅”。在寫名稱時,我們將最後一個元素的最後一個音節改為“-ide”。當寫化學式時,我們使用符號而不是完整的單詞。此外,還需要指定每種化合物中鋅原子和氧原子的數量。鋅的電荷為2+,而氧的電荷為1-。為了形成穩定的化合物,我們需要電荷加起來為零。因此,每1個鋅原子需要2個氧原子。這就是化學式:ZnO2。在用完整名稱命名離子化合物時,不需要說出每個元素的數量,但是如果寫符號,就需要寫。
命名分子化合物
[edit | edit source]命名分子化合物與命名離子化合物非常相似。但是,在命名化合物時,需要指定每個原子的數量。例如,水的化學式是H2O。我們把它寫成完整的名稱“二氧化氫”。我們在氫前面加上字首“di”,表示每個氧原子上有兩個氫原子。以下是1-10的字首列表 ([1] p.113)
- 一(你不需要寫,但可以寫。)
- 二
- 三
- 四
- 五
- 六
- 七
- 八
- 九
- 十
元素週期表
[edit | edit source]週期律
[edit | edit source]週期律是關於元素按其原子量排列的規律,由約翰·亞歷山大·紐蘭茲在1864年發現。它指出:“當元素按原子量遞增的順序排列時,化學和物理性質會形成規律,並在規律的間隔中重複出現”。([1] p.63)。
族/主族
[edit | edit source]元素週期表分為18個不同的縱列,稱為“族”或“主族”。每個族元素都具有相似的特徵,例如最外層軌道的電子數量或它們與其他元素反應的方式。第一族,包括鈉和鍅,只有一個價電子,並且都與水劇烈反應。
鹼金屬
[edit | edit source]鹼金屬是元素週期表第一族的金屬元素,位於最左側,不包括氫,氫只是為了分類目的放在這一行。這個族中的每種元素都具有1+的離子電荷,並且只有一個價電子。這意味著它們很不穩定,並且會與其他元素迅速反應。鹼金屬與水反應尤其劇烈。它們的原子序數越高,反應越劇烈,因為它們越不穩定。銣和鉀都是鹼金屬。
鹼土金屬
[edit | edit source]鹼土金屬是元素週期表第二族的元素,位於左側附近。它們具有2+的離子電荷,並且非常活潑。
過渡金屬
[edit | edit source]從第三族到階梯線的金屬被稱為“過渡金屬”。它們具有不同的離子電荷,其中一些元素具有不止一種離子電荷,並且它們的反應活性也不同。這部分元素包含許多我們日常使用的金屬,例如鐵、銅和錫。
鹵素
[edit | edit source]鹵素是元素週期表倒數第二族的非金屬元素,位於最右側附近。由於它們具有1-的離子電荷,因此它們是高反應性元素。
惰性氣體
[edit | edit source]惰性氣體是元素週期表最右側的族中的氣體。它們被稱為“惰性”是因為它們是唯一具有完整價層的元素,因此它們不會輕易與其他元素反應。它們是穩定存在於正常條件下的元素。當透過這些元素放電時,它們會發出不同的顏色。氦氣、氖氣和氬氣都是惰性氣體。
鑭系元素
[edit | edit source]從鑭開始的一系列元素被稱為鑭系元素。
錒系元素/超鈾元素
[edit | edit source]從錒開始的一系列元素被稱為錒系元素。
階梯線
[edit | edit source]這是金屬和非金屬之間的分界線。它被稱為階梯線,因為它像樓梯的臺階一樣。
金屬
[edit | edit source]這些元素位於階梯線右側。
早期的希臘人只有可以識別少數元素的技術。最初識別的七種元素是金、銀、鐵、汞、錫、銅和鉛。當時,希臘人只知道七顆行星或天體,因此他們為每種元素命名了天體並賦予了符號以表示它們。希臘人對元素的化學性質知之甚少,他們只是用它們來製造工具和藝術品。隨著時間的推移,人們發現使用符號來表示所有元素是不夠的,因此最終將其更改為字母。([1]p.55)。
道爾頓的理論通常被稱為“檯球模型”。他認為原子是中性的球體,質子和電子之間沒有明顯的區別。
 玻爾是第一個提出元素具有帶正電荷的原子核和繞其執行的帶負電荷的電子的化學家,電子被分成軌道組,每層具有特定數量的電子。他認為每個軌道會包含一定數量的電子,而最外層電子的數量決定了化學性質。
玻爾是第一個提出元素具有帶正電荷的原子核和繞其執行的帶負電荷的電子的化學家,電子被分成軌道組,每層具有特定數量的電子。他認為每個軌道會包含一定數量的電子,而最外層電子的數量決定了化學性質。
電子帶負電荷。它們圍繞原子核執行。每個軌道需要一定數量的電子。當沒有足夠的電子來填充軌道時,原子帶正電荷。當發生相反的情況時,原子必須開啟一個新的軌道來容納一兩個電子。這種原子帶負電荷。當像鈉這樣的帶正電荷的原子找到像氯這樣的帶負電荷的原子時,氯會將額外的電子給予需要一個額外電子的鈉。然後它們兩個形成離子化合物,即氯化鈉。
原子核是原子的中心。它包含帶正電荷的質子和帶中性電荷的中子。原子核是原子中大部分質量的來源,因為電子的重量不足以產生顯著的影響。每個質子或中子的重量為 1 個原子質量單位(AU)。透過檢視摩爾質量和原子序數,可以找出元素中質子或中子的數量。原子序數是質子的數量,原子序數減去摩爾質量是中子的數量。
原子序數是元素週期表中元素的序號。它表示元素原子核周圍有多少個電子,因此隨著原子序數的增加,電子的數量也隨之增加。例如,碳的原子序數是 12。這意味著它有 12 個電子,因此也有 12 個質子。元素根據其原子序數進行分組,因為元素中電子的數量會影響其性質。
中子是帶中性電荷的亞原子粒子。它們位於原子核中,重量為 1 個原子質量單位。元素中中子的數量決定了它是否為同位素。
同位素是具有正常數量的質子和電子,但具有額外或更少的中子的元素。元素仍然帶中性電荷,因為質子和電子仍然相互平衡。額外或缺失的中子會增加或減少元素的重量。同位素可以在自然界中找到,但它們通常不像元素的正常版本那樣穩定。([1]p.76)。
質量數是原子的摩爾質量。它包含元素中質子和中子的總質量。在元素週期表中,摩爾質量很少是整數。這是因為它是元素所有常見同位素的平均質量。氫的常見同位素很少,因此它的原子序數是 1.01。
單原子離子是透過獲得或失去電子來填充其價電子的元素。這使它們帶正電或負電荷。它們也被稱為離子。[1].
陽離子是透過失去電子來填充其價電子的元素。它們作為離子帶正電荷,因為它們具有比電子更多的質子。所有鹼金屬都是陽離子,因為它們會失去電子而不是獲得電子來填充其最外層電子層。
陰離子與陽離子相反,它們帶負電荷,因為它們透過獲得電子來填充其價電子層。大多數非金屬元素都是陰離子,因為它們位於元素週期表的右側,會獲得電子而不是失去電子。記住它們區別的一個簡單方法是想象一隻快樂的貓。這將幫助你記住陽離子帶正電荷。
以下是一個關於物質部分的簡短測驗
- ↑ a b c d e f g h i j k l m Jenkins, F., van Kessel, H., Tompkins, D., Lantz, O., (1996). Nelson Chemistry, British Columbia, Nelson Canada.
- ↑ Chem4Kids[1997-2012]http://www.chem4kids.com/files/elem_intro.html
- ↑ Chemistry and You! (n.d.) [1]
- ↑ a b Ophardt, C., Virtual Chembook,(2003), [2]
- ↑ Dayah, M. (1997) Dynamic Periodic Table, http://www.ptable.com

![淺藍色元素是惰性氣體,黃色元素是鹵素,兩者都是非金屬元素的一部分,用綠色表示。類金屬元素用棕色表示。過渡金屬元素用淡紫色表示。週期表主體中粉紅色的金屬是過渡金屬,週期表主體下方第一行的元素是鑭系元素,鑭系元素下面的元素是錒系元素,鹼土金屬是橙色,鹼金屬是紅色[5]。](http://upload.wikimedia.org/wikipedia/commons/thumb/8/84/Periodic_table.svg/779px-Periodic_table.svg.png)