高中化學/電子構型
在上一節中,我們確定了化學家族(元素週期表上的垂直列)的成員在其最外層電子層具有相同的電子構型。在下一節中,我們將回顧電子構型的軌道表示和電子構型程式碼。然後,我們將學習一個書寫電子構型程式碼的簡便方法。
- 將軌道表示圖轉換為電子構型程式碼。
- 區分外層電子層(價電子)和核心電子。
- 使用簡便方法書寫原子和離子的電子構型程式碼。
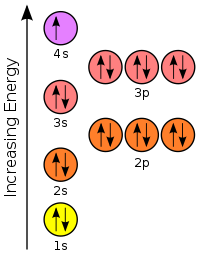
下圖代表了軌道表示圖,它在前面的章節中使用過。軌道表示圖有幾種不同的變體,但它們都用於繪製電子構型。大多數圖將軌道以組的形式顯示,作為直線、方框或圓圈,每個軌道在每個亞層中都有自己的直線(或圓圈)。
2p亞層有3個軌道(2px、2py和2pz),並且每個軌道都有自己的直線(或方框)。
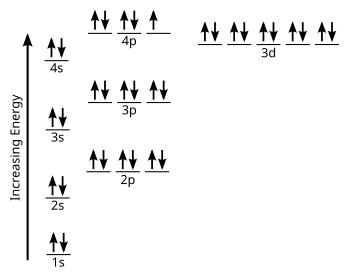
讓我們從一箇中性原子的軌道方框(或軌道表示圖)開始這一節。使用下面的電子構型圖繪製鉀的電子構型。記住鉀是元素編號19,所以它有19個電子。能量圖中的每條線都容納兩個自旋相反的電子。
現在我們可以簡化它,透過排除所有未被使用或沒有容納電子的能級和亞層。
鉀的電子構型程式碼為
- :
記住,惰性氣體是幾乎不反應的元素,部分原因是其最外層電子層的電子構型是滿的(ns2np6)。在元素週期表上找到鉀,然後找到它之前的惰性氣體。從鉀開始往後退,數到最近的惰性氣體。你得到什麼?正確答案是氬(Ar)。現在,讓我們繪製氬的電子構型,並將鉀的電子構型放在它旁邊。
觀察這兩張圖你發現什麼?鉀與氬的電子構型相同,只是多了一個電子。當我們書寫電子構型程式碼時,我們可以強調這一點。
: :
因此,
- : (這被稱為惰性氣體構型程式碼系統或“簡便方法”)
讓我們再試一個。繪製並書寫鎵(Ga)的電子構型。鎵是元素編號31,因此它有31個電子。它也在第4週期,是主族元素週期中的第三個元素。從這些資訊中,我們知道最外層的電子將是4s24p1。
書寫鎵的電子構型程式碼,我們得到1s22s22p63s23p64s23d104p1。按照數字順序,鎵的電子構型為1s22s22p63s23p63d104s24p1。
現在,回到之前的惰性氣體。同樣,我們發現之前的惰性氣體是氬。記住氬的電子構型為1s22s22p63s23p6。
: :
因此,
- :
這對於中性原子來說似乎很有效,那麼離子呢?請記住,當從中性原子中移除電子時會形成陽離子,而當向中性原子中新增電子時會形成陰離子。但是電子從哪裡新增或移除呢?參與化學反應的電子是位於最外層殼層的電子。因此,如果要移除或新增電子,它們將從具有最高n值的外層殼層中移除或新增到該外層殼層中。
現在讓我們看一個例子。繪製 Fe 的電子構型。然後,寫出 Fe2+ 形成的反應。
Fe2+ 離子形成的反應為:Fe → Fe2+ + 2e−。因此,我們必須移除 2 個電子。我們從哪裡移除這兩個電子?規則是從最高的n值開始移除,在本例中,這意味著我們首先從 4s 子能級移除電子。
請記住,當我們使用惰性氣體構型編寫電子構型程式碼時,我們使用前一個惰性氣體。在編寫 Fe 或 Fe2+ 的電子構型程式碼時,我們將使用符號 [Ar] 來代替 1s22s22p63s23p6。
除了形成 Fe2+ 離子外,鐵原子還可以形成 Fe3+ 離子。具有完全半充滿的d軌道的電子構型獲得額外的穩定性。從鐵原子中移除形成 Fe3+ 離子的第三個電子是從d軌道中移除的,這使得該鐵離子具有一個完全半充滿的d軌道。這種構型的額外穩定性解釋了為什麼鐵可以形成兩種不同的離子。
那麼負離子,即陰離子呢?請記住,負離子是透過向電子雲中新增電子而形成的。看一看溴,Br。中性溴的原子序數為 35,因此它擁有 35 個電子。
Br− 離子形成的反應為:Br + e− → Br−。溴離子是透過新增一個電子而形成的。如果你看一下溴的電子構型,你會注意到 4p 子能級還需要一個電子才能填滿該子能級,如果該子能級被填滿,則 Br− 的電子構型與惰性氣體氪 (Kr) 的電子構型相同。當新增電子形成負離子時,電子將被新增到最低未填滿的n值中。
或者
注意 Br− 的電子構型與 Kr 相同。當這種情況發生時,它們被稱為等電子。
|
示例問題 使用稀有氣體電子構型簡寫法,寫出以下原子或離子的電子構型程式碼。
解答:
|
核心電子
[edit | edit source]當我們檢視任何元素的電子構型時,我們可以區分出兩種不同的電子型別。有些電子參與反應,有些則不參與。外層電子被稱為價電子,它們負責原子發生的反應。對於主族元素,價電子的數量隨著你在元素週期表中橫向移動而增加。
在舊的元素週期表中,各族用 A 和 B 來編號。代表族(s 和 p 區)用 A 編號,過渡元素用 B 編號。下表列出了兩種編號系統。圖表中用紅色顯示了 A 編號;在本課中,我們將只關注這個編號。A 族中的價電子數量隨著族數的增加而增加。實際上,A 族的編號就是價電子的數量。因此,如果一個元素在 3A 族,它有 3 個價電子,如果它在 5A 族,它有 5 個價電子。
除價電子之外的所有電子都稱為核心電子。這些電子處於內層能級。將一個電子從這些滿殼層中拉出來需要大量的能量,因此,它們通常不參與任何反應。看看鎵 (Ga) 的電子構型。它有 3 個價電子和 28 個核心電子。
|
示例問題 以下各元素有幾個核心電子和價電子?
解答:
|
課程總結
[edit | edit source]- 可以使用軌道盒圖來繪製元素的電子構型。
- 稀有氣體構型系統是表示元素電子構型的簡寫方法。
- 稀有氣體符號代表所有或大多數核心電子。
- 對於陽離子,電子從具有最大 n 值的最外層亞層中移除。
- 對於陰離子,電子新增到具有最低 n 值的未填充能級。
- 等電子物種具有相同的電子構型。
- 使用軌道盒圖,可以輕鬆地視覺化核心電子和價電子。
- 價電子是指位於最外層殼層中的電子。
複習題
[edit | edit source]- 標準電子構型程式碼和使用稀有氣體構型的電子構型程式碼有什麼區別?
- 標準電子構型通常被稱為基態電子構型。你認為為什麼是這樣?
- 為什麼兩個不同的離子可以有相同數量的核心電子和價電子?
- 繪製鉀 (K) 的電子構型的軌道表示。
- 寫出鉀 (K) 的電子構型程式碼。
- 寫出鉀 (K) 的稀有氣體電子構型程式碼。
- 鉀 (K) 有幾個核心電子和價電子?
- 寫出鉀 (K+) 的電子構型。
- 寫出鉀 (K+) 的稀有氣體電子構型程式碼。
- K+ 與哪些物種等電子?
- 以下電子構型屬於哪個元素?
- [Kr]4d105s25p2
- (a) Sb
- (b) Sn
- (c) Te
- (d) Pb
- 以下電子構型屬於哪個元素?
- [Xe]5d106s26p4
- (a) Pb
- (b) Bi
- (c) Po
- (d) Tl
- 溴元素的稀有氣體電子構型是什麼?
- (a) 1s22s22p63s23p64s24p5
- (b) 1s22s22p63s23p63d104s24p5
- (c) [Ar]4s24p5
- (d) [Ar]3d104s24p5
- 寫出以下各元素的稀有氣體電子構型。
- (a) Al
- (b) N3−
- (c) Sr2+
- (d) Sn2+
- (e) I
- 以下各元素有幾個核心電子和價電子?
- (a) Mg
- (b) C
- (c) S
- (d) Kr
- (e) Fe
詞彙
[edit | edit source]- 核心電子
- 佔據最外層能級以下的能級的電子。
- 等電子
- 具有相同的電子構型。
- 軌道盒圖
- 繪製電子構型的圖,其中亞層以組(甚至以方格)顯示,每個軌道在每個亞層內都有自己的線(或方格)。
- 價電子
- 佔據原子或離子外層殼層的電子。
本材料改編自可在此處找到的原始 CK-12 圖書。該作品根據知識共享署名-相同方式共享 3.0 美國許可協議釋出










![{\displaystyle [{\text{Ar}}]4s^{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1c4b17922ea1878953e29b582e36ad2da592cc7)



![{\displaystyle [{\text{Ar}}]4s^{2}3d^{10}4p^{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d1ab7511907f596545a2b6121a960dabb4f6895)






![{\displaystyle [{\text{Ar}}]3d^{6}4s^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d9afad4dcec6812aff77aebaf74882154c0c274)
![{\displaystyle [{\text{Ar}}]3d^{6}+2e^{-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/158efdfbfd97872dbaadd3d7af410da550d4751c)

![{\displaystyle [{\text{Ar}}]3d^{5}+3e^{-}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d42dc0fab3d7bf87bf2e055cd223842ae7b729cd)




![{\displaystyle [{\text{Kr}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/efe1422248466f512bd18f7076dfda35b64ee1f3)
