高中化學/週期表和電子構型
根據我們已經討論過的內容,你可能會意識到,正如電子構型可以用來解釋週期表的形狀和組織方式一樣,週期表的形狀和組織方式反過來也可以用來預測電子構型。事實上,如果你可以在週期表上找到一個元素,你就可以利用元素的位置來確定元素價電子的能級。此外,元素在週期表上的位置告訴你元素最高能級價電子的亞層。在本課中,我們將仔細研究週期表與電子構型之間的關係。
- 將元素在週期表中的位置與它的價電子的能級聯絡起來(不包括過渡金屬、鑭系元素和錒系元素)。
- 將元素在週期表中的位置與它最高能級價電子的亞層聯絡起來。
- 解釋為什麼週期表的第一行只有兩個元素。
首先,讓我們試著找出我們可以從元素在週期表中的行或週期中瞭解到的資訊。
下圖顯示了週期表中不同行的編號方式。過渡金屬以及鑭系元素和錒系元素已被省略。

為了理解這在元素的電子構型方面意味著什麼,讓我們考慮一下IA族金屬。如果我們寫下週期表中每一行IA族金屬的電子構型,我們有
第2行 Li 第3行 Na 第4行 K 第5行 Rb 第6行 Cs 第7行 Fr
你看到規律了嗎?對於IA族金屬,元素的行似乎對應於該元素價電子的能級。例如,鋰(Li)位於週期表上的第2行,它的價電子位於n = 2能級。銫(Cs)位於週期表上的第6行,它的價電子位於n = 6能級。讓我們看看這種規律是否適用於IIA族金屬
第2行 Be 第3行 Mg 第4行 Ca 第5行 Sr 第6行 Ba 第7行 Ra
對於 IIA 族金屬,相同的規則適用!鎂 (Mg) 位於元素週期表的第三週期,其價電子位於 n = 3 能級。類似地,鐳 (Ra) 位於元素週期表的第七週期,其價電子位於 n = 7 能級。
到目前為止還不錯 - 但是,相同的模式是否適用於 IIIA-VIIIA 族元素(也稱為 13-18 族)?讓我們透過編寫每一週期中 IIIA 族元素的電子構型來找出答案。
第2行 B 第3行 Al 第4行 Ga 第5行 In 第6行 Tl
雖然 III A 族元素的價電子在 *s* 和 *p* 軌道中都有,但事實證明,元素的行數仍然對應於該元素價電子的能級。例如,鎵 (Ga) 位於元素週期表的第 4 行,其價電子位於 *n* = 4 能級。同樣,鉈 (Tl) 位於元素週期表的第 6 行,其價電子位於 *n* = 6 能級。
看起來我們可以使用元素週期表中元素的行號來預測元素價電子的能級。不過,為了確保,讓我們再試一個例子,透過寫出每行 VII A 族元素的電子排布。
第2行 F 第3行 Cl 第4行 Br 第5行 I 第6行 At
再次,元素的行號可以用來確定該元素價電子的能級。例如,氯 (Cl) 位於元素週期表的第 3 行,其價電子位於 *n* = 3 能級。同樣,碘 (I) 位於元素週期表的第 5 行,其價電子位於 *n* = 5 能級。
在能級及其與元素週期表的關係方面,您應該注意最後一點。我們使用元素週期表中的元素行號來確定元素價電子的能級的規則適用於 IA 族到 VIII A 族元素。但是,此規則*不*適用於 IB 族到 VIII B 族(也稱為 III 族到 XII 族)元素。元素週期表中較低部分的元素(元素週期表中第一個圖中“塗黑”的中間部分)被稱為**過渡金屬**。它們的性質有所不同,您不能像處理價電子一樣對它們應用相同的規則。元素週期表中孤立的較低部分(在上面的元素週期表圖中也“塗黑”了)也是如此。此塊包含被稱為*鑭系元素*和*錒系元素*的元素。與過渡金屬一樣,**鑭系元素和錒系元素**在價電子和價電子能級方面不遵循 IA 族到 VIII A 族元素的相同規則。
您可能注意到,在上一節中,我們根本沒有提到第一行。相反,我們總是從第二行開始。元素週期表中的第一行是“特殊行”,原因有很多。首先,元素週期表的第一行只包含兩個元素——氫和氦。你能弄清楚*為什麼*第一行只有兩個元素嗎?
根據我們在上一節中學到的知識,元素的行號對應於該元素價電子的能級。因此,第一行必須包含價電子位於 *n* = 1 能級的元素。到目前為止,您應該知道 *n* = 1 能級中只有一個軌道。當然,這個軌道是 1*s* 軌道。氫在 1s 軌道中有一個價電子(其電子排布為 1*s*1),而氦在 1s 軌道中有兩個價電子(其電子排布為 1*s*2)。由於 1*s* 軌道中不可能容納*超過*兩個電子,因此總共具有*三個或更多*電子的原子*必須*具有位於 *n* = 2 或更高能級的價電子。因此,很明顯,總共具有*三個或更多*電子的原子*不*屬於元素週期表的第一行。
元素週期表的第一行也是特殊的,因為其元素具有特殊的性質。例如,氫不像 IA 族中的其他元素那樣是金屬。相反,氫原子相互反應,形成稱為*氫氣*的 H2。正如在上一課中提到的,一些科學家會將氫歸為一類,而不是將其放在 IA 族的頂部。我們在這裡不做這種操作,但您應該始終牢記氫是“不同的”,並且您不應該將氫的化學性質與其他 IA 族元素的化學性質進行比較。
氦也是一種特殊的原子。你可能想知道為什麼氦出現在元素週期表的最右邊,而不是緊挨著氫。同樣,氦在元素週期表中的位置反映了它特殊的化學性質。你之前學過 VIII A 族元素是“惰性”的,其中包括氦。即使氦只有兩個價電子,而其他 VIII A 族元素有八個價電子,氦也被放置在 VIII A 族的最上面,因為氦的化學行為與其他惰性氣體的化學行為相似,因為它具有完整的外部能量層。
到目前為止,我們知道,除了過渡金屬、鑭系元素和錒系元素之外,我們可以利用元素所在的行來確定該元素價電子的能級。元素週期表的結構和元素在週期表中的位置還能告訴我們關於元素電子構型的其他資訊嗎?答案是“是的”。記住,IA 族和 IIA 族元素中能量最高的價電子始終位於 *s* 軌道。事實上,IA 族和 IIA 族元素中唯一的價電子都位於 *s* 軌道!例如,鋰 (Li) 的電子構型為 1*s*22*s*1。注意,鋰的單個價電子位於 *s* 軌道。同樣,鎂 (Mg) 的電子構型為 1*s*22*s*22*p*63*s*2。同樣,注意鎂的兩個價電子都位於 *s* 軌道。由於 IA 族和 IIA 族元素的所有價電子都存在於 *s* 軌道,因此元素週期表的前兩列(IA 族和 IIA 族)被稱為“*s* 亞層塊”。*s* 亞層塊如下圖所示。注意,*s* 亞層塊包括從 Li 到 Fr 的所有金屬,以及從 Be 到 Ra 的所有金屬。氫不包括在 *s* 亞層塊中,同樣,這是因為它具有特殊的性質。

對於 IIIA 族到 VIIIA 族元素,我們能說什麼?特別是,我們能對能量最高的價電子說什麼?如果你仔細觀察,你會發現,對於 IIIA 族到 VIIIA 族(或者如果你喜歡,13 族到 18 族)元素,能量最高的價電子始終位於 *p* 軌道。例如,硼 (B) 的電子構型為 1*s*22*s*22*p*1。雖然硼既有 2*s* 也有 2*p* 價電子,但 2*p* 價電子的能量更高。同樣,氪 (Kr) 的電子構型為 1*s*22*s*22*p*63*s*23*p*64*s*23*d*104*p*6。同樣,雖然氪既有 4*s* 也有 4*p* 價電子,但 4*p* 價電子的能量更高。由於 IIIA 族到 VIIIA 族元素的能量最高的價電子都存在於 *p* 軌道,因此元素週期表的最後六列(IIIA 族到 VIIIA 族)被稱為“*p* 亞層塊”。*p* 亞層塊如下圖所示。此外,如以下圖所示,*p* 亞層塊包括從 B 到 Tl 的所有元素,從 C 到 Pb 的所有元素,從 N 到 Bi 的所有元素,從 O 到 Po 的所有元素,從 F 到 At 的所有元素,最後,從 Ne 到 Rn 的所有元素。氦不包括在 *p* 亞層塊中,這應該是有道理的,因為氦沒有 *p* 電子!

正如元素週期表有 *s* 亞層塊和 *p* 亞層塊一樣,它也有*d* 亞層塊和*f* 亞層塊。在 *d* 和 *f* 亞層塊中定義價電子可能更困難,但一般來說,*d* 亞層塊中大多數高能價電子都位於 *d* 軌道,而 *f* 亞層塊中大多數高能價電子都位於 *f* 軌道。
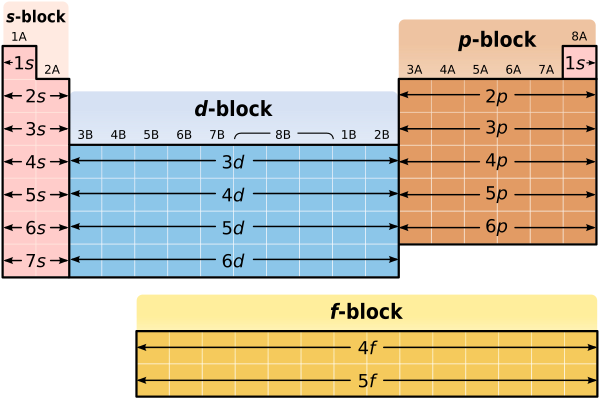
你之前學過元素週期表是總結科學家對我們世界中不同元素的所有了解的便捷方法。元素週期表可能對你來說看起來很奇怪,因為你無法理解它的形狀和結構意味著什麼。但是,現在我們已經討論了電子軌道和電子能級,元素週期表就不應該再顯得那麼奇怪了。事實上,元素週期表的形狀實際上反映了不同元素的原子中電子的組織方式。
- 對於 IA 族、IIA 族、IIIA 族、IVA 族、VA 族、VIA 族、VIIA 族和 VIIIA 族元素,元素所在的行列對應於該元素價電子的能級。例如,鋰 (Li) 位於第二行,其價電子位於 *n* = 2 能級。
- 你可以使用元素在元素週期表中的行號來預測元素價電子的能級。
- 第一行的元素具有特殊的性質。
- 氫不是鹼金屬,通常以氣體的形式存在。
- 氦是惰性氣體,表現出與 VIIIA 族中其他惰性氣體相似的化學性質。
- 元素週期表可以分為 *s*、*d*、*p* 和 *f* 亞層塊。
- *s* 亞層塊中的元素的所有價電子都位於 *s* 軌道。
- *p* 亞層塊中的元素的能量最高的價電子都位於 *p* 軌道。
- 使用元素週期表確定以下每個元素的價電子的能級。
- (a) B
- (b) Ga
- (c) Rb
- (d) At
- (e) He
- 填空
- (a) B 位於元素週期表的 __ 亞層塊
- (b) Sr 位於元素週期表的 __ 亞層塊
- (c) Fe 位於元素週期表的 __ 亞層塊
- (d) Cs 位於元素週期表的 __ 亞層塊
- (e) O 位於元素週期表的 __ 亞層塊
- 使用元素週期表確定以下每個元素中能量最高的電子的能級和亞層
- (a) N
- (b) Ca
- (c) Rb
- (d) P
- (e) In
- 判斷以下每個說法是正確還是錯誤。
- (a) Li 的價電子位於 *n* = 1 能級。
- (b) Si 的價電子位於 *n* = 3 能級。
- (c) Ga 的價電子位於 *n* = 3 能級。
- (d) Xe 的價電子位於 *n* = 5 能級。
- (e) P 的價電子位於 *n* = 2 能級。
- 將元素與其所在的亞層塊匹配起來
(a) C i. *s* 亞層塊 (b) Cs ii. *p* 亞層塊 (c) Ce iii. *d* 亞層塊 (d) Cr iv. *f* 亞層塊
- 元素週期表的第一行有
- (a) 1 個元素
- (b) 2 個元素
- (c) 3 個元素
- (d) 4 個元素
- (e) 5 個元素
- 使用元素週期表確定以下元素中哪個元素的能量最高的價電子。
- (a) Sr
- (b) As
- (c) H
- (d) At
- (e) Na
- 使用元素週期表確定以下元素中哪個元素的能量最低的價電子。
- (a) Ga
- (b) B
- (c) Cs
- (d) Bi
- (e) Cl
- *d* 亞層塊的第一行對應哪個能級?
- *d* 亞層塊
- 元素週期表中 IB 族到 VIIIB 族(也稱為過渡金屬)的元素。
- *f* 亞層塊
- 元素週期表中鑭系元素和錒系元素行的元素。
- 惰性
- 不反應的。
- 鑭系元素和錒系元素
- 元素週期表中 *f* 亞層塊的元素。鑭系元素和錒系元素中能量最高的電子位於 *f* 軌道。
- 惰性氣體
- VIIIA 族元素。這些元素位於元素週期表的第八列。它們是惰性的,這意味著它們很不活潑。
- *p* 亞層塊
- 元素週期表中 IIIA 族到 VIIIA 族(不包括氦)的元素。*p* 亞層塊的元素的能量最高的價電子都位於 *p* 軌道。
- *s* 亞層塊
- 元素週期表中 IA 族和 IIA 族(不包括氫)的元素。*s* 亞層塊的元素的所有價電子都位於 *s* 軌道。
- 過渡金屬
- 元素週期表中 *d* 亞層塊(第 1B 到第 8B 族)中的元素。過渡金屬中能量最高的電子位於 *d* 軌道。
此材料改編自原始 CK-12 圖書,可在此處找到 此處。此作品根據知識共享署名-相同方式共享 3.0 美國許可協議進行許可






















