無機化學/化學鍵/路易斯點結構
路易斯結構,也稱為路易斯點圖,是顯示分子中原子之間鍵合以及分子中可能存在的孤對電子的圖。 [1][2] 可以為任何共價鍵合的分子以及配位化合物繪製路易斯結構。 路易斯結構以吉爾伯特·N·路易斯命名,他在 1916 年的論文《原子與分子》中引入了它 [3]。 它們類似於電子點圖,因為孤對中的價電子用點表示,但它們也包含線來表示化學鍵中的共享對(單鍵、雙鍵、三鍵等)。
路易斯的結構使用其化學符號顯示分子結構中的每個原子。 在彼此鍵合的原子之間繪製線條(很少情況下,使用點對代替線條)。 形成孤對的剩餘電子用點對錶示,並放置在原子旁邊。

對於包含多個元素且公式中只有一個原子的化合物,中心原子是電負性最低的單個原子,而不是氫原子。 例如,在亞硫醯氯(SOCl2)中,硫原子是中心原子。
初始的路易斯結構應該以每個非中心原子透過單鍵連線到中心原子來繪製,儘管並非所有原子都需要連線以顯示鍵。
在某些情況下,中心原子很難確定,通常是當每個元素出現不止一次時。 在這些情況下,結構的連線性——也就是說,確定哪些原子連線到哪些其他原子——必須透過反覆試驗或先驗知識來確定。
當中心原子已知或確定時,可以以完全相同的方式繪製路易斯結構。
路易斯結構中表示的電子總數等於每個單個原子上的價電子數之和。 非價電子在路易斯結構中沒有表示。
八隅體規則指出,價電子層中具有八個電子的分子將是穩定的,無論這些電子是成鍵的還是非成鍵的。 該規則適用於有機化合物。 18 電子規則適用於週期 4 中的原子,它們必須達到 18 個電子才能填滿其軌道並獲得惰性氣體構型。 同樣,週期 6 中的原子必須達到 32 個電子才能填滿其軌道。
一旦確定了可用電子的總數,就必須將電子放置到結構中。 它們應該首先被放置為孤對:每對可用電子放置一對點。 孤對應該首先放置在外原子(除了氫以外)上,直到每個外原子在成鍵對和孤對中具有八個電子; 額外的孤對然後可以放置在中心原子中。 有疑問時,孤對應該首先放置在電負性更強的原子中。
一旦所有孤對都放置完畢,原子(尤其是中心原子)可能沒有八個電子的八隅體。 在這種情況下,原子必須形成雙鍵; 一對孤對電子被移動以形成兩個原子之間的第二個鍵。 由於成鍵對在兩個原子之間共享,因此最初具有孤對的原子仍然具有八隅體; 另一個原子現在在其價電子層中多了兩個電子。
除了有機化合物外,只有少數化合物在其價電子層中具有八個電子的八隅體。 不完整的八隅體對於第 2 族和第 13 族元素的化合物(例如鈹、硼和鋁)很常見。 在路易斯表示中原子價電子層具有超過八個電子的化合物被稱為超價化合物,對於第 15 族至第 18 族元素(例如磷、硫、碘和氙)很常見。
多原子離子的路易斯結構可以透過相同的方法繪製。 在計算電子時,負離子應該在其路易斯結構中放置額外的電子; 正離子應該比中性分子具有更少的電子。
當離子路易斯結構被寫出時,整個結構被放置在方括號中,電荷被寫為方括號外部右上角的上標。
已經提出了一種更簡單的方法來構建路易斯結構,消除了對電子計數的需要:原子被繪製出來顯示價電子,然後透過將參與成鍵過程的原子的價電子配對來形成鍵,陰離子和陽離子透過向適當的原子新增或移除電子來形成。 [4]
就路易斯結構而言,形式電荷用於描述、比較和評估可能的拓撲結構和共振結構 [5] 透過確定每個原子內的表觀電子電荷,基於其電子點結構假設排他共價性或非極性鍵合。 它在確定涉及反應機理的可能電子重新配置方面有用途,並且通常導致與原子的部分電荷相同的符號,但也有例外。 通常,原子的形式電荷可以使用以下公式計算,假設對使用的標記使用了非標準定義
其中
- 是形式電荷。
- 表示元素自由原子中的價電子數。
- 表示原子中未共享的電子數。
- 表示原子與另一個原子形成的鍵的總數。
原子的形式電荷計算為中性原子具有的價電子數與它在路易斯結構中所具有的電子數之差。共價鍵中的電子在參與鍵合的原子之間平均分配。離子上的形式電荷總和應該等於離子的電荷,而中性分子上的形式電荷總和應該等於零。
對於某些分子和離子,很難確定哪些孤對電子應該移動以形成雙鍵或三鍵。當相同型別的多個原子圍繞中心原子時,這種情況有時會發生,對於多原子離子尤其常見。
當出現這種情況時,該分子的路易斯結構被稱為共振結構,該分子以共振雜化體的形式存在。不同的可能性疊加在一起,並且認為該分子具有等效於這些狀態平均值的路易斯結構。
例如,硝酸根離子 (NO3-) 必須在氮和其中一個氧之間形成雙鍵以滿足氮的八隅體規則。但是,由於該分子是對稱的,因此哪個氧形成雙鍵並不重要。在這種情況下,存在三種可能的共振結構。在繪製路易斯結構時表達共振可以使用以下兩種方法:繪製每個可能的共振形式並在它們之間放置雙箭頭,或者使用虛線表示部分鍵。
在比較同一分子的共振結構時,通常那些形式電荷最少的結構對總共振雜化體的貢獻更大。當需要形式電荷時,那些在電負性更大的元素上帶負電荷,在電負性更小的元素上帶正電荷的共振結構更受青睞。
在路易斯共振結構中,該結構被寫成似乎該分子可以在多種形式之間切換。但是,該分子本身以這些形式的混合體存在。
以硝酸根離子為例,每種共振形式都有兩個單鍵和一個雙鍵。但是,當檢查硝酸根離子時,每個鍵似乎都有 1.333 的鍵序——也就是說,每個鍵都具有好像由一個三分之一的總鍵組成的性質。每個鍵的長度和鍵能介於單鍵和雙鍵之間。
不應該將共振結構解釋為該分子在形式之間切換,而是該分子作為多種形式的平均值起作用。
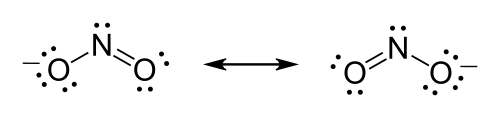
亞硝酸根離子的化學式為 NO2−。
第一步:氮是電負性最強的原子,因此根據多種標準它是中心原子。
第二步:計算價電子。氮有 5 個價電子;每個氧有 6 個,總共 (6 × 2) + 5 = 17 個。該離子帶 -1 電荷,表示有一個額外的電子,因此電子總數為 18 個。
第三步:放置離子對。每個氧必須與氮鍵合,這將使用 4 個電子——每個鍵中 2 個。剩下的 14 個電子應該最初被放置為 7 個孤對。每個氧最多可以接受 3 個孤對,使每個氧包含 8 個電子,包括鍵合對。第七個孤對必須放置在氮原子上。
第四步:滿足八隅體規則。兩個氧原子目前都分配了 8 個電子。氮原子只分配了 6 個電子。氧原子上的一個孤對必須形成雙鍵,但兩個原子都同樣有效。因此,我們必須有一個共振結構。
第五步:處理鬆散的結尾。必須繪製兩個路易斯結構:一個與每個氧原子雙鍵與氮原子鍵合。每個結構中的第二個氧原子將與氮原子單鍵鍵合。在每個結構周圍放置方括號,並將電荷 (-) 新增到方括號外面的右上角。在兩種共振形式之間繪製雙箭頭。



化學結構可以用更緊湊的形式寫出,尤其是在顯示有機分子時。在縮寫結構式中,許多甚至所有共價鍵都可能被省略,下標表示連線到特定原子的相同基團的數量。另一種簡寫結構圖是骨架式(也稱為鍵線式或碳骨架圖)。在骨架式中,碳原子不用 C 符號表示,而是用線的頂點表示。與碳鍵合的氫原子沒有顯示出來——它們可以透過計算特定碳原子的鍵合數量來推斷——假設每個碳都有四個鍵,因此任何未顯示的鍵都隱含地與氫原子鍵合。
其他圖表可能比路易斯結構更復雜,使用各種形式(例如空間填充圖)以 3D 方式顯示鍵。
- ↑ Zumdahl, S. (2005) 化學原理 Houghton-Mifflin ISBN 0-618-37206-7
- ↑ Miessler, G. L.、Tar, D. A. (2003) “無機化學” 第 2 版 Pearson Prentice-Hall ISBN 0-130-35471-6
- ↑ Lewis, G. N. 原子和分子。J. Am. Chem. Soc. 1916, 38, 762-785. doi:10.1021/ja02261a002
- ↑ 為非科學專業人士簡化路易斯結構繪製 Miburo, Barnabe B. J. Chem. Educ. 1992 75 317. 連結
- ↑ Miessler, G. L.、Tar, D. A. (2003),第 53 頁——對形式電荷使用說明的解釋。





