無機化學/化學鍵/MO圖
分子軌道圖或簡稱為MO圖,是一種定性的描述工具,它根據分子軌道理論,特別是原子軌道線性組合分子軌道方法(LCAO方法),解釋分子中的化學鍵合。[1][2][3] 該工具非常適合用於簡單的雙原子分子,如雙氫、雙氧和一氧化碳,但在討論多核分子(如甲烷)時變得更加複雜。它解釋了為什麼某些分子存在而另一些不存在,鍵的強度如何以及電子躍遷發生的方式。
最小的分子,氫氣以雙氫(H-H)的形式存在,兩個氫原子之間有一個共價鍵。由於每個氫原子只有一個1s原子軌道,因此該鍵由這兩個原子軌道的重疊形成。在圖1中,兩個原子軌道分別描繪在左側和右側。縱軸始終代表軌道能量。原子軌道能量與電負性相關,因為電負性更強的原子更牢固地抓住電子,從而降低其能量。MO處理僅在原子軌道具有可比能量時才有效;當它們差異很大時,鍵合方式變為離子鍵。每個軌道僅被一個電子佔據,向上和向下的箭頭表示一個電子。

這兩個AO可以根據它們的相位關係以兩種方式重疊。軌道的相位是電子振盪、波動性質的直接結果。在圖形表示中,軌道相位用加號或減號表示(令人困惑,因為它們與電荷無關),或者簡單地用陰影表示。相位的符號本身沒有物理意義,除非將軌道混合形成分子軌道。
然後,兩個同號軌道發生相長重疊,形成一個分子軌道,其大部分電子密度位於兩個原子核之間。這個MO被稱為成鍵軌道,其能量低於原始原子軌道的能量。該軌道相對於繞分子軸旋轉是對稱的(沒有變化),因此也被稱為sigma鍵(σ鍵)。
兩個氫原子也可以透過它們的1s軌道異相相互作用,這會導致相消干涉,並且兩個原子核之間沒有電子密度,這由所謂的節點平面(垂直虛線)表示。在這個反鍵MO中,能量遠高於原始AO,電子位於指向中心軸的葉片中。像成鍵軌道一樣,該軌道是對稱的,但與成鍵軌道不同,它用星號表示σ*鍵
構建MO圖的下一步是將電子填充到分子軌道中。以雙氫為例,兩個電子必須分佈在一個成鍵軌道和一個反鍵軌道上。三個一般規則適用
- 泡利不相容原理指出,軌道從最低能量開始填充
- 泡利不相容原理指出,佔據一個軌道的最大電子數為兩個,且自旋相反
- 洪特規則指出,當存在多個具有相同能量的MO時,電子一次填充一個MO。
將這些規則應用於雙氫,結果是兩個電子都在成鍵MO中。這個MO被稱為最高佔據分子軌道或HOMO,這使得另一個軌道成為最低未佔據分子軌道或LUMO。鍵MO中的電子稱為成鍵電子,反鍵軌道中的任何電子稱為反鍵電子。這些電子能量的降低是化學鍵形成的驅動力。為了使鍵合存在,鍵級定義為
必須大於0。雙氫的鍵級為(2-0)/2 = 1。
這個MO圖也有助於解釋鍵是如何斷裂的。當對雙氫施加能量時,當成鍵MO中的一個電子被提升到反鍵MO時,就會發生分子電子躍遷。結果是,不再有淨能量增益。
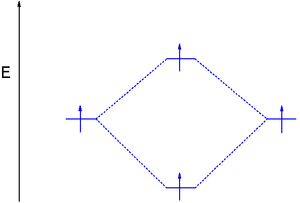
雙氦(He-He)是一個假設的分子,MO理論有助於解釋其不存在的原因。雙氦的MO圖(每個1s AO中有2個電子)看起來與雙氫的MO圖非常相似,但現在需要將4個電子而不是2個電子放入新形成的分子軌道中。

唯一能做到這一點的方法是也用兩個電子佔據反鍵軌道,這會將鍵級((2-2)/2)降低到零,並抵消淨能量穩定。
另一個基於此原理不存在的分子是雙鈹(鈹的電子構型為1s22s2)。另一方面,透過從雙氦中移除一個電子,形成了穩定的氣相物種He2+離子,其鍵級為1/2。
接下來是元素週期表中的鋰,MO理論正確地預測雙鋰是一個穩定的分子,其鍵級為1。1s MO完全填充,不參與鍵合。

雙鋰是一種氣相分子,其鍵強度遠低於雙氫,因為2s電子距離原子核更遠。
雙硼(B-B 電子構型硼:1s22s22p1)的MO圖需要引入p軌道原子軌道重疊模型。三個啞鈴形的p軌道具有相同的能量,並且相互垂直(或正交)。x方向上排列的p軌道(px)可以發生端對端重疊,形成成鍵(對稱)σ軌道和反鍵σ*分子軌道。與σ1s MO不同,σ2p在原子核的兩側都具有一些電子密度,其相位(藍色)與原子核之間的電子密度(白色)相反。σ*2p在原子核之間也具有一些電子密度。(請注意,在本圖中,σ*2p軌道的相位[顏色]略有不正確:電子密度的右手葉片的相位應互換,以便顏色為藍色、白色、藍色、白色。)

另外兩個p軌道py和pz可以側面重疊。形成的成鍵軌道具有兩個香腸狀的電子密度,位於分子平面的上方和下方。該軌道圍繞分子軸不對稱,因此是π軌道。反鍵π軌道(也不對稱)具有四個指向遠離原子核的葉瓣。py和pz軌道都形成一對能量相等(簡併)的π軌道,它們可能高於或低於σ軌道的能量。
在二硼中,1s和2s電子不參與成鍵,但2p軌道中的單個電子佔據2πpy和2πpz分子軌道,導致鍵級為1。由於電子具有相同的能量(簡併),因此二硼是一種雙自由基,並且由於自旋平行,因此該化合物是順磁性的。

與二硼類似,二碳(C-C電子構型:1s22s22p2)是一種反應性氣相分子。兩個額外的電子被放置在2πp分子軌道中,使鍵級增加到2。二氮的鍵級為3,因為現在在2σ分子軌道中也添加了兩個電子。
雙氧的分子軌道處理與之前的雙原子分子不同,因為pσ分子軌道現在比2π軌道能量更低。這歸因於2s分子軌道與2pz分子軌道之間的相互作用。[4] 在6個分子軌道上分配8個電子,使最後的兩個電子成為2pπ*反鍵軌道的簡併對,導致鍵級為2。與二硼一樣,這種型別的雙氧被稱為三線態氧,是一種順磁性雙自由基。當兩個HOMO電子配對時,另一種氧型別被稱為單線態氧。

鍵級降低,鍵長增加的順序為O2+(112.2 pm)、O2(121 pm)、O2-(128 pm)和O22-(149 pm)。[4]
在雙氟中,兩個額外的電子佔據2pπ*,鍵級為1。在雙氖Ne2(與雙氦一樣),成鍵電子的數量等於反鍵電子的數量,因此該化合物不存在。
- ↑ 有機化學. Jonathan Clayden, Nick Greeves, Stuart Warren和Peter Wothers 2001 ISBN 0-19-850346-6
- ↑ 有機化學, 第三版 Marye Anne Fox James K. Whitesell 2003 ISBN 978-0-7637-3586-9
- ↑ 有機化學 第3版. 2001 Paula Yurkanis Bruice ISBN 0-13-017858-6
- ↑ a b 現代無機化學 William L. Jolly 1985 ISBN 0-07-032760-2

