關於進行多組分質量平衡最重要的一點是,對於每個組分,您可以編寫一個獨立的質量平衡方程。我所說的獨立是什麼意思?好吧,請記住,我們可以為任何穩態系統編寫一般的整體質量平衡方程

我們還可以為流中的任何組分編寫類似的質量平衡方程

這看起來我們這裡有三個方程,但實際上只有兩個是獨立的,因為
- 組分的質量總和等於總質量
- 由於反應引起的總質量生成始終為零(根據質量守恆定律)
因此,如果我們將所有組分的質量平衡加起來,我們將得到整體質量平衡。因此,我們可以選擇我們想要的任何一組 n 個方程,其中 n 是組分的數量,但如果我們選擇整體質量平衡作為其中之一,我們就不能使用其中一個組分的質量平衡。
使用哪些平衡取決於兩個特定標準
- 您擁有關於哪個組分的資訊最多;如果您沒有足夠的資訊,您將無法解決您編寫的方程。
- 您可以對哪個組分做出最合理的假設。例如,如果您有一個在低溫和低壓下涉及氧氣和水的過程,您可以說液體流中沒有溶解氧,因此它都透過另一條路徑離開。如果您針對該組分編寫質量平衡,這將大大簡化代數運算。
示例:
假設包含乙醇和水(兩種完全互溶的化合物)的物流以 100 kg/s 的速率流入蒸餾塔。有兩股物流離開塔:蒸汽物流中乙醇的質量分數為 80%,塔底液物流中乙醇的濃度為 4M。總液物流流量為 20 kg/s。計算入口物流的組成。
按照分步方法可以使事情變得更容易。
第一步始終是繪製流程圖,如前所述。如果您對該系統執行此操作,您可能會得到如下所示的結果,其中 x 表示質量分數,[A] 表示 A 的摩爾濃度,數字表示物流編號。
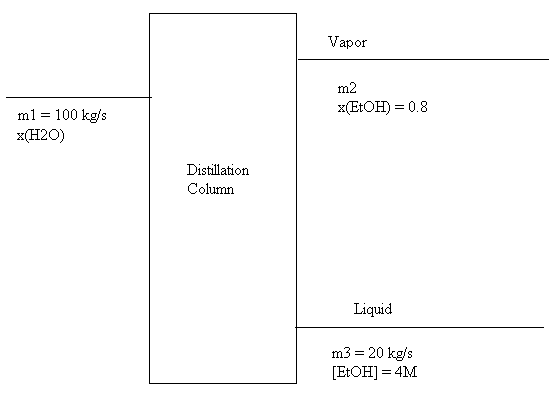
現在,我們需要將濃度轉換為合適的單位。由於總流量以質量表示,因此以組分質量表示濃度的單位將最有用。蒸汽物流組成以質量百分比給出,這與流量單位配合良好。但是,以摩爾濃度給出的液相濃度對於求解乙醇(或水)的質量流量沒有用。因此,我們必須將濃度轉換為更有用的東西。
|
注意
濃度測量之間的轉換 在濃度之間轉換最簡單的方法是仔細檢視您想要和擁有的單位,並詢問可以使用哪些物理性質(即摩爾質量、密度)來進行互換。在本例中,我們希望將摩爾濃度轉換為質量分數。根據定義,我們有 ![{\displaystyle [A]={\frac {mol_{A}}{L_{sln}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12cae0ffd5391b511141e597b359a51198002919)

要轉換分子,我們需要將 A 的摩爾數轉換為 A 的質量,因此我們可以為此目的使用摩爾質量。類似地,要轉換分母,我們需要將升轉換為質量,這意味著我們將使用密度。因此,從摩爾濃度到質量分數的轉換是 ![{\displaystyle x_{A}=[A]*{\frac {(MW)_{A}}{{\rho }_{SLN}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90dce5850a67c5e76032cf56b356a0d9ff709311)
由於我們有方法估計 (還記得它們嗎?),我們可以相互轉換這些濃度。 (還記得它們嗎?),我們可以相互轉換這些濃度。
|
為了將摩爾濃度轉換為質量分數,我們需要乙醇的分子量和4M乙醇溶液的密度。如果你知道乙醇的化學式,前者很容易計算: 。根據化學課上學習的方法計算分子量,你應該得到大約
。根據化學課上學習的方法計算分子量,你應該得到大約 。
。
計算密度本身就涉及到代入質量分數,所以你最終會得到一個隱式方程。回想一下,估計溶液密度的一種方法是假設溶液是理想的(在這種情況下它可能不是理想的,但如果沒有資料可用或者我們只需要一個估計值,那麼像這樣的假設是我們僅有的選擇,只要我們意識到這些值不會完全準確)。

在這種情況下,則

我們可以查閱純水和純乙醇的密度,如下所示(來自維基百科的條目w:Ethanol和w:Water)


因此,由於質量分數之和為1,我們關於密度的方程變為

根據上面的註釋,我們現在終於可以將摩爾濃度轉換為質量分數,如下所示
![{\displaystyle x_{EtOH}=[EtOH]*{\frac {(MW)_{EtOH}}{{\rho }_{SLN}}}=4{\frac {mol}{L}}*46{\frac {g}{mol}}*({\frac {x_{EtOH}}{789{\frac {g}{L}}}}+{\frac {1-x_{EtOH}}{1000{\frac {g}{L}}}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9742817f79fb2e374f314978b15f433bbe02275f)
求解該方程得到
 (無量綱)
(無量綱)
由於我們正在尋找與質量流量相關的性質,因此我們需要用質量平衡來關聯我們的變數。
請記住,我們可以對任何 N 個獨立組分進行質量平衡,以及對總質量進行一個質量平衡,但由於各個組分的質量之和等於總質量,因此只有 個這些方程是獨立的。在數學上,選擇總質量平衡和
個這些方程是獨立的。在數學上,選擇總質量平衡和 個單獨的組分平衡通常是最簡單的,因為您不需要處理總測量值的濃度。
個單獨的組分平衡通常是最簡單的,因為您不需要處理總測量值的濃度。
由於我們的濃度現在處於適當的單位,因此我們可以進行任何兩個質量平衡。讓我們首先選擇總質量平衡

代入已知值


現在我們知道了 ,我們可以對乙醇或水進行質量平衡以找到進料流的組成。讓我們選擇乙醇(A)
,我們可以對乙醇或水進行質量平衡以找到進料流的組成。讓我們選擇乙醇(A)

用質量分數表示,則變為

代入我們已知的資訊


因此,進料為 68% 乙醇和 32% 水。



![{\displaystyle [A]={\frac {mol_{A}}{L_{sln}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12cae0ffd5391b511141e597b359a51198002919)

![{\displaystyle x_{A}=[A]*{\frac {(MW)_{A}}{{\rho }_{SLN}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90dce5850a67c5e76032cf56b356a0d9ff709311)








![{\displaystyle x_{EtOH}=[EtOH]*{\frac {(MW)_{EtOH}}{{\rho }_{SLN}}}=4{\frac {mol}{L}}*46{\frac {g}{mol}}*({\frac {x_{EtOH}}{789{\frac {g}{L}}}}+{\frac {1-x_{EtOH}}{1000{\frac {g}{L}}}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9742817f79fb2e374f314978b15f433bbe02275f)









