無機化學導論/酸鹼化學


酸和鹼在無機化學中很重要,原因有很多。
- 許多工業上有用的催化反應涉及無機酸和 超強酸,例如沸石、無水氫氟酸和硫酸化氧化鋯。這些酸在無水介質中足夠強,可以質子化烯烴和醇,生成碳正離子。 碳正離子 是烴類轉化過程中的關鍵中間體。
- 無機化合物有時在強酸性或鹼性介質中合成。例如,三元金屬氧化物可以在熔融 NaOH 或 KOH(強鹼)中合成和結晶。有機氟化反應通常在強酸性介質中進行,例如無水 HF。瞭解酸和鹼在水中的熟悉化學原理有助於我們瞭解這些非水介質的工作原理。
- 金屬離子的酸性或鹼性環境會影響其氧化態的穩定性。我們將在第 4 章中進一步瞭解這一點。
- 過渡金屬配合物(配位化合物和有機金屬化合物)本質上是路易斯酸鹼配合物。透過考慮金屬和配體的酸鹼性質,我們可以瞭解很多關於它們的穩定性和反應性的資訊。我們將在第 5 章中學習這方面的知識。
第 3 章的學習目標
- 瞭解布朗斯特和路易斯酸鹼的定義。
- 識別共軛酸和鹼,以及布朗斯特和路易斯酸鹼體系中強酸/強鹼和弱酸/弱鹼的規則。
- 使用鮑林規則預測含氧酸的 pKa。
- 瞭解酸性、鹼性和兩性化合物的週期性趨勢。
- 預測、描述和解釋非水體系中的酸鹼化學,包括酸性和鹼性溶劑、非質子溶劑和熔鹽。
- 將酸鹼化學原理應用於具有目標功能的分子和路易斯酸的設計。
- 瞭解酸鹼化學與氧化態穩定性之間的聯絡。
- 使用硬軟酸鹼 (HSAB) 理論預測有利的和穩定的化合物。
- 瞭解 ECW 模型的應用。

酸和鹼的三種理論。 有三種主要的物質分類被稱為酸或鹼。阿倫尼烏斯定義指出,酸在溶液中產生 H+,鹼產生 OH-。該理論由 斯萬特·阿倫尼烏斯 於 1883 年提出。後來,人們提出了兩種更復雜、更通用的理論。它們是布朗斯特-勞裡酸鹼和路易斯酸鹼的定義。這些理論之間的關係在左圖中說明。
在酸鹼化學中,氫離子通常被稱為質子 (H+),並寫為 H+,但實際上它以多種水合形式存在,包括 H3O+、H5O2+、H7O3+。當我們寫 H+(aq) 或 H3O+(aq) 時,我們指的是這些質子化水形式的動態平衡混合物。
阿倫尼烏斯理論是最簡單、最不普遍的酸和鹼描述,包括 HClO4 等酸以及 NaOH 或 Mg(OH)2 等鹼。該理論成功地描述了酸和鹼如何相互反應生成水和鹽。然而,它並沒有解釋為什麼一些不含氫氧根離子的物質,例如 F- 和 NO2-,可以在水中形成鹼性溶液。布朗斯特-勞裡酸鹼的定義解決了這個問題。在這個理論中,酸是一種可以釋放質子的物質(就像在阿倫尼烏斯理論中一樣),而鹼是一種可以接受質子的物質。鹼性鹽(例如 Na+F-)透過從水本身(生成 HF)中奪取質子而在水中生成 OH- 離子
- F-(aq) + H2O(l) ⇌ HF(aq) + OH-
當布朗斯特酸解離時,它會增加溶液中氫離子濃度 [H+];相反,布朗斯特鹼透過從溶劑(水)中奪取質子解離,生成 [OH-]。
- 酸解離: HA(aq) ⇌ A-(aq) + H+(aq)
- Ka=[A-][H+]/[HA]
- 鹼解離: B(aq) + H2O(l) ⇌ HB+(aq) + OH-(aq)
- Kb = [HB+][OH-]/[B]
共軛酸和鹼。 這些平衡的一個重要結果是,每種酸 (HA) 都有一個共軛鹼 (A-),反之亦然。在上式中的鹼解離平衡中,鹼 B 的共軛酸是 HB+。
對於給定的酸或鹼,這些平衡由水解離平衡聯絡在一起
- H2O(l) ⇌ H+(aq) + OH−(aq)
- Kw = [H+][OH−]
該平衡常數 Kw 在 25°C 時為 1.00 × 10−14。可以很容易地證明酸和鹼解離常數 Ka 和 Kb 的乘積為 Kw。
強酸和弱酸,強鹼和弱鹼。 完全解離的酸和鹼被稱為強酸和強鹼
- HClO4(aq) → H+(aq) + ClO4−(aq)
- HBr(aq) → H+(aq) + Br−(aq)
- CH3O−(aq) + H2O(l) → CH3OH(aq) + OH−(aq)
- NH2−(aq) + H2O(l) → NH3(aq) + OH−(aq)
這裡的右箭頭 (→) 意味著反應進行到底。也就是說,1.0 M 的 HClO4 水溶液實際上包含 1.0 M H+(aq) 和 1.0 M ClO4−(aq),以及很少量的未解離的 HClO4。
相反,弱酸(如乙酸 (CH3COOH))和弱鹼(如氨 (NH3))在水中僅解離少量——通常為百分之幾,取決於它們的濃度以及 Ka 和 Kb 的值——並且主要以未解離的分子形式存在。

示例:家用氨是 NH3 在水中的溶液,重量百分比約為 5-10%。讓我們計算一下溶液的電離百分比和 pH 值。
對於重量百分比為 8% 的氨溶液,假設其密度與液態水相同,則氨的分析濃度為 (80 g/L) / (17 g/mol) = 4.7 M。
我們還需要知道另一個東西來解決這個問題,那就是鹼解離常數 Kb。
- NH3 + H2O ⇌ NH4+ + OH− Kb = 1.8 × 10−5
我們可以透過引用電荷平衡 ([H+] + [NH4+] = [OH−]) 和質量平衡 (4.7 M = [NH3] + [NH4+]) 並使用 Kw = [H+][OH−] 來嚴格地解決這個問題。但由於使用這種方法進行的代數運算會變得複雜——導致難以求解的三次方程——因此我們將引用兩個簡化假設
- [NH4+] ≈ [OH−] >> [H+] (這對鹼性溶液來說是一個合理的假設)
- 並且
- [NH3] >> [NH4+] (如果電離百分比很小,這也是合理的)
現在我們可以寫
- [NH4+][OH−] ≈ [OH−]2 = (4.7 M)(Kb) = 8.4 × 10−5
- [OH−] = 9.2 × 10−3 M (≈ [NH4+]),[H+] = Kw/[OH−]= 1.1 × 10−12 M,pH = 11.97
電離百分比為
- 100% x 9.2 x 10−3 M / 4.7 M = 0.19%
這個例子說明,將一瓶氨水標註為“氫氧化銨”在技術上是不正確的,因為只有大約 0.2% 的弱鹼以這種形式存在。
共軛酸和鹼。一個常見的誤解是強酸具有弱共軛鹼,弱酸具有強共軛鹼。記住 KaKb = Kw,很容易看出這是不正確的。我們對強酸或鹼的定義是 K >> 1,即該物質完全解離。我們對弱酸或鹼的定義是 1 > K > Kw。因此,如果 Ka >> 1(強),則 Kb 不能大於 Kw(弱)。
事實上,強酸如 HCl 解離產生旁觀離子如 Cl− 作為共軛鹼,而弱酸產生弱共軛鹼。下面以乙酸及其共軛鹼醋酸根離子為例說明。乙酸是弱酸(Ka = 1.8 x 10−5),醋酸根離子是弱鹼(Kb = Kw/Ka = 5.6 x 10−10)。
![]()
共軛酸/鹼的強度與其母體酸或鹼的強度或弱度成反比。任何酸或鹼在技術上也是共軛酸或共軛鹼;這些術語只是用來識別溶液中的物質(例如,乙酸是醋酸根離子的共軛酸,醋酸根離子是一種鹼,而醋酸根離子是乙酸的共軛鹼,乙酸是一種酸)。
中性含氧酸(H2SO4、H3PO4、HNO3、HClO2 等)可以根據萊納斯·鮑林首先提出的簡單規則分為強酸或弱酸。如果氧原子數比氫原子數多兩個或更多,則該酸為強酸;否則為弱酸。例如,HClO4 和 HClO3 的差值分別為 3 和 2,都是強酸。HNO2 和 HClO2 都是弱酸,因為兩種情況下差值都為 1。對於弱酸,相對強度取決於此差值(例如,HClO2 是比 HOCl 更強的弱酸)以及中心原子的電負性(HOCl 比 HOI 強)。
可以捐贈多個質子的酸稱為多質子酸。例如,硫酸 H2SO4 是一種強酸,其共軛鹼恰好本身也是弱酸。這意味著水溶液中的每摩爾 H2SO4 都捐贈了超過 1 摩爾的質子。碳酸 (H2CO3) 和磷酸 (H3PO4) 是弱多質子酸。通常,多質子酸的連續 pKa 之間相隔約 5 個 pH 單位,因為隨著離子變得更負電荷,去除質子變得越來越困難。例如,磷酸的三個 pKa 為 2.15、7.20 和 12.35。

兩性化合物。有些物質可以同時作為酸和鹼。例如,水。H2O 分子既可以捐贈氫離子,也可以接受氫離子。這種性質使水成為一種兩性溶劑。在酸在溶液中解離的情況下,水充當鹼。相反,當鹼解離時,水充當酸。我們可以在 H2O 中製成的最強酸是 H+ (aq),我們可以在 H2O 中製成的最強鹼是 OH− (aq)。
兩性化合物的其他例子是位於週期表中金屬和非金屬元素之間的邊界上的元素的氧化物和氫氧化物。例如,氫氧化鋁 (Al(OH)3) 在中性 pH 下不溶,但在酸性環境中可以接受質子形成 [Al(H2O)6]3+,或者在鹼性環境中接受一個 OH− 離子形成 Al(OH)4− 離子。因此,氧化鋁溶於酸和鹼,但不溶於中性水。兩性氧化物的其他例子是 BeO、ZnO、Ga2O3、Sb2O3 和 PbO。增加金屬的氧化態透過從氧原子中吸取電子密度來增加其氧化物的酸性。因此,Sb2O5 是酸性的,但 Sb2O3 是兩性的。
溶劑水平效應。溶劑水平效應是指當強酸置於如 (但不限於) H2O 等溶劑中時發生的一種效應。由於強酸將其質子捐贈給溶劑,因此可能存在的最強酸是溶劑的共軛酸。在水溶液中,這是 H3O+。這意味著 HCl 和 HBr 等酸的強度在水中無法區分,因為它們都 100% 解離為 H3O+。在我們上面討論的共軛鹼的背景下,我們可以說 Cl− 和 Br− 都是水的旁觀離子:它們都不是強鹼,無法從 H3O+ 中接受質子。為了區分 HClO4 和 HCl 等強酸的酸性,或區分 CH3O− 和 NH2− 等強鹼的鹼性,我們通常必須在非水溶劑中進行操作,如下所述。
非水溶液。布朗斯臺德理論涵蓋了任何可以捐贈和接受 H+ 離子的溶劑型別,而不僅僅是水溶液。酸或鹼的強度取決於溶劑。非水酸鹼化學遵循與水中的酸和鹼類似的規則。例如,在液氨中,溶劑在以下反應中發生自解離:
- 2NH3(l) ⇌ NH4+ + NH2−
該平衡類似於水的自解離,但其平衡常數更小 (K ≈ 10−30)。類比於水,我們可以得出 NH4+ 是液氨中最強的酸,NH2− 是液氨中最強的鹼。由於氨是一種鹼性溶劑,它增強了溶解其中的物質的酸性,並抑制了它們的鹼性。例如,銨離子 (NH4+) 在水中是一種弱酸 (Ka = 6 x 10−10),但在氨中是一種強酸。同樣,乙酸在水中是弱酸,但在氨中是強酸。溶劑水平效應實際上使 HCl、CH3COOH 和 NH4Cl 在氨中都是強酸,它們的酸強度相同。
在水中發生水平效應的強酸在 HF 或無水乙酸等酸性溶劑中具有不同的酸強度。例如,HX 在乙酸 (CH3COOH) 中的酸解離涉及質子化溶劑形成其共軛酸 (CH3COOH2+) 和 X− 陰離子。由於 CH3COOH2+ 比 H3O+ 是一種更強的酸,因此陰離子 X−(在水中是旁觀離子)可以在 CH3COOH 中成為弱鹼
- HX + CH3COOH ⇌ CH3COOH2+ + X−
因此,酸性溶劑會放大那些不能在水中接受質子的物質的布朗斯臺德鹼性。相反,鹼性溶劑會放大那些不能將質子捐贈給 OH− 的物質的酸性。
非水溶劑的酸性和鹼性難以精確量化,但一個很好的相對測量值是漢密特酸度函式,Ho。Ho 根據亨德森-哈塞爾巴赫方程定義,類似於 pH
Ho = pKa + log([鹼]/[共軛酸])
對於非水溶劑,或對於溶解在本身不發生解離的溶劑中的酸性或鹼性化合物,Ho 是所討論的溶劑或化合物的 pH 的粗略測量值。無水 HF 和 H2SO4 的 Ho 值分別約為 -10 和 -12。
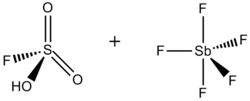
超強酸和超強鹼。術語超強酸最初是由詹姆斯·布萊恩特·科南特 在 1927 年創造的,用於描述比傳統無機酸更強的酸。[1] 喬治·奧拉 透過將五氟化銻 (SbF5) 和氟磺酸 (FSO3H) 混合,製備了所謂的魔酸,之所以這樣命名是因為它能夠攻擊碳氫化合物。這個名字是在將一根蠟燭放入魔酸樣品中後取的。蠟燭溶解了,表明該酸能夠質子化碳氫化合物,而在水性酸性條件下,碳氫化合物無法被質子化。
在 140 °C 下,FSO3H–SbF5 將甲烷轉化為叔丁基碳正離子,該反應以甲烷的質子化為起點:[2]
- CH4 + H+ → CH+5
- CH+5 → CH+3 + H2
- CH+3 + 3 CH4 → (CH3)3C+ + 3H2
氟銻酸,HSbF6,可以產生 H0 低至 –28 的溶液。[3] 氟銻酸是透過將 HF 和 SbF5 混合製成的。在這個體系中,HF 釋放其質子 (H+),同時 F− 與五氟化銻結合,五氟化銻(如下所述)是一種路易斯酸。由此產生的陰離子 (SbF6-) 既是弱親核試劑,又是極弱的鹼。
超強酸 在烷烴異構化等反應中很有用。在工業上,無水酸交換沸石(超強酸催化劑)在將原油加工成汽油的碳氫化合物異構化過程中大規模使用。 超強鹼,如二乙基鋰胺 (LiNEt2)、烷基鋰化合物 (RLi) 和格氏試劑 (RMgX) 在廣泛的有機反應中很有用。LiNEt2 去質子化 C-H 鍵以生成反應性碳負離子。RLi 和 RMgX 是強大的親核試劑。
在非水介質中使用超強鹼可以讓我們對不同型別分子的酸性進行排序(並測量它們的 pKa 值)。這種排序對於理解有機分子的反應尤為重要。需要注意的是,烴類酸性的順序是炔烴 >> 烯烴、芳烴 >> 烷烴。這種順序與形成碳負離子的碳原子的雜化方式有關。碳負離子的負電荷孤對電子在 s 特性高的軌道(例如 sp 與 sp2 或 sp3)中得到穩定。這是因為 s 軌道在原子核處具有有限的機率密度,並且比 p 軌道“感受”到更強的正核電荷(從而穩定碳上的額外負電荷)。共振效應也能穩定碳負離子。因此,環戊二烯的酸性甚至比炔烴還強,因為當 C5H6 去質子化時,負電荷會在整個(芳香族)C5H5- 環上離域。
| 名稱 | 化學式 | 結構式 | pKa |
|---|---|---|---|
| 甲烷 | CH4 | 
|
56 |
| 丙烯 | C3H6 | 44 | |
| 苯 | C6H6 | 43 | |
| 乙炔 | C2H2 | 
|
25 |
| 環戊二烯 | C5H6 | 
|
18 |
| 表 1. 碳酸在 pKa 在 DMSO [4] 中的酸性. | |||
熔融鹽中的酸鹼平衡。 當固體鹽熔化時,它會形成陽離子和陰離子的溶液。例如,KOH 在高於 400 °C 的溫度下熔化並解離成 K+ 和 OH- 離子,它們可以作為化學反應的溶劑。由於 OH- 溶劑的自身解離,根據酸鹼平衡,水中總是存在水
- 2 OH- ⇌ H2O + O2-
因此,在這種非常鹼性的溶劑中,水(溶劑的共軛酸)是存在的最強酸。溶劑的共軛鹼 O2- 是最強鹼。這種自身解離平衡允許透過新增或蒸發水輕鬆調節熔體的酸性。“溼”熔體更酸性,可以溶解含有鹼性 O2- 陰離子的金屬氧化物。相反,“幹”熔體更鹼性,會導致氧化物沉澱。因此,熔融氫氧化物熔體可用於合成氧化物晶體,例如鈣鈦礦超導體 (K1-XBaXBiO3)。[5]。NaOH 和 KOH 的低共熔混合物熔點相對較低(≈ 200 °C),可以用作結晶各種鹼性氧化物的溶劑。
路易斯酸和鹼
路易斯酸鹼分類比布朗斯特-勞裡定義更廣泛,涵蓋了更多物質。布朗斯特-勞裡和阿侖尼烏斯分類基於質子的轉移,而路易斯酸性和鹼性則基於電子對的共享。路易斯酸可以接受電子對,而路易斯鹼可以提供電子對。這個定義涵蓋了布朗斯特-勞裡定義,因為 H+ 是一個電子對接受體(當與鹼相互作用時),而鹼在其與 H+ 的相互作用中是一個電子對供體。下圖說明了氨的質子化過程。

三氟化硼 BF3 在與可以提供電子對的鹼性離子或分子結合時充當路易斯酸。下圖顯示了這樣的反應。
- BF3 + F- ⇌ BF4-
這裡,酸是 BF3,鹼是 F-。這種酸鹼反應允許硼(在 BF3 中電子不足)完成其八隅體。類似地,AlCl3 是一種路易斯酸,可以與 Cl-(一種路易斯鹼)反應生成路易斯“鹽”AlCl4-。注意,在水中,Cl- 是一個旁觀離子(比溶劑弱鹼性),在布朗斯特酸鹼反應中。
路易斯酸鹼反應的其他示例。在每個示例中,嘗試根據鹼是提供電子對的分子或離子的概念來確定酸、鹼和鹽。在你不確定的情況下,繪製分子的 VSEPR 結構可能會有所幫助
- I2 + I- ⇌ I3-
- AuCl3 + Cl- ⇌ [AuCl4]-
- Fe3+ + 6 H2O ⇌ [Fe(H2O)6]3+
- TiF4 + 2 F- ⇌ [TiF6]2-
- SF4 + SbF5 ⇌ “SSbF9”
在其他路易斯酸鹼反應中,酸和鹼都是分子,產物被稱為加合物。
- (CH3)3 B + N(CH3)3 →(CH3)3 B-N (CH3)3
- I2 + S(CH3)2 → I2-S(CH3)2
- C5N5N + Cu(HFacac)2 → C5N5N-Cu(HFacac)2
路易斯酸性是配位化學的基礎,我們將在第 5 章中更詳細地討論這個主題。這是因為配位化學涉及作為路易斯酸的金屬離子,它們與作為路易斯鹼的配體結合。
確定金屬離子路易斯酸的強度。金屬離子路易斯酸強度的三個決定因素
1. 金屬上正電荷越高,酸性越強。例如,Al3+ 和 Fe3+ 是良好的路易斯酸,它們的鹽在水中形成酸性溶液,但 K+ 和 Na+ 則不是。
2. 金屬離子的原子半徑越小,酸性越強。沿著週期表向下,金屬離子的路易斯酸性降低(例如,Al3+ > Ga3+ > In3+),因為離子半徑增大。
3. 對於過渡金屬離子,電負性更高的金屬往往形成更強的路易斯酸。電負性在 5d 系列的 W 和 Au 處達到最大值,因此週期表中該部分附近的金屬離子是良好的路易斯酸。
具有五配位幾何結構的分子(例如,PCl5、AsF5、SbF5)通常是強路易斯酸,因為當從鹼接受另一對電子時,它們會形成八面體分子或陰離子。兩種常見的五配位幾何結構(三角雙錐或四方錐)在堆積方面都不是有效的。路易斯酸鹼反應形成一個額外的鍵,其能量損失相對較小,僅需拉伸現有鍵即可。

由於 F- 是一個良好的路易斯鹼,也是一個小的陰離子,它可以與主族元素和過渡金屬形成穩定的八面體陰離子。因此,TiO2 和 SiO2 溶解在 HF 中(但與水溶液 HCl 和其他強酸不反應)
- TiO2 + 4 HF + 2 F- ⇌ TiF62- + 2 H2O
- SiO2 + 4 HF + 2 F- ⇌ SiF62- + 2 H2O

路易斯鹼穩定高氧化態。一個使用路易斯酸鹼化學驅動反應的有趣例子是氟氣(F2)的化學合成,該合成方法由 Karl O. Christe 於 1986 年提出。[6] Christe 當時正在組織一個研討會,紀念 Henri Moissan 分離元素氟 100 週年,Moissan 是在 1886 年透過電解無水 HF 溶液來完成的。100 年後,仍然沒有 F2 的直接(非電化學)合成方法。Christe 的反應方案包括兩個步驟。第一步是已知的由 KMnO4 合成 K2MnF6
- 4 MnO4-(aq) + 10 H2O(l) + 24 F-(aq) → 4 MnF62-(aq) + 3O2(g) + 20 OH-(aq)
- 2 K+(aq) + MnF62-(aq) → K2MnF6(s)
第二步是讓 K2MnF6 與強路易斯酸 SbF5 反應,生成亞穩態 MnF4,它會自發分解成 MnF3 和氟氣
- K2MnF6(s) + 2 SbF5(l) → 2 KSbF6(s)+ “MnF4”(s)
- “MnF4”(s) → MnF3(s) + 1/2 F2(g)
這個反應教會了我們關於酸鹼與氧化還原化學之間聯絡的一些有趣而重要的內容。酸傾向於穩定低氧化態,而鹼傾向於穩定高氧化態(我們將在第 4 章中討論 Pourbaix 圖時再次看到這一點)。在 K2MnF6 中,Mn 在 +4 氧化態下穩定,因為它被六個鹼性 F- 陰離子包圍。然而,Mn 的最高穩定中性氟化物是 MnF3,而 MnF4(從 K2MnF6 中短暫形成)會自發分解生成氟。
氧化物是比氟化物更好的鹼。有趣的是,Mn 可以失去所有價電子形成高錳酸根離子 MnO4- 中的 Mn7+。這裡,7+ 氧化態透過與四個 O2- 離子的配位以及 MnO4- 陰離子的整體 -1 電荷來靜電穩定。由於它的 2- 電荷,O2- 是比 F- 更強的鹼,也是穩定高氧化態的更好離子。這是過渡金屬中的一般趨勢:最高氧化態通常出現在氧化物中,而不是氟化物中,儘管 F 是比 O 更具電負性的元素。例如,Cr6+ 在 CrO42- 和 Cr2O72- 陰離子中穩定,但在任何中性氟化物或氟化物陰離子中都不穩定。+8 氧化態出現在 RuO4 和 OsO4 中,但在任何 Ru 或 Os 的氟化物中都不穩定。
3.2 硬酸和軟酸以及硬鹼和軟鹼
[edit | edit source]路易斯酸和鹼可以根據其是硬的還是軟的進行分類。
- 硬酸/硬鹼
- “硬”酸和鹼具有高電荷(酸為正,鹼為負)與離子半徑之比,以及更高的氧化態。硬酸不容易極化,具有高電荷密度。因此,具有高正電荷和較小離子尺寸的金屬離子往往是硬酸。3d 系列中的早期過渡金屬離子往往是硬路易斯酸。硬鹼通常是小的陰離子和中性分子。一些硬酸和鹼的例子包括:H+、O2-、OH-、F-、Fe3+ 和 Al3+。
- 軟酸/軟鹼
- “軟”酸或鹼具有低電荷與半徑之比,具有低氧化態。它們通常是更大的離子,是可極化的。例如,I- 和 S2- 是軟鹼,而低電荷密度過渡金屬,如 Ag+,被認為是軟酸。軟酸通常包括週期表第二行和第三行中帶 +1 或 +2 電荷的過渡金屬,以及具有填充或幾乎完全填充的d軌道的晚期過渡金屬(尤其是 4d 和 5d 系列中的金屬)。
酸和鹼並非嚴格地是硬的或軟的,許多離子化合物被歸類為中間體。例如,三甲基硼烷、Fe2+ 和 Pb2+ 陽離子是中間體酸,而吡啶和苯胺是中間體鹼的例子。元素的硬/軟性質也會隨著其氧化態的變化而改變。最極端的例子是氫,其中 H+ 是硬酸,而 H- 是軟鹼。Ni3+(如層狀化合物 NiOOH 中的 Ni3+)是硬酸,但 Ni0(如 Ni(CO)4 中的 Ni0)是軟酸。下圖顯示了週期表中酸(左)和鹼(右)的硬/軟趨勢。對於鹼而言,主要的硬/軟不連續性出現在第二行(N、O、F)和下面的行之間。


相似相吸
硬酸與硬鹼的相互作用比與軟鹼的相互作用更強,而軟酸與軟鹼的相互作用比與硬鹼的相互作用更強。因此,最穩定的配合物是那些具有硬硬和軟軟相互作用的配合物。下表說明了這種趨勢,該表顯示了硬酸和軟酸的形成常數的趨勢。硬酸以 F- > Cl- > Br- > I- 的順序結合鹵化物,而軟酸則遵循相反的趨勢。
Log K1 |
氟化物 |
氯化物 |
溴化物 |
碘化物 |
酸分類
|
|---|---|---|---|---|---|
Fe3+ |
6.0 |
1.4 |
0.5 |
- |
硬
|
Pb2+ |
1.3 |
0.9 |
1.1 |
1.3 |
中間
|
Ag+ |
0.4 |
3.3 |
4.7 |
6.6 |
軟
|
Hg2+ |
1.0 |
6.7 |
8.9 |
12.9 |
軟
|

元素週期表中最軟的金屬離子是 Au+(aq)。它與軟鹼(如膦和 CN-)形成穩定的配合物,但與硬鹼(如 O2- 或 F-)不形成。Au+ 對軟鹼 CN- 的親和力很高,形成的 [Au(CN)2]- 配合物非常穩定,以至於金(通常很難氧化)可以被空氣中的氧氣氧化
- 4 Au(s) + 8 CN-(aq) + O2(g) + 2 H2O ⇌ 4 [Au(CN)2]-(aq) + 4 OH-
該反應用於金礦開採,以從大量的沙子和其它氧化物中分離出少量的金片。Ag 在氰化物溶液中同樣被空氣氧化而溶解。然後,使用化學還原劑或電鍍從溶液中分離出貴金屬。然而,在採礦中大規模使用氰化物離子會造成潛在的嚴重環境危害。2000 年,羅馬尼亞拜亞馬雷發生一起洩漏事件,導致了自切爾諾貝利以來歐洲最嚴重的環境災難。氰化物劇毒,逐漸被空氣氧化成毒性較低的氰酸根(OCN-)離子。在實驗室規模上,氰化物電鍍溶液通常透過使用漂白劑將 CN- 氧化成 OCN- 來處理,金屬以不溶性氯化物鹽的形式回收。
Au3+ 離子由於其較高的正電荷,比 Au+ 是更硬的酸,可以與硬鹼(如 H2O 和胺)形成配合物。符合“相似相吸”原理,化合物 AuI(軟軟)是穩定的,但 AuI3(硬軟)是未知的。相反,AuF 從未被分離出來,但 AuF3(硬硬)是穩定的。
3.3 靜電-共價 (ECW) 酸鹼反應模型
[edit | edit source]將路易斯酸和鹼分類為硬和軟是一種有用的定性方法來解釋其行為。ECW 模型是一個更定量的模型,它描述和預測路易斯酸-路易斯鹼相互作用的強度。酸鹼相互作用的強度用加合物形成的焓變 △H 來衡量。每種酸都以 EA 和 CA 為特徵。每種鹼也以其自己的 EB 和 CB 為特徵。E 和 C 引數分別指酸和鹼將形成的鍵的強度中的靜電和共價貢獻。這些引數是透過使用加合物的焓值經驗獲得的,這些加合物僅在酸和鹼之間形成 σ 鍵,以及酸和鹼之間沒有空間位阻的加合物。
-△H = EAEB + CACB + W
該方程再現並預測了許多酸和鹼之間反應的焓變 △H。△H 是衡量酸和鹼之間鍵強度的指標,無論是在氣相中還是在弱溶劑化介質中。W 項代表酸或鹼二聚體斷裂的恆定能量。例如,[Rh(CO)2Cl]2 被鹼 B 裂解的焓變涉及兩個步驟。第一步是二聚體的斷裂,這是 W
½ [Rh(CO)2Cl]2 → Rh(CO)2Cl W = 43.5 kJ/mol
第二步是 B 與 RhCl(CO)2 單體結合。在另一種情況下,W 是裂解氫鍵酸 (CF3)3COH 的內部氫鍵所需的焓變。
吡啶 C5H5N 和雙(六氟乙醯丙酮)銅 (II) Cu(HFacac)2 反應的加合物形成焓變的計算表明了這些引數是如何使用的。在這種情況下,W = 0,因為酸和鹼都不是二聚體。可以在 ECW 模型的維基百科頁面中找到選定的引數。
-△H = EAEB + CACB = (1.82)(1.78) + ( 2.86)(3.54) = 13.4 kcal/mol = -56.1 kJ/mol
△H = -56.1 kJ/mol, △Hmeasured = -56.1 kJ/mol.
然而,計算的 Me3B 與 Me3N 反應的 ᐃH 比觀察到的更負。這種差異歸因於 B 和 N 原子上甲基之間的空間位阻。計算值和觀察值之間的差異可以被視為空間效應的量,這是其他方法無法獲得的值。空間效應也已經在 (CH3)3SnCl 和 Cu(HFacac)2 中被發現。當 π 鍵合對測量的焓值有貢獻時,根據 E 和 C 引數計算的焓值將小於測量的焓值,而差異提供了 π 鍵合貢獻程度的量度。
該模型的圖形表示清楚地表明,不存在路易斯酸或路易斯鹼強度的單一排序順序,這一點經常被忽視,並強調酸鹼相互作用的大小需要兩個引數(E & C)來解釋相互作用。使用三種路易斯鹼:乙腈、氨和二甲基硫醚的克萊默-博普圖[7]說明不存在路易斯鹼強度的唯一排序。克萊默-博普圖是一種直觀的工具,用於比較路易斯鹼強度和可能的路易斯酸夥伴的範圍,類似的圖可以用來檢查選定的路易斯酸與可能的路易斯鹼的範圍。這些圖表明,需要兩個屬性來完全定義酸和鹼的強度,任何試圖用一個屬性或引數來定義強度的嘗試在實用性上都是有限的。對於德拉戈的定量 ECW 模型,這兩個屬性是靜電和共價,而對於皮爾遜的定性 HSAB 理論,這兩個屬性是硬度和強度。
3.4 受挫的路易斯對
[edit | edit source]受挫的路易斯對 (FLP) 是一種化合物或混合物,它包含一個路易斯酸和一個路易斯鹼,由於空間位阻,它們不能結合形成經典的加合物。 [8] 已經設計出了許多種 FLP,並且它們對其他分子的反應性得到了廣泛的開發。 [9] [10]
最初的 FLP 的氫加合物,一種膦鎓-硼酸鹽,可以透過將亞苯基橋聯的膦硼烷和氫氣結合製備。該鹽是無色的,在空氣和水分的存在下是穩定的。當加熱到 100 °C 以上時,它會釋放出分子 H2。考慮到 H-H 鍵的強度為 432 kJ/mol,這種反應性是相當顯著的。
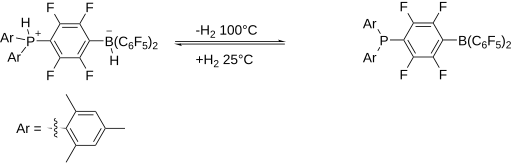
一些 FLP 可以裂解 H2 的發現 [11] 引發了對 FLP 研究的快速發展。由於它們的“未淬滅”反應性,這類體系對可以發生異裂的底物具有反應性。例如,許多 FLP 會裂解氫分子。這種反應性表明 FLP 可以用於氫化反應。現在已經開發出使用 FLP 的一系列均相和非均相催化反應。
空間位阻的路易斯酸和鹼的混合物也可以作為 FLP。一種成功的策略是將空間位阻的三芳基膦與三芳基硼烷混合。然後,像 CO2 和乙烯這樣的小分子可以在膦路易斯鹼和硼烷路易斯酸之間形成橋,例如:
- P(t-Bu)3 + B(C6F5)3 + CO2 → (t-Bu)3P+C(O)OB−(C6F5)3
- PCy3 + B(C6F5)3 + C2H4 → Cy3P+CH2CH2B−(C6F5)3
由於 FLP 同時表現出親核試劑和親電試劑的特性,它們可以實現環狀醚(如 THF、2,5-二氫呋喃、香豆素和二惡烷)的開環。 [12]
3.5 討論問題
[edit | edit source]- 討論金屬離子路易斯酸性的週期性變化趨勢。
- 用具體的例子解釋我們所說的硬酸和軟酸以及硬鹼和軟鹼。
- 解釋為什麼硬和軟不應該等同於靜電和共價。
- 根據 HSAB 理論,Cu 和 Zn 被歸類為中等酸,而 Cd 被歸類為軟酸。鹼 (CH2)4O 被認為是硬鹼,而 (CH2)4S 是軟鹼。使用 Cd[N(Si(CH3)3)2] 和 ZnTPP 的 E 和 C 值計算這兩種酸與 (CH2)4O 和 (CH2)4S 相互作用的焓值,並證明 HSAB 模型正確地預測了哪種鹼與哪種酸的相互作用更強。使用 Cu(HFacac)2 作為酸進行相同的比較,並證明 HSAB 無法預測哪種鹼的相互作用更強。這些結果如何與 Cramer-Bopp 圖相關聯,該圖表明不能使用單一性質或引數來對路易斯酸或鹼強度進行排名?
1. 將以下每種物質分類為酸或鹼,以及強或弱,或在所列溶劑中作為旁觀者。對於每種情況,寫出解離反應。
(a) 水中的 H3PO4
(b) 冰醋酸中的 HBr
(c) 液氨中的 CH3CH2COOH
(d) 熔融 KOH 中的 H2O
(e) 液氨中的 I-
2. 寫出酸 HA 及其共軛鹼 A- 在水中的解離反應。使用 Ka 和 Kb 的平衡表示式證明 KaKb = Kw。
3. 計算水中 1 M 醋酸 (Ka = 1.8 x 10-5) 的電離百分比。
4. 對於以下每對化合物,指出哪一個是更強的酸,並解釋你的選擇
(a) [Co(H2O)6]3+ 或 [Co(H2O)6]2+
(b) H3BO3 或 H3AsO3
(c) [In(H2O)6]3+ 或 [Ga(H2O)6]3+
(d) HClO3 或 HClO4
(e) H3PO4 或 HMnO4
5. Al3+ 和 Co3+ 陽離子具有相似的離子半徑,但含有這兩種離子的水性硝酸鹽溶液的酸度不同。解釋哪種離子更酸性以及原因。
6. 氟的電負性比氧強,但過渡金屬的最高氧化態通常存在於氧化物中。例如,錳金屬與氟反應生成 MnF3,但 Mn 的更高氧化態在其二元氟化物中不存在。然而,Mn(IV) 在氧化物(如 MnO2 和 CaMnO3)以及氟化物鹽(如 K2MnF6)中是穩定的。解釋為什麼這些化合物可以比二元氟化物穩定更高的錳氧化態。
7. (a) 當 As3+、Sb3+ 和 Sn4+ 的氫硫化物 (SH-) 鹽的溶液與水性硫化氫銨 (NH4+SH-) 溶液反應時,硫化物鹽 As2S3、Sb2S3 和 SnS2 會沉澱出來。然而,當加入過量的 Na2S 水溶液時,這些硫化物會重新溶解形成可溶的陰離子配合物。相反,Cu2+、Pb2+、Hg2+、Bi3+ 和 Cd2+ 的溶液會以固體硫化物的形式沉澱出來,但在含有過量硫化物的溶液中不會重新溶解。我們可以認為第一組離子對於涉及 SH- 而不是 OH- 的軟酸鹼反應是兩性的。第二組更鹼性(酸性更弱),因為它不會與過量的軟鹼反應。使用這些資訊在週期表中找到硫化物的兩性對角線。將此與定義了兩性氧化物的對角線進行比較,這些氧化物溶解在酸性或鹼性溶液中。你的分析是否與 S2- 比 O2- 更軟鹼的描述一致?
(b) Au+ 也會被 SH- 離子沉澱,硫化物 Au2S 會重新溶解並在過量的 SH- 中形成可溶的配合物。這是否符合你在 (a) 部分中發現的趨勢?從金的電負性來看,這是否合理?解釋。
8. 計算加合物 (CH3)3B-N(CH3)3 的焓值,並將其與測得的 -73.6 kJ/mol 值進行比較。引數可以在 ECW 模型 中找到。
9. 計算路易斯酸 (CH3)3SnCl 與以下每種路易斯鹼形成加合物的焓值: (C2H5)2O、(CH2)4O 和 CH3CN。它們各自的測量焓值為 -9.2、-21.3 和 -20.1 kJ/mol。解釋計算焓值和測量焓值之間的任何差異。引數可以在 ECW 模型 中找到。
10. 參考 ECW 模型 中的 Cramer-Bopp 圖,並指示以下路易斯鹼強度的遞增順序
(a) 酸,其 Ra = -0.5
(b) 酸,其 Ra = 0.33
(c) 酸,其 Ra = -0.9
11. 路易斯酸 [Rh(CO)2Cl]2 的 W 值為 -43.47 kJ/mol。在 ECW 模型 中找到的 E、C 和 W 引數給出了與鹼 B 形成一摩爾加合物的焓值,即 B + 1/2 [Rh(CO)2Cl]2 → B-RhCl(CO)2
(a) W 代表什麼?
(b) 一摩爾 [Rh(CO)2Cl]2 的解離熱是多少?
(c) 2B + [Rh(CO)2Cl]2 → 2 B-RhCl(CO)2 的焓值是多少?
(d) 當 B = C5H5N 和 B = (CH3)2CO 時,每摩爾 B-RhCl(CO)2 的焓值是多少?
12. 當鋁腐蝕時,會在其表面形成固體 Al2O3,但當銀變黑時,會在其表面形成固體 Ag2S。解釋為什麼會這樣。
13. 鑑於以下反應,解釋反應在平衡時是否有利於反應物或產物。簡要解釋你的推理。
[Fe(CO)6]Cl3 (aq) + 6 NH3(g) ⇌ [Fe(NH3)6]Cl3(aq) + 6 CO(g)
[Pd(CN)4]2-(aq) + [Mn(CO3)4]2-(aq) ⇌ [Mn(CN)4]2+(aq) + [Pd(CO3)4]6-(aq)
14. 合理性地解釋每對反應的形成常數差異。
(a) железо
Fe2+(aq) + 4 OH−(aq) → [Fe(OH)4]2−(aq)。 Kf = 1.00 × 1010
Fe3+(aq) + 4 OH−(aq) → [Fe(OH)4]−(aq)。 Kf = 2.51 × 1034
(b) 銅
Cu+(aq) + 4 CN−(aq) → [Cu(CN)4]3−(aq)。 Kf = 2.00 × 1030
Cu2+(aq) + 4 CN−(aq) → [Cu(CN)4]2−(aq)。 Kf = 1.00 × 1025
15. 描述以下對的溶解度差異。你如何預測這些溶解度模式?
(a) AgF(s) 可溶於水,而 AgI(s) 不溶於水。
(b) LiF(s) 不溶於水,而 LiI(s) 可溶。
- ↑ Hall NF, Conant JB (1927). "A Study of Superacid Solutions". Journal of the American Chemical Society. 49 (12): 3062–70. doi:10.1021/ja01411a010.
- ↑ George A. Olah, Schlosberg RH (1968). "Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H–SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH5+ and Related Hydrocarbon Ions. The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions". Journal of the American Chemical Society. 90 (10): 2726–7. doi:10.1021/ja01012a066.
- ↑ Herlem, Michel (1977). "Are reactions in superacid media due to protons or to powerful oxidising species such as SO3 or SbF5?". Pure & Applied Chemistry. 49: 107–113. doi:10.1351/pac197749010107.
- ↑ Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 - 463; DOI:10.1021/ar00156a004
- ↑ R. J. Cava 等人 (1988). “不含銅的 30K 附近超導性:Ba0.6K0.4BiO3 鈣鈦礦”. 自然. 332: 814–6. doi:10.1038/332814a0.
{{cite journal}}: 在“|author=” 中顯式使用等人 (幫助) - ↑ Christe, Karl O. (1986). “元素氟的化學合成”. 無機化學 25 (21): 3721. doi:10.1021/ic00241a001.
- ↑ Cramer RE, Bopp TT (1977). “偉大的 E 和 C 圖。路易斯酸和鹼加合物形成焓的圖形顯示”. 化學教育雜誌. 54 (10): 612–613. doi:10.1021/ed054p612.
- ↑ Stephan, D. W. (2008). “受挫路易斯對:新反應性和催化概念”. 有機生物分子化學. 6: 1535–1539. doi:10.1039/b802575b.
- ↑ Stephan, D. W.; Erker, G. (2010). “受挫路易斯對:無金屬氫活化等”. 應用化學國際版. 49 (1): 46–76. doi:10.1002/anie.200903708. ISSN 1433-7851.
- ↑ Stephan, D. W.; Erker, G. (2017). “受挫路易斯對化學”. 英國皇家學會哲學彙刊A:數學、物理和工程科學. 英國皇家學會. 375 (2101): 20170239. Bibcode:2017RSPTA.37570239S. doi:10.1098/rsta.2017.0239. ISSN 1364-503X. PMC 5540845. PMID 28739971.
- ↑ Welch, G. C.; San Juan, R. R.; Masuda, J. D.; Stephan, D. W. (2006). “可逆的、無金屬的氫活化”. 科學. 314 (5802): 1124–1126. Bibcode:2006Sci...314.1124W. doi:10.1126/science.1134230. ISSN 0036-8075. PMID 17110572.
- ↑ Birkmann, B. 等人 (2010). “受挫路易斯對和 THF、二惡烷和噻烷的開環”. 有機金屬化學. 29: 5310–5319. doi:10.1021/om1003896.
{{cite journal}}: 在“|first1=” 中顯式使用等人 (幫助)
