無機化學導論/離子化合物和共價化合物固體 - 結構

正如我們在第 6 章中關於金屬和合金結構的討論中提到的,材料的結構與其物理性質之間存在著密切的聯絡。當我們從基於球體堆積的簡單金屬結構“過渡”到更復雜的結構時,我們發現這一點仍然是正確的。在本章中,我們將嘗試對無機固體(金屬氧化物、鹵化物、硫化物和相關化合物)的結構進行系統化,並根據電負性差異、硬軟酸鹼規則和其他週期性規律,制定一些關於哪些結構是可預期的規則。我們將看到,這些結構中的許多結構與我們在第 6 章中學習的球體堆積相關。
第 8 章的學習目標
- 用密堆積框架和八面體和四面體空隙的系統填充來描述許多晶體結構。
- 透過繪製截面圖來表示晶體結構。
- 使用化學原理來解釋為什麼某些晶體結構對於某些化合物是穩定的,而對於其他化合物則不穩定,以及為什麼某些結構和鍵合基序對於某些化合物比其他化合物更受歡迎。
- 根據離子性和週期性規律預測哪些晶體結構對於給定成分最有利。
- 根據晶體結構解釋結構相關的性質,如鐵電性和磁性有序。
- 瞭解層狀和開放框架固體中的嵌入反應。
- 使用過渡金屬化學中的論點(例如晶體場穩定化能)來預測正常尖晶石或反尖晶石的優先生成。
無機固體通常具有簡單的晶體結構,其中一些結構被大量的離子化合物或共價化合物採用。最常見的結構的例子包括 NaCl、CsCl、NiAs、閃鋅礦、纖鋅礦、螢石、鈣鈦礦、金紅石和尖晶石。我們將從下面所示的密堆積和非密堆積晶格系統地發展這些結構。一些層狀結構,如 CdCl2 和 CdI2,可以看作是簡單離子晶格的衍生物,其中一些原子“缺失”。
-
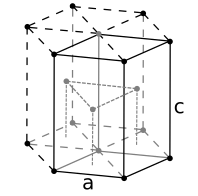
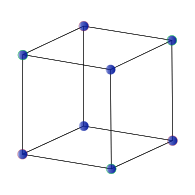
面心立方 (fcc) 或立方密堆積 (ccp)
-
六方密堆積 (hcp)
-
體心立方
-
簡單立方

許多常見的無機晶體具有與立方密堆積(面心立方)或六方密堆積球體堆積相關的結構。這些堆積晶格包含兩種型別的位點或“空隙”,間隙原子填充這些位點,這些位點的配位幾何形狀要麼是四面體,要麼是八面體。填充四面體空隙的間隙原子與四個堆積原子配位,而填充八面體空隙的原子與六個堆積原子配位。在六方密堆積和立方密堆積晶格中,每個堆積原子都有一個八面體空隙和兩個四面體空隙。
問題:陰離子還是陽離子更適合作為堆積原子?
我們可以預期,陰離子(通常比陽離子大)更適合堆積原子的位置。雖然這通常是正確的,但也存在許多結構的例子,其中陽離子是堆積原子,還有一些結構的例子,其中這種區別是任意的。NaCl 結構就是後者的一個很好的例子。


在右側所示的 NaCl 結構中,綠色球體是 Cl- 離子,灰色球體是 Na+ 離子。面心立方晶格中的八面體空隙可以在分數座標 (1/2 1/2 1/2)、(1/2 0 0)、(0 1/2 0) 和 (0 0 1/2) 處找到。每個晶胞有四個這樣的空隙,它們被氯離子填充。堆積原子 (Na+) 的座標為 (0 0 0)、(0 1/2 1/2)、(1/2 1/2 0) 和 (1/2 0 1/2)。請注意,每個 Na+ 位置都與 Cl- 位置透過 (1/2 0 0) 的平移相關。另一種說法是,該結構由兩個相互穿插的面心立方晶格組成,它們透過沿三個笛卡爾軸中的任何一個平移半個晶胞而相互關聯。我們可以等效地將 Cl 離子放置在面心立方晶格點上,將 Na 離子放置在八面體空隙中,只需將晶胞的原點平移 (1/2 0 0) 即可。因此,在這種情況下,堆積原子和間隙原子之間的區別是任意的。
NaCl 的有趣之處在於它是一個三維棋盤,因此結構中不存在 NaCl “分子”。當該結構最初被解決(1913 年,使用 X 射線衍射)時,W. L. Bragg 的解釋遭到了化學家的反對,化學家認為精確的整數化學計量比是分子中原子價的結果。德國化學家 P. Pfeiffer 在 1915 年指出,“普通的價概念似乎不適用”,十四年後,有影響力的化學家 H. E. Armstrong 仍然認為 Bragg 提出的氯化鈉結構“對於常識來說過於令人反感,不符合化學規範”!然而,Bragg 和他的父親 W. H. Bragg 堅持不懈,並使用當時新興的 X 射線衍射技術確定了許多其他化合物的結構,包括金剛石、閃鋅礦、氟化鈣和其他鹼金屬鹵化物。這些實驗讓化學家們第一次真正瞭解了固體的原子結構,併為 X 射線衍射實驗奠定了基礎,這些實驗後來闡明瞭 DNA、蛋白質和許多其他化合物的結構。由於在 X 射線衍射方面的貢獻,布拉格父子在 1915 年獲得了諾貝爾物理學獎。
由於 NaCl 結構中每種型別的原子都形成一個面心立方晶格,因此每個 NaCl 晶胞有四個 Na 和四個 Cl 原子。正是由於這種比例,NaCl 的化學計量比為 1:1。NaCl 晶格中陰影綠色的雙錐體結構和灰色的雙錐體結構表明 Na+ 離子與六個 Cl- 離子配位,反之亦然。NaCl 結構可以作為密堆積層面的堆積來繪製,AcBaCbAcBa... 沿著晶胞的體對角線。這裡,大寫字母代表堆積原子,小寫字母代表間隙原子。這種分層堆積在下圖中說明
NaCl 結構
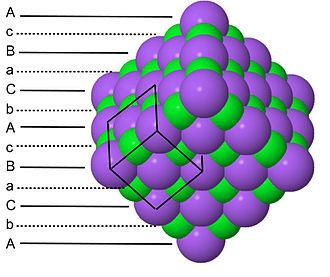
- ------------ A
- - - -c- - - -
- ------------ B
- - - -a- - - -
- ------------ C
- - - -b- - - -
- ------------ A
- - - -c- - - -
- ------------ B
- - - -a- - - -
- ------------ C
- - - -b- - - -
- ------------ A
請注意,堆積原子和間隙原子都按 A-B-C-A-B-C... 的順序堆積,這與它們各自形成立方密堆積晶格這一事實相符。
NaCl 結構在離子化合物中相當常見
- 鹼金屬鹵化物(除了 CsCl、CsBr 和 CsI)
- 過渡金屬單氧化物(TiO、VO、...、NiO)
- 鹼土金屬氧化物和硫化物(MgO、CaO、BaS... 除了 BeO 和 MgTe)
- 碳化物和氮化物(TiC、TiN、ZrC、NbC)-這些是極其穩定的耐火間隙合金(金屬性)
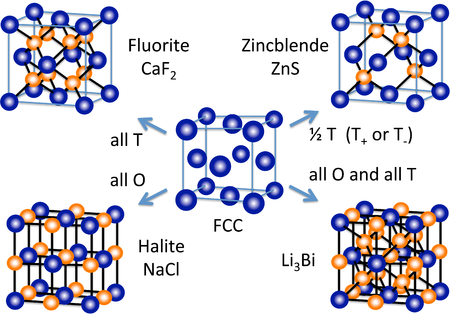
許多其他無機晶體結構(至少在概念上)是透過填充密堆積晶格中的八面體和/或四面體空隙形成的。右側的圖顯示了一些最常見的結構(螢石、岩鹽、閃鋅礦)以及一種從面心立方晶格衍生而來的相當罕見的結構(Li3Bi)。從六方密堆積晶格,我們可以構建 NiAs 和纖鋅礦結構,它們分別是 NaCl 和閃鋅礦的六方類似物。

表示無機晶體結構的另一種非常方便的方法(尤其是像 Li3Bi 這樣的複雜結構)是沿著晶胞軸之一繪製晶胞的截面。左側顯示了面心立方晶格和 NaCl 結構的這種表示方法。由於這些結構中的所有原子都具有 0 或 1/2 的 z 座標,因此只需要繪製這些截面來描述晶胞的內容。繪製一些面心立方化合物結構(右上角)的截面是一個有益的練習。

有許多化合物具有與 NaCl 結構相似的結構,但具有比 NaCl 本身更低的對稱性(通常是由陰離子的幾何形狀決定的)。這些化合物包括
- FeS2(黃鐵礦,“愚人金”):S22-(二硫化物)和 Fe2+
- CaC2(鹽狀碳化物):Ca2+ 和線性 C22- 陰離子
- CaCO3(方解石、石灰石、大理石):Ca2+ 和三角形 CO32-。

右側展示了方解石(CaCO3)的晶體結構。三角形的 CO32- 離子填充了扭曲的 NaCl 晶格中 Ca2+ 離子(黑色球體)之間的八面體空隙。與 NaCl 一樣,每個離子都與六個其他種類的離子配位。從該圖中我們可以看出,為什麼 CaCO3 結構的對稱性低於 NaCl。當球形的 Cl- 離子被三角形的 CO32- 離子取代時,NaCl 晶胞的四重旋轉對稱性就會消失。由於這種對稱性降低,透明的方解石晶體是雙折射的,如左側所示。
NiAs 結構。NaCl 結構可以描述為一個面心立方晶格,其中所有八面體空隙都被填充。如果我們從一個六方密堆積晶格而不是面心立方晶格開始會怎麼樣呢?

這是NiAs 以及許多其他過渡金屬硫化物、磷化物和砷化物採用的結構。右側的圖中,陽離子顯示為灰色,陰離子顯示為淺藍色。陽離子處於八面體配位,因此每個陽離子都與六個陰離子配位。陰離子也與六個陽離子配位,但它們佔據三角稜柱位置。在層堆積方面,NiAs 結構是 AcBcAcBc...,其中 A 和 B 位置(hcp 晶格)被 As 原子佔據,而 c 位置(沿著層堆積軸重疊)被 Ni 佔據。與 NaCl 結構不同,在 NaCl 結構中,陰離子和陽離子位置是可以互換的,NiAs 具有獨特的陰離子和陽離子位置。NiAs 的層堆積序列如下所示
- ------------ A
- - - -c- - - -
- ------------ B
- - - -c- - - -
- ------------ A
- - - -c- - - -
- ------------ B
- - - -c- - - -
由於陽離子重疊,NiAs 結構不能被離子化合物採用,因為陽離子-陽離子斥力會使離子化合物內部不穩定。這種結構主要被共價和極性共價 MX 化合物採用,通常具有“軟”X 陰離子(S、Se、P、As,....)和低價過渡金屬陽離子。例如,一些具有 NiAs 結構的化合物有:MS、MSe、MTe(M=Ti、V、Fe、Co、Ni)。這些化合物通常是非化學計量或具有有序空位的複雜化學計量化合物(Cr7S8、Fe7S8)。
8.3 四面體結構
[edit | edit source]
在 ccp 和 hcp 晶格中,每個堆積原子有兩個四面體空隙。M2X 或 MX2 的化學計量比會產生填充所有四面體位置的結構,而 MX 結構只填充一半的位置。MX2 結構的一個例子是螢石,CaF2,其結構如圖左側所示。螢石中的堆積原子是 Ca2+,結構由三個相互穿插的 fcc 晶格組成。需要注意的是,作為堆積原子的 Ca2+ 離子(灰色球體)違反了我們的“規則”,即陰離子大於陽離子,因此必須是堆積原子。螢石結構在離子 MX2(MgF2、ZrO2 等)和 M2X 化合物(Li2O)中很常見。相反,由於同電荷離子之間不利的緊密接觸,螢石結構的 hcp 相對結構非常罕見。
在幾何方面,Ca2+ 處於立方配位,與八個 F- 鄰居相鄰,氟離子被四個 Ca2+ 離子四面體配位。8:4 的配位幾何與 1:2 的 Ca:F 化學計量比一致;在所有晶體結構中,配位數之比是化學計量比的倒數。三個相互穿插的 fcc 晶格的 Ca 在 0,0,0 , 1/2,1/2,0 , 等....F 在 1/4,1/4,1/4 , 3/4,3/4,1/4 , 等...和 F 在 3/4,3/4,3/4 , 1/4,1/4/3/4 , 等...
仔細觀察螢石中的四面體位置,我們發現它們分為兩個不同的組:T+ 和 T-。如果四面體朝上沿堆積軸指向一個頂點,則該位置為 T+。同樣,頂點朝下指向的四面體是 T-。T+ 和 T- 位置的交替排列允許在結構中有效地堆積離子。這種結構的層堆積序列(包括 T+ 和 T- 位置的氟離子)是

- ------------ A
- - - -b- - - T+
- - - -a- - - T-
- ------------ B
- - - -c- - - T+
- - - -b- - - T-
- ------------ C
- - - -a- - - T+
- - - -c- - - T-
- ------------ A
- - - -b- - - T+
- - - -a- - - T-
具有 1:1 化學計量比(MX 化合物)的四面體鍵合化合物僅填充一半的四面體位置(T+ 或 T- 位置)。在這種情況下,M 和 X 原子都處於四面體配位。閃鋅礦和纖鋅礦結構分別是基於 fcc 和 hcp 晶格的 1:1 四面體結構。這兩種結構都受到遵循八隅體規則的 p 區化合物青睞,這些化合物通常是半導體或絕緣體。閃鋅礦結構,如下圖所示,可以認為是兩個相互穿插的 fcc 晶格,一個是陰離子,一個是陽離子,彼此偏移 1/4 個晶胞體對角線的距離。具有閃鋅礦結構的化合物例子包括 CuCl、CuI、ZnSe、HgS、BeS、CdTe、AlP、GaP、SnSb、CSi 和金剛石。此外,化合物 CuInSe2 在一個有序的、加倍的晶胞中是閃鋅礦(黃銅礦結構)。具有這種結構的固溶體化合物 CuIn1-xGaxSe2 是最廣泛研究的高效薄膜光伏電池材料。以 ZnS 為閃鋅礦的代表,Zn 和 S 原子的配位都是四面體。層序列 AbBcCaAbBcC...,導致形成與環己烷的“椅式”構型幾何形狀相同的六元 ZnS 環。椅式構型允許環中相對原子之間的距離相對較長,因此它比船式構型在空間上更有利。閃鋅礦中緊密堆積層的序列,只填充 T+ 位置,而 T- 位置留空,如下所示

- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
- - - -c- - - T+
- - - - - - - T-
- ------------ C
- - - -a- - - T+
- - - - - - - T-
纖鋅礦結構是閃鋅礦的近親,基於填充 hcp 晶格中一半的四面體空隙。與閃鋅礦一樣,纖鋅礦包含在椅式構型中融合的六元環平面。然而,與閃鋅礦不同的是,連線這些平面的環包含六元“船式”環。船式結構將陰離子排列成直接位於結構中的陽離子之上,這在空間上不利,但在靜電方面更有利。因此,纖鋅礦結構往往比閃鋅礦結構更利於極性或離子化合物(例如 ZnO、NH4+F-)。與閃鋅礦一樣,兩種離子都處於四面體(4:4)配位,並且 MX 化合物中通常有八個價電子。具有這種結構的化合物例子包括:BeO、ZnO、MnS、CdSe、MgTe、AlN 和 NH4F。纖鋅礦的分層結構是 AbBaAbB,填充 T+ 位置的層序列如下圖所示

- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
- - - -a- - - T+
- - - - - - - T-
- ------------ A
- - - -b- - - T+
- - - - - - - T-
- ------------ B
纖鋅礦結構中層堆積的一個有趣結果是晶體是極性的。當沿著 c 軸(堆積軸)劈開時,ZnO、ZnS 和 GaN 的晶體會呈現一個帶負電荷的面和一個帶相反正電荷的面。施加的電場會與晶體偶極矩相互作用,導致晶格沿著該方向壓縮或拉伸。因此,纖鋅礦結構化合物的晶體通常是壓電的。
有些化合物是二形的,可以是閃鋅礦結構或纖鋅礦結構。具有中間極性的化合物例子包括 CdS 和 ZnS。SiO2 存在於多晶型物(方石英和鱗石英)中,這些多晶型物類似於閃鋅礦和纖鋅礦,其中 O 原子位於每個 Si 原子之間的中間位置。閃鋅礦和纖鋅礦結構對四面體鍵合網路具有有效的堆積排列,並且在具有四面體鍵合的化合物中很常見。例如,水具有四面體氫鍵網路,並且是纖鋅礦型別的。未扭曲的纖鋅礦和閃鋅礦結構通常存在於具有八個價電子的 AX 化合物中,這些化合物遵循八隅體規則。具有九個或十個電子的 AX 化合物,如 GaSe 和 SbAs,在纖鋅礦結構的扭曲變體中結晶。在 GaSe 中,額外的電子形成孤對電子,這會在結構中形成層,如以下圖所示。在 GaSe 的右側,As、Sb 和 SbAs 的結構顯示了隨著價電子增加而結構逐漸分解成層的現象。
-
纖鋅礦晶體結構
-
GaSe 晶體結構
-
Sb、SbAs 和灰色 As 的晶體結構
-
六方冰的晶體結構
六方冰是在 1 個大氣壓下冷凍時獲得的冰的最穩定多晶型物。這種多晶型物(冰-I)具有 hcp 纖鋅礦型結構。觀察右側的結構,我們發現 O-H---O 鍵的排列不規則。在結構中,氫鍵強制每個水分子的四面體配位,導致相對開放的結構,其密度低於液態水。因此,冰漂浮在水面上。
8.4 層狀結構和插層反應
[edit | edit source]層狀結構的特點是在二維方向上原子之間具有強(通常是共價)鍵合,而在第三維方向上具有較弱的鍵合。廣泛的化合物,包括金屬鹵化物、氧化物、硫化物、硒化物、硼化物、氮化物、碳化物和一些純元素(B、C、P、As)的同素異形體以層狀形式存在。從結構上講,這些結構中最簡單的結構(例如二元金屬鹵化物和硫化物)可以描述為在 fcc 和 hcp 晶格中填充了一部分八面體和/或四面體位置。例如,CdCl2 結構是透過填充 fcc 晶格中交替層的所有八面體位置形成的,而 CdI2 結構是該結構在 hcp 晶格中的相對結構。


在CdCl2 結構中,陰離子層的堆積序列是 ABCABC...
在CdI2 結構中,陰離子堆積序列是 ABAB...,所有陽離子沿著堆積軸重疊。
這些是6-3 結構的例子,因為陽離子被六個陰離子的八面體配位,而陰離子被三個陽離子配位形成三角錐體(如 NH3)。另一種描述這些結構的方法是說 MX6 八面體在 MX2 層中共享六個邊。
由於這些結構將堆積原子(陰離子)置於直接範德華接觸,因此它們對於相對共價的化合物最穩定。否則,接觸陰離子之間的靜電排斥會在能量上使結構不穩定。更具離子性的 MX2 化合物傾向於採用螢石 (CaF2) 或金紅石 (TiO2) 結構,這些結構不是層狀的。
儘管這兩種結構型別在最近鄰和次近鄰離子水平上相同,但 CdI2 結構比 CdCl2 結構常見得多。
CdCl2 結構
- MCl2 (M = Mg, Mn, Fe, Co, Ni, Zn, Cd)
- NiBr2, NiI2, ZnBr2, ZnI2
CdI2 結構
- MCl2 (M = Ti, V)
- MBr2 (M = Mg, Fe, Co, Cd)
- MI2 (M = Mg, Ca, Ti, V, Mn, Fe, Co, Cd, Ge, Pb, Th)
- M(OH)2 (M = Mg, Ca, Mn, Fe, Co, Ni, Cd)
- MS2 (M = Ti, Zr, Sn, Ta, Pt)
- MSe2 (M = Ti, Zr, Sn, V, Pt)
- MTe2 (M = Ti, Co, Ni, Rh, Pd, Pt)
從物理上講,層狀化合物是軟且滑的,因為層平面很容易相互滑動。例如,石墨、MoS2 和滑石(一種矽酸鹽)是層狀化合物,被廣泛用作潤滑劑和潤滑劑新增劑。
層狀化合物的一個重要反應是插層。在插層反應中,客體分子和離子進入分離層的層間,通常會使沿堆積軸的晶格膨脹。如果該反應不擾亂層內的鍵合,則通常是可逆的。通常,插層的驅動力是氧化還原反應,即主體和客體之間的電子轉移。例如,鋰金屬與 TiS2、MoS2 和石墨反應生成 LiTiS2、LixMoS2 (x < 1) 和 LiC6。在這些化合物中,鋰被電離成 Li+,層帶負電。氧化劑如 Br2、FeCl3 和 AsF5 也與石墨反應。在所得的插層化合物中,層帶正電,插層物質為陰離子。

插層反應對於二次電池中的電化學儲能尤其重要,例如 鋰離子電池、鎳氫電池 和 鎳鎘電池。插層反應的可逆性使電極能夠充電和放電數千次,而不會失去其機械完整性。在鋰離子電池中,負極材料通常是石墨,它被鋰插層形成 LiC6。幾種不同的氧化物和磷酸鹽,包含氧化還原活性過渡金屬離子(Mn、Fe、Co、Ni),被用作正極材料。

基於 CoO2 的鋰離子電池首次在 1980 年[1] 由當時在牛津大學工作的 約翰·B·古迪納夫 研究小組描述。在基於 CoO2 的電池中,CoO2 具有 CdI2 結構,正極半反應為
負極半反應為
當正極處於 CoO2 形式,負極處於 LiC6 形式時,電池充滿電。放電涉及 Li+ 離子透過電解質的運動,在兩個電極上形成 LixCoO2 和石墨。

鋰離子電池是一種“搖椅”電池,之所以這樣命名是因為充放電涉及將 Li+ 離子從一側移動到另一側。雖然早期的鋰離子電池包含層狀金屬硫化物,如 TiS2,但金屬氧化物提供了更高的工作電壓和更穩定的電池。CoO2 是在鋰離子電池中使用的正極材料的一個例子。它具有高能量密度,但基於 CoO2 的電池熱穩定性差。更安全的材料包括磷酸鐵鋰 (LiFePO4) 和 LiMO2 (M = Co、Mn 和 Ni 的混合物)。負極材料 LiC6 在電化學系列中具有接近鋰金屬的電位。鋰金屬電極提供的能量密度比 LiC6 高得多,但鋰金屬電池由於安全性和迴圈壽命問題尚未投入商業使用。[4] 可充電鋰離子電池廣泛應用於筆記型電腦、行動式電子裝置、手機、無線工具以及電動和混合動力汽車。約翰·古迪納夫(德克薩斯大學)與 M·斯坦利·惠廷漢(賓漢姆頓大學)和 吉野彰(旭化成)因其在鋰離子電池基礎研究方面做出的貢獻共同獲得了 2019 年諾貝爾化學獎。
鎳鎘電池和鎳氫電池中也發生類似的插層反應,只是在這種情況下,反應涉及質子進出具有 CdI2 結構的 Ni(OH)2 晶格
有許多層狀化合物不能透過氧化還原反應進行插層,通常是因為形成了其他穩定的產物。例如,層狀 CdI2 與 Li 反應生成 LiI(NaCl 結構)和 Cd 金屬。
8.5 TiS2、MoS2 和黃鐵礦結構中的鍵合
[edit | edit source]許多層狀二硫化物,如 TiS2 和 ZrS2,具有 CdI2 結構。在這些化合物中,正如我們在上面提到的,金屬離子被 S 八面體配位。有趣的是,MoS2 和 WS2 的結構,雖然也是層狀的,但不同。在這些情況下,金屬被硫原子的三角稜柱包圍。NbS2、TaS2、MoSe2、MoTe2 和 WSe2 也具有三角稜柱狀輝鉬礦結構,該結構在下方顯示,旁邊是一個 MoS2 的片狀晶體。

金屬離子被硫族元素離子的三角稜柱配位,相對於八面體配位來說是空間上不利的。硫族元素離子之間存在緊密接觸,這些離子在堆積順序AbA/BaB/AbA/BaB...(其中“/”表示層之間的範德華間隙)中重疊。是什麼穩定了這種結構?
輝鉬礦結構最常見於具有d1 或 d2 電子數的 MX2 化合物。下圖比較了八面體和三角稜柱配位環境中 d 軌道能級的分裂。

MoS2 中的三角稜柱結構透過填充最低能量帶 dz2 來穩定。dz2 軌道垂直穿過三角稜柱的三角形頂面和底面,與硫化物配體相互作用最少,因此能量最低。dxz 和 dyz 軌道指向配體,具有最高的能量。在這個結構中,dz2 軌道的能量比 TiS2 八面體結構中的 t2g 軌道能量低。
PtS2 與 TiS2 一樣,採用八面體 CdI2 結構。在這種情況下,由於 Pt4+ 具有六個 d 電子,t2g 軌道被填充。由於 S2- 是強場配體,因此存在較大的晶體場穩定能(穩定 Pt 的高氧化態)。與 MoS2 一樣,PtS2 是半導體,因為在填充的 t2g 帶和空的 eg 帶之間存在能隙。
由於 TiS2 具有未填充的 t2g 帶,因此很容易透過與 Li 嵌入來還原。因此,LiTiS2 是最早由 Stanley Whittingham 研究的嵌入化合物之一,他在 1970 年代初提出了非水鋰離子電池的概念。[5] 由於 MoS2 具有填充的 dz2 帶,因此更難還原,但它可以透過與強還原劑正丁基鋰反應嵌入,形成 LixMoS2(x < 1)。這些化合物範德華平面的原子相對不活潑,這賦予 MoS2 良好的氧化穩定性,並使其能夠用作高溫潤滑劑。然而,晶體邊緣的原子更活潑,實際上具有催化活性。高表面積 MoS2 具有高密度的暴露邊緣平面,用作加氫脫硫催化劑,並且作為將水還原為氫氣的電催化劑越來越受到關注。

層狀金屬二硫化物,包括 MoS2、WS2 和 SnS2,可以形成閉合的奈米結構,形狀為多層洋蔥和多層管。這些材料是由 Reshef Tenne 小組在 1992 年發現的,緊隨碳奈米管的發現。從那時起,許多其他材料已經合成了納米管,包括釩和錳氧化物。
雖然早期的(TiS2)和後期的(PtS2)過渡金屬二硫化物具有層狀結構,但過渡系中間的一些 MS2 化合物,如 MnS2、FeS2 和 RuS2,具有三維鍵合結構。例如,FeS2 具有 **黃鐵礦結構**,它與 NaCl 結構相關。原因是 FeS2 不是 Fe4+(S2-)2,而是實際上是 Fe2+(S22-),其中 S22- 是二硫化物陰離子(它與過氧化物陰離子 O22- 一樣包含一個單鍵)。S2- 作為強還原劑,不能與強氧化劑 Fe4+ 存在於同一化合物中。因為 FeS2 實際上是 Fe2+(S22-),所以它是一個 1:1 化合物,並採用 1:1 結構。
8.6 尖晶石、鈣鈦礦和金紅石結構
[edit | edit source]還有三種結構,它們源自密堆積晶格,由於其化合物的材料特性而特別重要。它們是 **尖晶石** 結構,鐵氧體和其他磁性氧化物基於該結構;**鈣鈦礦** 結構,鐵電和超導氧化物採用該結構;**金紅石** 結構,這是氧化物和氟化物採用的常見二元 6:3 結構。
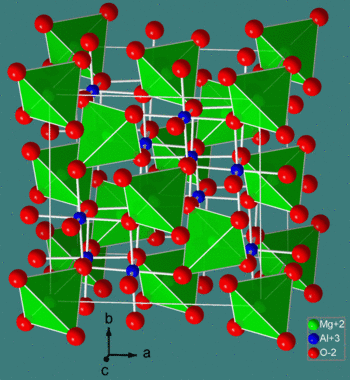
**尖晶石結構** 的化學式為 MM'2X4,其中 M 和 M' 分別是四面體配位和八面體配位的陽離子,X 是陰離子(通常是 O 或 F)。該結構以礦物 MgAl2O4 命名,氧化物尖晶石的通式為 AB2O4。
在 **正尖晶石** 結構中,存在一個密堆積的陰離子陣列。A 位陽離子填充 1/8 的四面體空隙,B 位陽離子填充 1/2 的八面體空隙。正尖晶石晶胞的多面體檢視顯示在左側,簡化的檢視(為了清晰起見,去除了晶胞後半部分的內容)顯示在上面。每個晶胞包含八個化學式單位,其組成是 A8B16O32。
**逆尖晶石** 具有密切相關的結構(具有相同的較大晶胞),其中 A 位離子與一半 B 位離子交換位置。因此,逆尖晶石的化學式為 B(AB)O4,其中括號內的 AB 離子佔據八面體位置,其他 B 離子位於四面體位置。還有混合尖晶石,它們介於 **正** 和 **逆** 尖晶石結構之間。
一些尖晶石和逆尖晶石 AB 組合是
- A2+B3+,例如 MgAl2O4(正尖晶石)
- A4+B2+,例如 Pb3O4 = PbII(PbIIPbIV)O4(逆尖晶石)
- A6+B+,例如 Na2WO4(正尖晶石)
許多磁性氧化物,如 Fe3O4 和 CoFe2O4,是尖晶石。
**正與逆尖晶石結構。** 對於過渡金屬氧化物尖晶石,正與逆尖晶石結構的選擇主要由離子在四面體和八面體位置上的 **晶體場穩定能** (CFSE) 決定。對於包含 3d 元素(如 Cr、Mn、Fe、Co 和 Ni)的尖晶石,電子構型通常是 **高自旋**,因為 O2- 是 **弱場配體**。
例如,我們可以考慮磁鐵礦 Fe3O4。該化合物每個化學式單位包含一個 Fe2+ 和兩個 Fe3+ 離子,因此我們可以將其表示為正尖晶石 Fe2+(Fe3+)2O4,或逆尖晶石 Fe3+(Fe2+Fe3+)O4。哪一個能量最低?

首先,我們考慮 **Fe2+** 離子的晶體場能,它為 d6。比較四面體和高自旋八面體圖,我們發現 O2- 離子在 **八面體** 場中的 CFSE 為 [(4)(2/5) - (2)(3/5)]Δo - P = **0.4 Δo - P**。在 **四面體** 場中,CFSE 為 [(3)(3/5) - (3)(2/5)]Δt - P = **0.6 Δt - P**。由於 Δo 大約是 Δt 的 2.25 倍,因此八面體排列具有更大的 CFSE,是 Fe2+ 的優選排列。

相反,很容易證明 **Fe3+**(即 d5)在八面體或四面體幾何結構中都具有零 CFSE。這意味著 Fe2+ 傾向於佔據八面體位置,而 Fe3+ 沒有偏好。因此,我們將 Fe2+ 放在八面體位置,**Fe3O4 是一個** **逆尖晶石**,Fe3+(Fe2+Fe3+)O4。
**鐵氧體** 是通式為 **MIIFe2O4** 的化合物。我們可以看到磁鐵礦是鐵氧體的一個例子(其中 M = Fe)。其他二價金屬(M = Mg、Mn、Co、Ni、Zn)也形成鐵氧體。鐵氧體可以是正尖晶石、逆尖晶石或混合尖晶石,具體取決於 MII 離子的 CFSE。根據其 CFSE,Fe2+、Co2+ 和 Ni2+ 都對八面體位置有強烈的偏好,因此這些化合物都是逆尖晶石。ZnFe2O4 是一個正尖晶石,因為較小的 Zn2+ 離子 (d10) 比 Fe3+ (d5) 更容易適合四面體位置,並且兩個離子都具有零 CFSE。MgFe2O4 和 MnFe2O4 中所有離子都具有零 CFSE,並且沒有位置偏好,是混合尖晶石。**鉻鐵礦** 尖晶石 **MIICr2O4** 始終是 **正尖晶石**,因為 d3 Cr3+ 離子對八面體位置有強烈的偏好。
正和逆尖晶石結構的例子
- **MgAl2O4** 是一個 **正尖晶石**,因為 Mg2+ 和 Al3+ 都是非過渡金屬離子,因此 CFSE = 0。電荷更高的 Al3+ 離子更傾向於佔據八面體位置,在那裡它被六個帶負電荷的氧原子包圍。
- **Mn3O4** 是一個 **正尖晶石**,因為 Mn2+ 離子是一個高自旋 d5 體系,CFSE 為零。兩個 Mn3+ 離子是高自旋 d4,在八面體位置 (3/5 ΔO) 上具有比在四面體位置 (2/5 Δt ~ 1/5 ΔO) 上更高的 CFSE。
- **Fe3O4** 是一個 **逆尖晶石**,因為 Fe3+ 離子是一個高自旋 d5 體系,CFSE 為零。Fe2+ 是一個高自旋 d6 體系,在八面體位置上具有比在四面體位置上更高的 CFSE。
- **NiFe2O4** 再次是一個 **逆尖晶石**,因為 Ni2+(一個 d8 離子)傾向於佔據八面體位置,而 Fe3+(一個 d5 離子)的 CFSE 為零。
- **FeCr2O4** 是一個 **正尖晶石**,因為 Fe2+ 是一個高自旋 d6 離子,CFSE = [4(2/5)-2(3/5)] ΔO = 2/5ΔO 在八面體位置上,而 Cr3+ 是一個 d3 離子,CFSE = 3(2/5) ΔO = 6/5 ΔO。因此,Cr3+ 佔據兩個八面體位置在能量上更有利。
- Co3O4 是一種正尖晶石。即使在弱場氧配體存在的情況下,Co3+ 也是一個低自旋 d6 離子,在八面體位置上具有非常高的晶體場穩定化能,這是由於 Co3+ 離子的高電荷和較小尺寸。因此,Co3+ 離子佔據八面體位置,而 Co2+ 離子佔據四面體位置。

鐵氧體尖晶石的磁性。鐵氧體尖晶石因其磁性有序而具有技術意義,根據結構(正或反)和金屬離子的性質,磁性有序可以是亞鐵磁性或反鐵磁性。Fe3O4、CoFe2O4 和 NiFe2O4 都是反尖晶石,是亞鐵磁體。後兩種化合物分別用於磁記錄介質和偏轉磁體。
為了理解鐵氧體的磁性,我們需要考慮金屬離子在氧化物中的不成對自旋如何耦合。如果一個氧化物離子被兩個金屬離子共享,它可以透過超交換來介導自旋的耦合,如右圖所示。耦合可以是反鐵磁性的,如所示,也可以是鐵磁性的,取決於參與的軌道填充和對稱性。Goodenough-Kanamori 規則預測由過渡金屬離子電子自旋超交換耦合產生的區域性磁性排序(鐵磁性 vs. 反鐵磁性)。對於鐵氧體,最強的耦合發生在相鄰四面體和八面體位置的離子之間,這兩個位置之間的自旋排序通常是反鐵磁性的。

由於尖晶石或反尖晶石晶體中的所有四面體和八面體位置都以相同的方式耦合在一起,因此,四面體位置上的離子將全部具有一個方向(例如,自旋向下),而所有八面體位置上的離子將具有相反的方向(例如,自旋向上)。如果兩個位置上的自旋數相同,則固體將是反鐵磁性的。但是,如果自旋數不相等(如 Fe3O4、CoFe2O4 和 NiFe2O4 的情況),則固體將是亞鐵磁性的。左側的 Fe3O4 圖示了這一點。Fe3+ 位置上的自旋相互抵消,因為其中一半向上,一半向下。但是,Fe2+ 離子上的四個不成對電子在晶體中都以相同的方式排列,因此該化合物是亞鐵磁性的。

鈣鈦礦是三元氧化物,通式為ABO3。更一般地,鈣鈦礦公式為 ABX3,其中陰離子 X 可以是O、N 或鹵素。A 離子通常是大型離子,如 Sr2+、Ba2+、Rb+ 或鑭系 3+ 離子,而 B 離子是較小的過渡金屬離子,如 Ti4+、Nb5+、Ru4+ 等。該結構以其命名為礦物的公式為 CaTiO3。
鈣鈦礦結構具有簡單立方對稱性,但與 fcc 晶格有關,因為 A 位置陽離子和 6 個 O 原子構成 fcc 晶格。B 位置陽離子填充 1/4 的八面體孔,並被 6 個氧化物陰離子包圍。

鈣鈦礦中 A 離子的配位和 BO6 八面體的排列最好透過觀察 ReO3 結構來理解,該結構與鈣鈦礦結構相同,只是 A 位置陽離子被移除。在右側顯示的結構的多面體表示中,可以看出八面體共享所有頂點,但沒有共享任何八面體邊。這使得 ReO3 和鈣鈦礦結構具有靈活性,就像三維的酒架一樣,八面體可以協同旋轉和傾斜。八個這樣的八面體包圍一個大的立方八面體空腔,它是鈣鈦礦結構中 A 離子的位置。這些位置中的陽離子被 12 個氧化物離子配位,正如鈣鈦礦和 fcc 晶格之間的關係所預期的那樣。
由於 ReO3 結構中的 A 位置是空的,因此具有該結構的化合物可以透過小離子(如Li+ 或 H+)進行可逆嵌入,這些離子隨後佔據立方八面體空腔中的位置。例如,在強陽光下變暗的智慧窗戶包含電致變色材料 WO3,它具有 ReO3 結構。在陽光下,光伏電池驅動 WO3 的還原嵌入,反應如下:
WO3 是一種淡黃色的化合物,含有 d0 W(VI)。相反,HxWO3(混合價態 W(V)-W(VI) = d1-d0)呈深藍色。這種顏色是混合價態過渡金屬配合物的典型特徵,因為它們的 d 電子可以透過紅光激發到離域導帶能級。由於電化學嵌入-脫嵌過程是由太陽能電池驅動的,因此窗戶的色調可以根據陽光照射程度自動調整。

鐵電鈣鈦礦。角共享 BO6 八面體網路的靈活性在具有鈣鈦礦結構的鐵電氧化物中也非常重要。在一些 B 位置陽離子較小的鈣鈦礦中,如 Ti4+ 和 Nb5+,陽離子太小,無法對稱地嵌入 BO6 八面體中。八面體會發生畸變,使陽離子偏離中心。這些畸變可以是四方(如右圖所示),菱形或正交,具體取決於陽離子是朝 BO6 八面體的頂點、面或邊移動。將陽離子從八面體的中心移開會產生電偶極子。在鐵電材料中,這些偶極子透過八面體的協同旋轉和傾斜在相鄰的晶胞中排列。因此,晶體獲得淨電極化。
鐵電性與鐵磁性類似,只是極化是電性的而不是磁性的。在這兩種情況下,都存在一個臨界溫度 (Tc),高於該溫度晶體的自發極化會消失。低於 Tc,鐵電體的電極化可以透過矯頑場切換,極化與場強之間的磁滯回線類似於鐵磁體的磁滯回線。高於 Tc,晶體是順電的,並且具有很高的介電常數。
鐵電和順電氧化物(以及壓電和熱電材料)在開關、致動器、感測器和電容器介電材料中具有廣泛的應用。鐵電電容器在儲存器裝置(FRAM)和手機的調諧電路中非常重要。多鐵材料是指同時具有鐵電性和鐵磁性的材料,它們比較罕見,目前正被人們深入研究,因為它們在電可定址磁儲存方面具有潛在的應用價值。

鹵化物鈣鈦礦(ABX3,X = Cl、Br、I)可以透過將一價 A 離子鹽(A+ = Cs+、NH4+、RNH3+)和二價金屬鹽(如 PbCl2 或 PbI2)結合起來製備。這些化合物最近引起了人們的興趣,作為薄膜太陽能電池中用於從陽光中產生電力的光吸收體。鹵化鉛和錫鈣鈦礦可以從溶液前驅體中或透過在相對較低的溫度下熱蒸發來製備薄膜。在一些鹵化鉛鈣鈦礦中,電子和空穴的遷移率非常高,與更昂貴的 III-V 族半導體(如 GaAs)相當,後者必須在高溫下以非常純淨的單晶形式生長才能用於太陽能電池。由於其高載流子遷移率,一些鹵化鉛鈣鈦礦也是電致發光的,並且作為廉價的發光二極體 (LED) 材料引起了人們的興趣。

鹵化錫和鉛鈣鈦礦最早是在 20 世紀 90 年代被研究作為薄膜電子學材料,[6] 後來被用作染料敏化太陽能電池中的光吸收體。在報道了染料敏化鈣鈦礦電池的結果後不久,人們發現鹵化物鈣鈦礦也可以用於薄膜固態太陽能電池。這些太陽能電池的結構在右側以示意圖的形式顯示。鈣鈦礦太陽能電池報道的最高太陽能轉換效率已從 2009 年的 3.8%[7] 躍升至 2012 年的 10.2%[8],再到 2020 年的 25.5%(單結結構),[9] 以及在矽基串聯電池中達到 29.15%,[9] 超過了單結矽太陽能電池所能達到的最高效率。因此,鈣鈦礦太陽能電池是發展速度最快的太陽能技術。由於具有實現更高效率和極低生產成本的潛力,鈣鈦礦太陽能電池已成為商業上的吸引力。迄今為止,效能最高的電池在鈣鈦礦 B 位置陽離子位置包含二價鉛,並在鈣鈦礦 A 位置陽離子位置包含甲胺和甲脒離子的混合物。
儘管鈣鈦礦太陽能電池的效率非常高,但它們不如由矽或 GaAs 等共價網路固體制成的太陽能電池穩定,並且對空氣和水分敏感。目前的研究重點是瞭解這些太陽能電池的降解機制,並在工作條件下提高其穩定性。


金紅石結構是重要的MX2 (X = O, F)結構。它是一種6:3結構,其中陽離子被陰離子八面體配位,因此其極性介於CaF2 (8:4)和SiO2 (4:2)結構之間。金紅石礦物是TiO2的多晶型之一,其他多晶型(銳鈦礦和板鈦礦)也是6:3結構。
金紅石結構可以描述為NiAs結構的扭曲形式,其中一半的陽離子被移除。回想一下,具有NiAs結構的化合物通常是金屬的,因為金屬離子沿堆疊軸重疊,因此彼此相對靠近。在金紅石中,MO6 八面體沿四方c軸共邊,因此一些金紅石氧化物,如NbO2,RuO2和IrO2,由於d軌道重疊沿該軸也是金屬的。這些化合物作為電解槽催化劑和催化劑載體很重要,因為它們將高催化活性與良好的電子導電性結合在一起。
金紅石TiO2由於其高折射率,是白色塗料的基礎顏料。它是一種寬頻隙半導體,在作為水分解太陽能電池的電極以及光催化劑(主要作為銳鈦礦多晶型)降解空氣和水中的汙染物方面也得到了廣泛的研究。 自清潔玻璃利用薄層TiO2的光催化性質去除玻璃表面的油性物質,並改善玻璃的潤溼效能。
8.7 討論問題
[edit | edit source]- 使用利物浦3D視覺化網站 (http://www.chemtube3d.com/solidstate/_table.htm) 確定氯化鎘和銳鈦礦中陰離子和陽離子的配位幾何形狀。描述這些結構中八面體的排列(就它們是否共邊、共面等而言)。
- 計算Li3Bi和ReO3晶胞中的原子數,並確定每個離子的配位環境。
- 矽、鍺和許多其他半導體採用金剛石(或閃鋅礦)結構。假設所有原子的大小相同,計算晶胞中被原子佔據的體積分數。金剛石的填充分數與簡單立方結構和密堆積結構相比如何,這告訴我們關於配位數和密度的關係什麼?
- 描述鈦酸鋇的鐵電性的結構基礎。
8.8 問題
[edit | edit source]1. 對於以下每種密堆積層序列,指出結構名稱(結構型別)、陽離子的配位環境(用小寫字母表示)和陰離子的配位環境(用大寫字母表示)。給出具有相同結構的兩種額外示例(除結構型別本身之外)。
(a) AbBaAbBaAbB......
(b) AaBbCcAaBbCc.....
(c) AcBaCbAcBaCb.....
(d) AcB | AcB | AcB |.... ("|" = 範德華爾斯間隙)
2. 下面是氧化鋰晶胞的部分。

(a) 描述如何獲得(以及如何獲得)經驗式。
(b) 每種離子的配位數和幾何形狀是什麼?
(c) 哪個原子是密堆積的?
(d) 另一種離子填充了哪種型別的空隙,以及填充了多少比例?
3. 金屬氮化物的六方晶胞在部分中顯示如下。

(a) 化合物的經驗式是什麼?
(b) 有多少個M原子與每個N原子配位?
(c) 您預計會在元素週期表的哪個族中找到M?
4. 繪製Li3Bi立方晶胞的部分。
5. 如果從CsCl結構中移除一半的銫,使得每個Cl原子隨後四面體配位,會生成哪種結構型別?
6. 某種三元氧化物的晶體結構如下所示。

(a) 經驗式是什麼,晶胞中包含多少個式量單位?
(b) 哪些原子(如果有)是密堆積的?
(c) 結構中每個不同陽離子有多少個氧化離子配位?
(d) (c) 部分中的配位數是否不同?如果是,為什麼?
7. 二硫化物(MS2)的結構顯示出明顯的異常趨勢,從過渡系列的左側到右側。在左側(TiS2,ZrS2,MoS2等),人們發現層狀結構,而在中間(ReS2,FeS2,RuS2)則存在三維黃鐵礦和白鐵礦型別結構。在右側(PtS2,SnS2),再次出現層狀結構。簡要解釋這些趨勢。
8. 解釋為什麼層狀化合物通常是共價的,很少是離子性的。
9. 繪製閃鋅礦結構的部分。
10. 閃鋅礦結構很少與極性或離子性很強的化合物一起發現。然而,一些極性和離子性化合物(BeO,NH4F等)具有纖鋅礦結構。
(a) 描述閃鋅礦結構和纖鋅礦結構之間的相似之處和不同之處(就配位數、陽離子和陰離子的堆積順序等而言)(b) 為什麼纖鋅礦比閃鋅礦更具離子性?
11. R. Cava及其同事最近發表的一篇文章(Nature Materials 2010, 9, 546-9)描述了一種Y-Pt-Bi合金的獨特電子性質,其結構在部分中顯示如下

(a) 化合物的化學計量比是多少?
(b) 每個Bi原子有多少個Y原子和多少個Pt原子配位?
12. 螢石結構,CaF2,它是由填充FCC陣列中的所有四面體空隙產生的,是一種常見的MX2結構型別。
(a) 在CaF2的假設近親中,F的配位環境是什麼,其中Ca形成hcp陣列,F佔據所有四面體位?
(b) 建議一個原因,說明為什麼(a)中描述的結構非常罕見。

13. 赤銅礦(Cu2O)結構與閃鋅礦(或金剛石)相關,因為氧佔據Zn和S的位置,銅位於兩者之間。這在右側的示意圖中顯示出來。實際上,在赤銅礦中,有兩個這樣的互穿網路,它們之間沒有鍵。在空的單元格中繪製第二個網路。如果將兩個部分放在一起並取出銅,您將獲得哪種立方堆積晶格?它是最密堆積晶格嗎?(提示 #1: 從1/2,1/2,1/2處的O原子開始)(提示 #2: 首先用鉛筆嘗試)
14. 繪製金紅石結構的晶胞部分,並驗證化學計量比為MX2。Ti和O的配位數是多少?
15. 隕石坑中發現了一種高壓形式的SiO2,叫做板鈦礦。雖然正常的SiO2具有石英結構,其中每個Si都與四個O原子配位,但板鈦礦具有金紅石結構。您預計Si-O鍵在板鈦礦中更長,還是在石英中更長?每個多晶型中的鍵序是多少?
16. Na和Cl以1:1的比例結合形成離子NaCl晶格。有趣的是,最近的理論預測(透過高壓合成和晶體學得到證實)已經確定了在高壓下形成穩定晶體的幾種其他化學計量比。這些包括Na3Cl,Na2Cl,Na3Cl2,NaCl3,以及其他幾種。[10] 下面部分顯示了其中一種新的氯化鈉的結構。

- a) 該化合物的化學計量比是多少?
- b) Na和Cl的配位數是多少,以及它們與NaCl和Na金屬中的配位數相比如何?
- c) 根據您對(b)的回答,解釋為什麼高壓應該穩定這種相。
17. 在問題16中描述的研究中發現的新化合物之一是NaCl3。該化合物有兩種多晶型,其中一種包含線性Cl3-離子。精確的分子軌道計算表明,這些線性陰離子中中心Cl原子的電荷接近於零。繪製與這些觀察結果一致的Cl3-離子的MO圖和價鍵圖。您預計Cl-Cl鍵會比Cl2中的鍵更長還是更短?
18. 一些MX鹽可以以CsCl或NaCl結構存在。使用Pauling公式預測具有NaCl結構中鍵長為3.5 Å的化合物的CsCl結構中的M-X鍵長。施加高壓會使該化合物的CsCl形式穩定,還是使NaCl形式穩定?(提示:計算每個式量單位的體積)
19. Mn3O4和Fe3O4都是混合價態氧化物。在這兩種情況下,每個式量單位(M = Fe,Mn)中有一個M2+離子,兩個M3+離子。
- (a) 其中一個是正尖晶石,另一個是反尖晶石。解釋哪個是哪個,以及為什麼。(提示:考慮CFSE)
- (b) 對於Mn3O4,您會期望哪種型別的磁性排序(反鐵磁性、鐵磁性或亞鐵磁性),以及為什麼?您可以假設結構中相鄰的四面體和八面體離子是反鐵磁性耦合的。
- (c) 為Mn3O4繪製χ與T以及1/χ與T曲線的大致形式。在您的圖表上標記任何特殊溫度值。
20. 預測以下每種物質應該形成正尖晶石還是反尖晶石:MgV2O4,VMg2O4,NiGa2O4,ZnCr2S4,NiFe2O4。您會預測NiFe2O4會產生哪種型別的磁性排序(鐵磁性、亞鐵磁性或反鐵磁性)?
21. 對於以下每對物質,哪種結構更受極性較弱的化合物青睞?
A. NaCl CsCl
B. 閃鋅礦 纖鋅礦
C. CdI2 CdCl2
D. NaCl NiAs
E. 螢石 石英 (SiO2)
22. 對於以下無機晶體結構,描述堆積離子與間隙離子的排列,給出層堆積順序(例如AaBbCcA...),並在部分中繪製晶胞。
A. 閃鋅礦
B. 纖鋅礦
- ↑ K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough (1980). "LixCoO2 (0<x<l): A New Cathode Material for Batteries of High Energy Density". Materials Research Bulletin. 15: 783–789. doi:10.1016/0025-5408(80)90012-4.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Yang Shao-Horn, Laurence Croguennec, Claude Delmas, E. Chris Nelson 和 Michael A. O'Keefe (2003 年 7 月). "Atomic resolution of lithium ions in LiCoO2". Nature Materials. 2 (7): 464–467. doi:10.1038/nmat922. PMID 12806387.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ M.S. Whittingham (1976). "Electrical Energy Storage and Intercalation Chemistry". Science. 192: 1126–1127. doi:10.1126/science.192.4244.1126.
- ↑ . Gao, Z. Yan, J. L. Gray, X. He, T. Chen, Q. Huang, Y. C. Li, H. Wang, S. H. Kim, T. E. Mallouk 和 D. Wang (2019). "Polymer–inorganic solid–electrolyte interphase for stable lithium metal batteries under lean electrolyte conditions". Nature Materials. 18: 384–389. doi:10.1038/s41563-019-0305-8.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ M. Stanley Whittingham "Lithium Batteries and Cathode Materials" Chem. Rev., 2004, vol. 104, pp. 4271–4302. DOI: 10.1021/cr020731c
- ↑ Kagan, Cherie R.; Mitzi, David B.; Dimitrakopoulos, C. D. (1999). "Organic-inorganic hybrid materials as semiconducting channels in thin-film field-effect transistors". Science. 286: 945–947. doi:10.1126/science.286.5441.945.
{{cite journal}}: Cite has empty unknown parameter:|1=(help) - ↑ Kojima, Akihiro; Teshima, Kenjiro; Shirai, Yasuo; Miyasaka, Tsutomu (2009 年 5 月 6 日). "Organometal Halide Perovskites as Visible-Light Sensitizers for Photovoltaic Cells". Journal of the American Chemical Society. 131 (17): 6050–6051. doi:10.1021/ja809598r. PMID 19366264.
- ↑ Chung, In; Lee, Byunghong; He, Jiaking; Chang, Robert P. H.; Kanatzidis, Mercouri G. (2012 年 5 月 24 日). "All-solid-state dye-sensitized solar cells with high efficiency". Nature. 485: 486–489. doi:10.1038/nature11067.
- ↑ a b "NREL efficiency chart" (PDF).
- ↑ W. Zhang 等人 (2013),"Unexpected Stable Stoichiometries of Sodium Chlorides." Science,第 342 卷,第 6165 號,第 1502-1505 頁。 doi: 10.1126/science.1244989