生命科學方法與概念/克隆方法
分子克隆是一組實驗方法,用於組裝重組DNA分子並在宿主生物體中指導它們的複製。術語克隆指的是該方法涉及一個分子的複製,以產生具有相同DNA分子的細胞群體。分子克隆通常使用來自兩種不同生物體的DNA序列:DNA克隆來源物種和作為重組DNA複製活體宿主的物種。
這裡概述了使用限制酶和連線酶克隆的例子來描述整個過程,這是傳統方法。在此之後,描述了特殊策略和替代方法。
在20世紀70年代之前,由於無法從複雜生物體中分離和研究單個基因,我們對遺傳學和分子生物學的理解受到了嚴重阻礙。當發現限制酶和DNA連線酶是分子生物學中寶貴的工具時,這種情況發生了戲劇性的變化。第一個重組DNA分子是在1972年生成和研究的。限制酶和連線酶克隆很快成為分子生物學中的一項標準程式。整個過程通常包括以下七個步驟。
雖然大量的宿主生物和分子克隆載體正在使用,但絕大多數分子克隆實驗始於大腸桿菌的實驗室菌株和質粒克隆載體。大腸桿菌和質粒載體被廣泛使用,因為它們技術成熟、用途廣泛、易於獲得,並且能以最少的裝置快速培養重組生物。如果要克隆的DNA特別大(數十萬到數百萬個鹼基對),那麼通常選擇細菌人工染色體或酵母人工染色體載體。
專門的應用可能需要專門的宿主-載體系統。例如,如果實驗人員希望從重組生物體中收穫特定蛋白質,那麼選擇包含在所需宿主生物體中轉錄和翻譯的適當訊號的表達載體。或者,如果需要在不同物種中複製DNA(例如,將DNA從細菌轉移到植物),那麼可以選擇多種宿主範圍載體(也稱為穿梭載體)。然而,在實踐中,專門的分子克隆實驗通常從克隆到細菌質粒開始,然後亞克隆到專門的載體中。
克隆載體用限制性內切酶處理,以在插入外源DNA的位點切割DNA。選擇限制酶以在切割位點產生與外源DNA末端相容的構型。通常,這是透過用相同的限制酶切割載體DNA和外源DNA來完成的。重要的是,這種限制性消化效果良好,否則將會有許多含有原始載體而沒有插入片段的菌落。載體的重新連線也會導致這個問題。當線性載體的末端相容時,它們可以在連線步驟中連線起來,並導致假陽性菌落。為了防止這種情況發生,載體可以用磷酸酶處理。DNA連線酶需要磷酸基團來形成磷酸二酯鍵,因此它不能連線脫磷酸化的載體末端。在這種情況下,插入片段DNA必須帶有5'磷酸基團,如果它是從PCR獲得的,則可能不是這種情況。
對於基因組DNA的克隆,要克隆的DNA從感興趣的生物體中提取。幾乎任何組織來源都可以使用,只要DNA沒有被過度降解。然後純化DNA以去除汙染的蛋白質、RNA和更小的分子。PCR方法通常用於在分子克隆之前擴增特定的DNA或RNA(RT-PCR)序列。
用於克隆實驗的DNA也可以透過使用逆轉錄酶從RNA中獲得(cDNA克隆),或以合成DNA的形式(人工基因合成)。cDNA克隆通常用於獲得代表感興趣細胞的mRNA群體的克隆,而合成DNA用於獲得設計者定義的任何精確序列。
然後用限制性內切酶處理純化的DNA,以產生具有可與載體末端連線的末端的片段。如有必要,可以在PCR步驟中將所需的限制位點新增到插入片段中。
在此步驟中,將載體和插入片段以適當的濃度混合在一起,並暴露於DNA連線酶,DNA連線酶將末端共價連線起來。然後,將含有隨機連線末端的DNA混合物準備好引入宿主生物體。
DNA連線酶只識別和作用於線性DNA分子的末端,通常產生具有隨機連線末端的複雜DNA分子混合物。將存在所需的產物(載體DNA共價連線到外源DNA),但其他序列(例如,外源DNA連線到自身,載體DNA連線到自身以及載體和外源DNA的高階組合)也通常存在。這種複雜的混合物在克隆過程的後續步驟中被分選出來,在將DNA混合物引入細胞後。
在體外操縱DNA之後,產物通常透過稱為轉化的過程引入大腸桿菌。為了進行轉化,細菌必須處於感受態。一些細菌表現出天然感受態,而在另一些細菌中,這種狀態必須透過實驗室程式誘導。通常,將細胞在含有二價陽離子(通常是氯化鈣)的溶液中在冷條件下孵育,然後暴露於熱休克。
如大腸桿菌等細菌的表面由於其細胞表面的磷脂和脂多糖而帶負電,DNA也帶負電。因此,二價陽離子的一個功能是透過協調磷酸基團和其他負電荷來遮蔽電荷,從而使DNA分子能夠粘附在細胞表面。有人建議,在冷條件下將細胞暴露於二價陽離子也可能改變或削弱細胞的細胞表面結構,使其更容易透入DNA。熱脈衝被認為會在細胞膜的兩側產生熱量不平衡,迫使DNA透過細胞孔或受損的細胞壁進入細胞。
電穿孔是另一種轉化方法。在這個方法中,細胞被短暫地暴露在10-20 kV/cm的電場中,這被認為會在細胞膜上 tạo ra các lỗ hổng,允許質粒 DNA 進入。在電擊後,細胞的膜修復機制會迅速封閉這些孔洞。
將重組 DNA 匯入選定的宿主生物體通常是一個低效率的過程,也就是說,只有一小部分細胞會真正攝取 DNA。這使得選擇步驟成為必需,在這個步驟中,只有那些攝取了具有可選擇標記的 DNA 的細胞才能存活。
當使用細菌細胞作為宿主生物體時,可選擇標記通常是一個賦予抗生素抗性的基因,通常是 ampicillin。該步驟透過將含有轉化子的溶液鋪板到含有抗生素的瓊脂平板上,並在 37°C 下過夜培養來進行。含有質粒的細胞將存活並形成菌落,而那些未能攝取質粒序列的細胞將死亡。
現代細菌克隆載體(例如 pUC19 及其後來的衍生物,包括 pGEM 載體)使用藍白篩選系統來區分轉基因細胞菌落和含有親本載體(即沒有插入重組序列的載體 DNA)的菌落。因此,很容易識別轉基因細菌克隆,而忽略那些不包含重組 DNA 的克隆。
如果載體不包含這種系統,可以進行菌落 PCR 來確定哪些菌落攜帶含有插入片段的質粒。限制性酶切和隨後的凝膠電泳是另一種選擇。這隻能在菌落被挑選、培養並分離出質粒後進行。
即使這些方法表明 DNA 已整合到載體中,也不能確定它是否是所需的序列。出於這個原因,需要進行 DNA 測序作為最終的驗證步驟。
Golden Gate 克隆是一種方法,它允許研究人員使用 II 類限制性內切酶和 DNA 連線酶同時定向地將多個 DNA 片段組裝成一個片段。這種組裝是在體外進行的。最常用的 II 類酶包括 BsaI、BsmBI 和 BbsI。
與 EcoRI 和 BamHI 等標準 II 類限制性內切酶不同,這些酶在識別位點之外切割 DNA,因此可以 tạo ra các overhang 不對稱。由於有 256 種可能的 overhang 序列,因此可以透過使用 overhang 序列組合來組裝多個 DNA 片段。
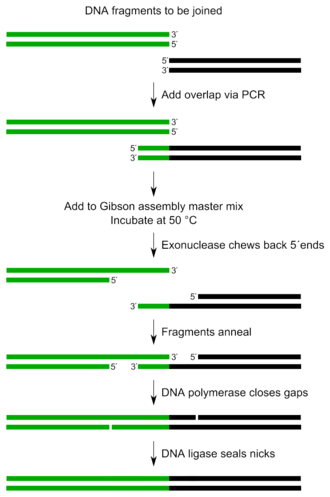
Gibson 組裝是一種 DNA 組裝方法,它允許在單個等溫反應中將多個 DNA 片段連線起來。它由 Daniel Gibson 於 2009 年在 J. Craig Venter 研究所 (JCVI) 工作時發明。
整個 Gibson 組裝反應只需要少量元件,操作步驟很少。
該方法可以基於序列同源性同時組合多個(>10)DNA 片段。它要求 DNA 片段包含與相鄰 DNA 片段的約 20-40 個鹼基對重疊。這些 DNA 片段與三種酶的混合物以及其他緩衝液組分混合。
三種必需的酶活性是:核酸外切酶、DNA 聚合酶和 DNA 連線酶。
- 核酸外切酶從 5' 端將 DNA 向回切除。相鄰 DNA 片段上產生的單鏈區域可以退火。
- DNA 聚合酶摻入核苷酸以填補任何缺口。
- DNA 連線酶共價連線相鄰片段的 DNA,從而消除 DNA 中的任何缺口。
整個混合物在 50°C 下孵育長達一小時。所得產物是連線成一個的不同的 DNA 片段。
與傳統的限制性酶/連線重組 DNA 克隆相比,這種 DNA 組裝方法具有許多優點。
- PCR 後無需對 DNA 片段進行限制性酶切。骨架載體可以被酶切,也可以透過 PCR 合成。
- 它比傳統的克隆方案簡單得多,因為需要更少的步驟和更少的試劑。該過程也需要更少的時間。
- 兩個 DNA 片段之間沒有留下限制性位點痕跡(又稱“無痕”)。
- 可以在單個試管反應中同時組合多個 DNA 片段。
TA 克隆方法利用了Taq 聚合酶的末端轉移酶活性。這種酶在 PCR 產物的 3' 端新增一個腺苷 (A)。如果 PCR 引物在 5' 端具有鳥嘌呤,最好是,因為這最大限度地提高了Taq DNA 聚合酶新增末端腺苷突出端的可能性。不應使用具有廣泛 3´ 到 5´ 核酸外切酶活性的聚合酶,因為它們不會留下 3´ 腺嘌呤突出端。目標載體被線性化並用鈍端限制性內切酶切割。然後使用末端轉移酶用二脫氧胸腺嘧啶三磷酸 (ddTTP) 對該載體進行尾部新增。重要的是使用 ddTTP 以確保只新增一個 T 殘基。這種尾部新增使載體在每個鈍端具有一個單一的 3'-突出胸腺嘧啶殘基。這使得可以直接將 PCR 產物克隆到線性化的載體中。
TOPO TA 克隆結合了 TA 克隆的優點和 DNA 拓撲異構酶 I 的連線活性。拓撲異構酶的生物學作用是切割和重新連線超螺旋 DNA 末端以促進複製。牛痘病毒拓撲異構酶 I 特異性識別 DNA 序列 5´-(C/T)CCTT-3'。在複製過程中,該酶特異性地在這個序列處消化 DNA,解開 DNA 並重新連線到胸腺嘧啶鹼基的 3' 磷酸基團。
TOPO 載體經過設計,使其在兩個線性末端都帶有這個特定序列 5´-(C/T)CCTT-3'。線性載體 DNA 已經具有共價連線到其兩條鏈的遊離 3' 末端的拓撲異構酶。然後將其與 PCR 產物混合。當 PCR 產物鏈的遊離 5' 末端攻擊每個載體鏈的拓撲異構酶/3' 末端時,這些鏈透過已結合的拓撲異構酶共價連線。當溶液在室溫下與所需的鹽一起孵育時,此反應有效地進行。
TOPO 鈍端克隆利用帶有連線到末端的拓撲異構酶的線性化載體,但它不依賴於 A/T 突出端。這意味著可以使用具有校對活性的聚合酶進行 PCR。
Gateway 克隆系統由 Invitrogen 於 1990 年代後期發明並商業化,它使研究人員能夠使用一組專有的重組序列,“Gateway att”位點,以及兩種專有的酶混合物,“LR 克隆酶”和“BP 克隆酶”,高效地在質粒之間轉移 DNA 片段。該方法基於噬菌體 λ 用於將其 DNA 整合到大腸桿菌染色體中的位點特異性重組系統。
Gateway克隆技術允許在不同的克隆載體之間轉移DNA片段,同時保持閱讀框。使用Gateway,可以克隆或亞克隆DNA片段以進行功能分析。該系統要求將DNA片段初始插入到帶有兩個側翼重組序列(稱為attL1和attL2)的質粒中,以開發“Gateway Entry克隆”。
包含絕大多數人類、小鼠和大鼠ORF的Gateway Entry克隆的大型檔案已從人類cDNA文庫克隆或化學合成,以使用NIH(美國國立衛生研究院)資金支援研究界。這些基因盒在標準Gateway克隆質粒中的可用性,幫助研究人員快速將這些盒轉移到促進基因功能分析的質粒中。Gateway克隆的初始設定需要更多時間,並且比傳統的限制性內切酶和連線酶克隆方法更昂貴,但它節省了時間,併為下游應用提供了更簡單、更高效的克隆。
該技術已被生命科學研究界廣泛採用,尤其是在需要將數千個DNA片段轉移到一種型別的質粒(例如,一種包含CMV啟動子用於在哺乳動物細胞中表達蛋白質的質粒)或將一個DNA片段轉移到許多不同型別的質粒(例如,用於細菌、昆蟲和哺乳動物蛋白質表達)的應用中。
Gateway克隆的第一步是製備Gateway Entry克隆。Entry克隆通常分兩步完成。
1) 使用基因特異性PCR引物和PCR擴增,將Gateway attB1和attB2序列分別新增到基因片段的5'端和3'端。
2) 然後將PCR擴增產物與稱為Gateway“Donor載體”的特殊質粒和專有的“BP Clonase”酶混合物混合。酶混合物催化attB序列包含的PCR產物重組插入Gateway Donor載體中的attP重組位點。一旦盒成為目標質粒的一部分,在Gateway命名法中它被稱為“Entry克隆”,重組序列被稱為Gateway“attL”型別。
然後可以簡單而有效地將Gateway Entry克隆中的基因盒轉移到任何Gateway Destination載體(Invitrogen對任何包含Gateway“attR”重組序列和元素(如啟動子和表位標籤,但不包括ORF)的Gateway質粒的命名法)中,使用專有的酶混合物“LR Clonase”。數千個Gateway Destination質粒已被製造出來,並且在世界各地的研究人員之間自由共享。Gateway Destination載體類似於包含多個克隆位點的經典表達載體。Gateway Destination載體可從Invitrogen、EMD(Novagen)和Covalys商業化獲得。
由於Gateway克隆使用專利重組序列,以及僅從Invitrogen獲得的專有酶混合物,該技術不允許研究人員切換供應商,並導致所有此類專利程式的鎖定效應。
總結Gateway克隆中涉及的不同步驟。
- Gateway BP反應:帶有側翼attB位點的PCR產物(例如,從cDNA文庫擴增)+包含attP位點的Donor載體+ BP克隆酶 => Gateway Entry克隆,包含attL位點,側翼感興趣的基因
- 此步驟可以用其他克隆方法代替
- Gateway LR反應:包含attL位點的Entry克隆+包含attR位點、啟動子和標籤的Destination載體+ LR克隆酶 => 表達克隆,包含attB位點,側翼感興趣的基因,準備基因表達。
連線獨立克隆 (LIC)
[edit | edit source]連線通常是傳統克隆方法中最有問題的一步。使用限制性內切酶時,此步驟是必要的,因為酶產生的短粘性末端不能永久地將載體和插入片段保持在一起。連線獨立克隆透過建立更長的突出端消除了對連線的需要。當載體和插入片段的互補突出端退火時,氫鍵足夠強以將它們保持在一起,並且可以將構建體直接轉化。然後由宿主細胞酶修復缺口。
為了建立突出端,使用T4 DNA聚合酶。該酶具有5'到3'聚合酶活性以及3'到5'核酸外切酶活性。核酸外切酶可以從3'端去除核苷酸,但只要溶液中存在所有核苷酸,它們就會立即被聚合酶替換。然而,在LIC中,只添加了dGTP到混合物中,這意味著核酸外切酶會一直進行到遇到序列中的第一個G為止。這意味著必須以使產生的突出端足夠長的方式設計重疊區域。
為了進行反應,載體透過限制性消化或PCR線性化,如果完全避免使用限制性內切酶。插入片段透過PCR擴增,並將與載體末端同源的序列新增到5'端。
序列和連線獨立克隆 (SLIC)
[edit | edit source]在這種連線獨立克隆的變體中,首先從反應中排除所有dNTP。在T4 DNA聚合酶的3'到5'核酸外切酶活性建立5'突出端的一段時間後,透過新增dCTP停止反應。一旦酶到達3'到5'鏈中的C,核酸外切酶活性就可以被聚合酶平衡。然而,由於只添加了一個核苷酸,所以突出端被保留,並且可以用來連線載體和插入片段。
In-Fusion克隆
[edit | edit source]In-Fusion® 克隆是Clontech開發的一種專有組裝方法,類似於SLIC和Gibson組裝。與這些方法相比,推薦的重疊長度只有15 bp,它使用痘苗病毒DNA聚合酶來建立突出端。
無縫連線克隆提取物 (SLiCE)
[edit | edit source]SLiCE類似於SLIC或Gibson組裝等克隆方法,因為它需要相同型別的DNA起始分子,併產生相同的產物。主要區別在於它使用細菌細胞提取物,這種提取物很容易產生,並且可能非常經濟實惠。
基於硫代磷酸酯的連線獨立基因克隆 (PLICing)
[edit | edit source]PLICing是一種無酶、序列無關的克隆方法,它基於硫代磷酸酯鍵的化學裂解反應。
第一步,載體和插入片段都透過PCR擴增,使用在5'端具有互補硫代磷酸酯核苷酸的引物。這些核苷酸形成硫代磷酸二酯鍵,而不是磷酸二酯鍵。PCR後,這些鍵在碘/乙醇溶液中裂解,產生單鏈突出端。載體和插入片段的末端雜交,並且可以轉化構建體。
