生命科學方法與概念/顯微鏡
顯微鏡 是使用顯微鏡觀察肉眼無法看到的物體和物體區域的技術領域(即不在正常眼睛解析度範圍內的物體)。顯微鏡有三個著名的分支:光學顯微鏡、電子顯微鏡和掃描探針顯微鏡。

明場顯微鏡 是所有光學顯微鏡照明技術中最簡單的。樣本照明是透射的(即從下方照射,從上方觀察)白光,樣本中的對比度是由樣本緻密區域中某些透射光的吸收引起的。

暗場顯微鏡 描述了一種用於增強未染色樣本對比度的照明技術。它透過從影像中排除未散射的光束來實現。這產生了經典的外觀,即暗背景上帶有明亮物體。
暗場顯微鏡的光路如下
- 光線進入顯微鏡用於照亮樣本。
- 一個特殊尺寸的圓盤,遮光板 會阻擋部分來自光源的光線,留下一個外部環形照明區域。在低放大倍率下,可以用一個寬相環來代替。
- 聚光鏡 將光線聚焦到樣本上。
- 光線進入樣本。大部分光線直接透射,而部分光線被樣本散射。
- 散射光 進入物鏡,而直接透射光 只是錯過了物鏡,由於直接照明阻擋 並沒有被收集到。
- 只有散射光會繼續產生影像,而直接透射光被省略。
暗場顯微鏡是一種非常簡單但有效的技術,非常適合用於涉及活的未染色生物樣本,例如來自組織培養物或單個水生單細胞生物的塗片。考慮到設定的簡單性,從該技術獲得的影像質量令人印象深刻。
暗場顯微鏡的主要限制是最終影像中看到的低光照度。這意味著樣本必須被非常強地照亮,這會對樣本造成損壞。暗場顯微鏡技術幾乎完全沒有偽影,這是由於過程的本質。但是,暗場影像的解釋必須非常小心,因為明場顯微鏡影像的常見暗特徵可能是不可見的,反之亦然。

相位襯度 是一種廣泛使用的技術,將折射率的差異顯示為對比度的差異。
使相位襯度顯微鏡中的相位變化可見的基本原理是,將照明背景光與樣本散射光(構成前景細節)分離,並對其進行不同的操作。
透過聚光鏡環形光經過聚光鏡環形光並聚焦到樣本上。一些照明光被樣本散射。剩餘的光線不受樣本影響,形成背景光。在觀察未染色的生物樣本時,散射光很弱,通常相對於背景光發生 -90° 相移。這意味著前景和背景幾乎具有相同的強度,導致影像對比度低(a)。
在相位襯度顯微鏡中,影像對比度透過兩個步驟得到改善。背景光透過相移環 相移 -90°。這消除了背景光和散射光之間的相位差,導致前景和背景之間的強度差增加(b)。為了進一步提高對比度,背景光被灰色濾光片環 (c)變暗。部分散射光會因環而發生相移和變暗。但是,背景光受到的影響更大,從而產生相位襯度效果。

以上描述的是負相位襯度。在其(更常見的)正形式中,背景光改為相移 +90°。因此,背景光相對於散射光將相移 180°。這意味著散射光將在 (b) 中從背景光中減去,以形成影像,其中前景比背景更暗。

微分干涉對比 (DIC) 顯微鏡是一種光學顯微鏡照明技術,用於增強未染色透明樣本的對比度。一個相對複雜的照明方案產生一個影像,其中物體出現在灰色背景上的黑色到白色。該影像類似於透過相位襯度顯微鏡獲得的影像,但沒有明亮的衍射光暈。
該系統在聚光鏡中包含一個特殊稜鏡(諾馬斯基稜鏡、沃拉斯頓稜鏡),它將光線分成普通光束和非凡光束。兩束光束之間的空間差異很小(小於物鏡的最大解析度)。透過樣本後,光束由物鏡中的類似稜鏡重新組合。
在均勻樣本中,兩束光束之間沒有差異,不會產生對比度。然而,在折射邊界附近(例如細胞質中的細胞核),普通光束和非凡光束之間的差異會在影像中產生浮雕。微分干涉對比需要偏振光源才能起作用;必須在光路中安裝兩個偏振濾光片,一個在聚光鏡下方(偏振器),另一個在物鏡上方(分析器)。
- 非偏振光進入顯微鏡,並在 45° 處偏振。
- 偏振光進入第一個諾馬斯基改進的沃拉斯頓稜鏡,並被分成兩束光線,兩束光線相互偏振 90°,即取樣光線和參考光線。
- 這兩束光線被聚光鏡聚焦,以便透過樣本。這兩束光線被聚焦,以便它們穿過樣本中的兩個相鄰點,相距約 0.2 μm。
- 光線穿過樣本的相鄰區域,以剪下量分隔。該分離通常類似於顯微鏡的解析度。它們將在區域折射率或厚度不同的區域經歷不同的光程長度。由於波在光學密度更大的材料中經歷的延遲,這會導致一束光線相對於另一束光線的相位變化。許多光線對穿過樣本中相鄰點的對(以及它們被樣本吸收、折射和散射)意味著樣本的影像現在將由 0° 和 90° 偏振光攜帶。如果單獨檢視,它們將是樣本的明場影像,彼此略微偏移。光還攜帶人眼無法看到的資訊,即光線的相位。不同的偏振在這一點上防止了這兩個影像之間的干擾。
- 光線穿過物鏡,並被第二個諾馬斯基改進的沃拉斯頓稜鏡聚焦。
- 第二個稜鏡將這兩束光線重新組合成一束在 135° 處偏振的光線。光線的組合會導致干涉,根據光程差使影像在該點變亮或變暗。

影像
[edit | edit source]影像在非常傾斜的光照下呈現三維物體的視覺效果,在相應的表面上形成強烈的明暗陰影。表觀光照方向由沃拉斯頓稜鏡的方位決定。
如上所述,影像是由兩個相同的明場影像略微偏移疊加(通常約為0.2 μm)生成的,然後由於相位差導致的干涉將相位變化(因此光程)轉化為可見的明暗變化。這種干涉可能是相長干涉或相消干涉,從而產生出三維特性的視覺效果。
產生干涉的典型相位差非常小,很少超過90°(波長的四分之一)。這是由於大多數樣品及其介質的折射率相似造成的:例如,水中的細胞只有大約0.05的折射率差。這種小的相位差對於DIC的正常功能至關重要,因為如果兩種物質交界處的相位差太大,那麼相位差可能達到180°(半波長),導致完全相消干涉,形成異常的暗區;如果相位差達到360°(全波長),則會產生完全相長干涉,形成異常的亮區。
DIC在涉及活體和未染色生物樣品(如組織培養塗片或單個水生單細胞生物)的應用中具有很強的優勢。在這種情況下的解析度和清晰度在標準光學顯微鏡技術中是無與倫比的。
DIC的主要侷限性在於它需要一個與周圍環境具有相當相似折射率的透明樣品。DIC不適用於(在生物學中)厚樣品(如組織切片)和高度色素沉著的細胞。DIC也不適用於大多數非生物學應用,因為它依賴於偏振,而許多物理樣品會影響偏振。
熒光顯微鏡
[edit | edit source]
熒光顯微鏡是一種光學顯微鏡,它使用熒光和磷光而不是(或除了)反射和吸收。
標本用特定波長(或波長)的光照射,該光被熒光團吸收,導致熒光團發射更長波長的光。照射光透過使用光譜發射濾光片與微弱的發射熒光分離。熒光顯微鏡的典型元件包括光源(氙弧燈或汞蒸汽燈很常見;更先進的形式是高功率LED和雷射器)、激發濾光片、二向色鏡(或二向色分束器)和發射濾光片。濾光片和二向色鏡的選擇要與用於標記標本的熒光團的光譜激發和發射特性相匹配。透過這種方式,一次可以對單個熒光團的分佈成像。多個熒光團的彩色影像必須透過組合多個單色影像來合成。

大多數使用的熒光顯微鏡是落射熒光顯微鏡,其中熒光團的激發和熒光檢測透過相同的路徑(即透過物鏡)進行。這些顯微鏡廣泛應用於生物學領域,也是更先進的顯微鏡設計(如共聚焦顯微鏡和全內反射熒光顯微鏡(TIRF))的基礎。
反捲積
[edit | edit source]熒光顯微鏡是一種強大的技術,可以顯示覆雜環境中特異性標記的結構,並提供生物結構的三維資訊。然而,這些資訊會被以下事實所模糊:在照射下,所有熒游標記的結構都會發射光,無論它們是否處於焦點。因此,特定結構的影像總是會被來自非焦點結構的光的貢獻所模糊。這種現象會導致對比度降低,尤其是在使用具有高解析度的物鏡(通常是高數值孔徑的油浸物鏡)時。
然而,模糊不是由隨機過程(如光散射)引起的,而是可以由顯微鏡成像系統中影像形成的光學特性很好地定義。如果我們考慮一個小的熒光光源(本質上是一個亮斑),來自該斑點的光會隨著斑點變得越來越失焦而從我們的視角擴充套件開來。在理想條件下,這會在第三(軸向)維度上產生該點光源的“沙漏”形狀。這種形狀被稱為顯微鏡成像系統點擴散函式(PSF)。由於任何熒光影像都是由大量這樣的小的熒光光源組成的,因此影像被認為是“被點擴散函式卷積”。
瞭解這種點擴散函式意味著可以使用計算機方法(通常被稱為反捲積顯微鏡)在一定程度上逆轉這個過程。有各種各樣的演算法可用於2D或3D反捲積。它們可以大致分為非恢復和恢復方法。雖然非恢復方法可以透過從焦點平面移除非焦點光來提高對比度,但只有恢復方法才能真正將光重新分配到其適當的起源位置。以這種方式處理熒光影像可能比直接獲取沒有非焦點光的影像(如來自共聚焦顯微鏡的影像)更具優勢,因為否則被消除的光訊號將成為有用的資訊。對於3D反捲積,人們通常提供從不同焦點平面拍攝的一系列影像(稱為Z堆疊),以及對PSF的瞭解,PSF可以透過實驗或理論上從已知顯微鏡的所有貢獻引數推匯出。
共聚焦顯微鏡
[edit | edit source]共聚焦顯微鏡是一種光學成像技術,透過在透鏡的共焦平面上新增空間針孔來消除非焦點光,從而提高顯微照片的光學解析度和對比度。它能夠從獲得的影像中重建三維結構。
在傳統的(即廣域)熒光顯微鏡中,整個標本被光源均勻地照射。光路中的所有標本部分都同時被激發,產生的熒光被顯微鏡的光電探測器或相機檢測,包括很大一部分非焦點背景部分。相反,共聚焦顯微鏡使用點照明和位於探測器前方光學共焦平面上的針孔來消除非焦點訊號——“共聚焦”這個名稱源於這種配置。由於只有來自焦平面附近產生的熒光才能被探測到,因此影像的光學解析度(尤其是在樣品深度方向上)遠高於廣域顯微鏡。然而,由於來自樣品熒光的大部分光在針孔處被阻擋,因此這種提高的解析度是以訊號強度降低為代價的,因此通常需要長時間曝光。

由於一次只照射樣品中的一個點,因此2D或3D成像需要在標本中進行規則光柵掃描(即平行掃描線的矩形圖案)。焦平面的可實現厚度主要由所用光的波長除以物鏡的數值孔徑來決定,但也受標本的光學特性影響。這種薄的光學切片功能使這些型別的顯微鏡特別適合3D成像和樣品表面的輪廓分析。
旋轉盤顯微鏡
[edit | edit source]旋轉盤共聚焦顯微鏡使用一個圓盤上的一系列移動針孔來掃描光斑。由於一系列針孔平行地掃描一個區域,因此每個針孔可以在特定區域停留更長的時間,從而與雷射掃描顯微鏡相比,減少了照亮樣品所需的激發能量。激發能量的降低減少了樣品的毒性和光漂白,這使其成為成像活細胞或生物體的首選系統。
熒光相關光譜(FCS)
[edit | edit source]
典型的FCS裝置由一條雷射線組成,雷射線透過二向色鏡反射到顯微鏡物鏡中。雷射束聚焦在樣品中,樣品中含有熒光分子,其稀釋度非常高,以至於焦斑中只有幾個分子(通常是1-100個分子在一個fL中)。當粒子穿過焦體積時,它們會發生熒光。這種光被相同的物鏡收集,並且由於它相對於激發光紅移,因此它穿過二向色鏡到達探測器。產生的電子訊號可以被直接儲存為強度與時間的軌跡,以便稍後分析,或者被計算以直接生成自相關。FCS曲線本身只代表時間頻譜。對物理現象的結論必須透過適當的模型從那裡提取。感興趣的引數是在將自相關曲線擬合到模型函式形式後發現的。當已知適當的模型時,FCS可用於獲得定量資訊,例如擴散係數、流體力學半徑、平均濃度和化學反應動力學速率。
熒光壽命成像顯微鏡(FLIM)
[edit | edit source]熒光壽命成像顯微鏡(FLIM)是一種成像技術,用於根據熒光樣品熒光的衰減速率差異來產生影像。
這具有最小化厚樣本層中光子散射影響的優勢。熒光壽命成像產生影像,其中每個畫素的強度由熒光壽命決定,這允許觀察具有不同熒光衰減速率的材料之間的對比度(即使這些材料在完全相同的波長處發出熒光),並且還產生顯示其他衰減途徑變化的影像,例如在 FRET 成像中。

全內反射熒光顯微鏡 (TIRFM) 是一種顯微鏡,可以透過它觀察樣本的薄區域,通常小於 200 奈米。
在細胞和分子生物學中,許多細胞表面分子事件,如細胞粘附、激素對細胞的結合、神經遞質的分泌和膜動力學,已被用傳統熒光顯微鏡研究。然而,與樣本表面結合的熒光團和周圍介質中的熒光團處於平衡狀態。當這些分子被傳統熒光顯微鏡激發和檢測時,來自與表面結合的那些熒光團的熒光往往會被來自未結合分子數量大得多的背景熒光所淹沒。
TIRFM 使用倏逝波來選擇性地照亮和激發緊鄰玻璃-水介面的樣本受限區域中的熒光團。倏逝波僅在入射光在玻璃-水介面發生全內反射時產生。倏逝電磁場從介面呈指數衰減,因此僅穿透到樣品介質中約 100 奈米。因此,TIRFM 能夠選擇性地觀察表面區域,例如細胞的基底質膜(約 7.5 奈米厚),如上圖所示。然而,需要注意的是,視覺化的區域至少有幾百奈米寬,因此在 TIRF 顯微鏡檢查期間,除了質膜外,質膜下方的胞質區域也必然會被視覺化。質膜的選擇性視覺化以高軸向解析度呈現活細胞中質膜的特徵和事件。
TIRF 也可用於觀察單個分子的熒光,使其成為生物物理學和定量生物學的重要工具。
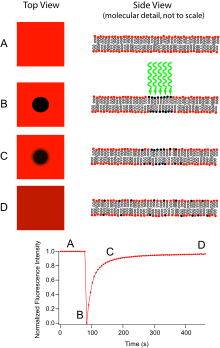
光漂白後熒光恢復 (FRAP) 指的是一種光學技術,能夠量化含有熒游標記探針的分子薄膜的二維橫向擴散,或檢查單個細胞。該技術在細胞膜擴散和蛋白質結合的生物學研究中非常有用。此外,熒光磷脂雙層 (或單層) 的表面沉積允許根據表面結構和自由能來表徵親水性 (或疏水性) 表面。
基本裝置包括一臺光學顯微鏡、一個光源和一些熒光探針。該技術首先在光漂白前儲存樣本的背景影像。接下來,光源聚焦到可視區域的一小塊區域。該區域的熒光團接受高強度照明,導致它們的熒光壽命迅速過去。現在顯微鏡中的影像是一個均勻的熒光場,有一個明顯的暗點。隨著布朗運動的進行,仍具有熒光的探針將在整個樣本中擴散,並取代漂白區域中的非熒光探針。這種擴散以有序的方式進行,可以從擴散方程中解析地確定。
光漂白後熒光損失 (FLIP) 與 FRAP 密切相關。這兩種顯微鏡技術的主要區別在於,FRAP 涉及研究細胞在單次光漂白事件後恢復的能力,而 FLIP 涉及研究在多次光漂白事件後熒光損失如何在整個細胞中傳播。這種目的上的差異也導致了對細胞哪些部分進行觀察的差異。在 FRAP 中,實際光漂白的區域是感興趣的區域。相反,在 FLIP 中,感興趣的區域位於正在光漂白的區域的外部。另一個重要的區別是,在 FRAP 中,存在單個光漂白事件和一個恢復期來觀察熒光團移動回漂白部位的情況。然而,在 FLIP 中,發生多次光漂白事件以防止未漂白的熒光團返回漂白區域。與 FLIP 一樣,FRAP 用於研究膜性細胞器的連續性。FLIP 和 FRAP 通常一起使用以確定 GFP 標記蛋白質的遷移率。FLIP 也可用於測量細胞區域之間的分子轉移,而與移動速度無關。這允許對細胞內蛋白質運輸進行更全面的分析。這不同於 FRAP,FRAP 主要用於確定蛋白質僅在光漂白區域附近的移動性。
超解析度顯微鏡 是一種光學顯微鏡。由於光的衍射,傳統光學顯微鏡的解析度受到限制,正如恩斯特·阿貝在 1873 年所述。可以實現的解析度的一個良好近似值是點擴散函式的半峰全寬 (FWHM),並且具有高數值孔徑和可見光的精確廣域顯微鏡通常達到約 250 奈米的解析度。
4Pi 顯微鏡是一種雷射掃描熒光顯微鏡,具有改進的軸向解析度。典型的 500-700 奈米值可以提高到 100-150 奈米,這對應於一個幾乎球形的焦斑,其體積比標準共聚焦顯微鏡小 5-7 倍。
解析度的提高是透過使用兩個相對的物鏡來實現的,這兩個物鏡都聚焦到相同的幾何位置。此外,透過兩個物鏡的光程差被仔細調整為最小。透過這種方式,位於兩個物鏡共同焦區的分子可以從兩側被相干地照亮,並且反射光或發射光也可以被相干地收集,即發射光的相干疊加在探測器上是可能的。用於照亮和檢測的立體角增加,並接近理想情況。在這種情況下,樣本從所有側面同時被照亮和檢測。

結構照明顯微鏡 依賴於特定的顯微鏡協議和曝光後的廣泛軟體分析。SI 的主要概念是使用圖案化的光照亮樣本,並透過測量莫爾條紋(來自照明圖案和樣本的干涉)中的條紋來提高解析度。否則無法觀察到的樣本資訊可以從條紋中推斷出來並透過計算恢復。
SI 透過從可觀察區域之外的頻率空間收集資訊來增強空間解析度。此過程在倒空間中完成:SI 影像的傅立葉變換 (FT) 包含來自倒空間不同區域的疊加附加資訊;透過使用幾個幀並將照明移位一些相位,可以計算分離和重建 FT 影像,該影像具有更多解析度資訊。反向 FT 將重建的影像返回到超解析度影像。

受激發射損耗顯微鏡 (STED) 使用兩個雷射脈衝:激發脈衝用於將熒光分子激發到熒光狀態,而 STED 脈衝則用於透過受激發射使熒光分子去激發。在實踐中,首先應用激發雷射脈衝,然後緊隨其後的是 STED 脈衝(但也有使用連續波雷射的無脈衝 STED 技術)。此外,STED 脈衝經過改造,具有一個零強度點,該點與激發焦點重合。由於受激發射速率對 STED 光束強度的非線性依賴性,焦點激發點周圍的所有熒光分子都將處於關閉狀態(熒光分子的基態)。透過掃描此焦點,可以獲取影像。
正常熒光透過將電子從基態激發到不同基本能量級的激發電子態(S0 躍遷至 S1)來實現,該電子在弛豫回基態 (s1) 後,透過從 S1 下降到 S0 上的振動能級而發射光子。STED 在光子釋放之前會中斷此過程。被激發的電子被迫弛豫到比熒光躍遷所進入的更高的振動態,導致釋放的光子發生紅移。由於電子要進入更高的振動態,這兩個態的能量差小於正常熒光差。能量的降低提高了波長,並導致光子進一步移向光譜的紅色端。這種偏移區分了兩種型別的光子,並允許忽略受雷射子。
要迫使這種替代發射發生,入射光子必須撞擊熒光分子。這種被入射光子撞擊的必要性對 STED 有兩個含義。首先,入射光子的數量直接影響這種發射的效率,其次,當光子數量足夠多時,熒光可以完全被抑制。為了獲得抑制熒光所需的足夠數量的入射光子,用於產生光子的雷射必須具有很高的強度。不幸的是,這種高強度雷射會導致熒光分子光漂白的問題。
隨機光學重建顯微鏡 (STORM)、光啟用定位顯微鏡 (PALM) 和熒光光啟用定位顯微鏡 (FPALM) 是一種超解析度成像技術,利用光開關熒光分子的順序啟用和時間分辨定位來建立高解析度影像。在成像過程中,任何給定時刻只有一個光學可分辨的熒光分子子集被啟用到熒光狀態,使得透過找到特定熒光分子單分子影像的質心位置,可以高精度地確定每個熒光分子的位置。隨後使熒光分子失活,並激活和成像另一個子集。重複此過程允許定位眾多熒光分子,並從影像資料構建超解析度影像。這三種方法在短時間內獨立發表,其原理相同。STORM 最初使用連線到核酸或蛋白質的 Cy5 和 Cy3 染料進行描述,而 PALM 和 FPALM 則使用光開關熒光蛋白進行描述。原則上,可以使用任何光開關熒光分子。
參考文獻
- Ishikawa-Ankerhold, H.C., Ankerhold, R., Drummen, G.P.C., 2012. 高階熒光顯微技術--FRAP、FLIP、FLAP、FRET 和 FLIM。 分子 17, 4047–132。 doi:10.3390/molecules17044047
- Leung, B.O., Chou, K.C., 2011. 生物學超解析度熒光顯微鏡綜述。 應用光譜學 65, 967–80。 doi:10.1366/11-06398
- Lichtman, J.W., Conchello, J.-A., 2005. 熒光顯微鏡。 自然方法 2, 910–9。 doi:10.1038/nmeth817
- Petty, H.R., 2007. 熒光顯微鏡:成熟和新興方法、實驗策略以及免疫學中的應用 709, 687–709。 doi:10.1002/jemt
