生命科學方法與概念/PCR

聚合酶鏈式反應 (PCR) 用於將一段 DNA 擴增幾個數量級,產生特定 DNA 序列的數千到數百萬個複製。
PCR 由 Kary Mullis 於 1983 年開發,現已成為醫療和生物研究實驗室中常用的、且經常不可或缺的技術,應用於各種領域。1993 年,Mullis 因其在 PCR 方面的貢獻與 Michael Smith 一起獲得了諾貝爾化學獎。
該方法依賴於熱迴圈,包括對反應進行重複的加熱和冷卻迴圈,以實現 DNA 熔化和 DNA 的酶促複製。包含與目標區域互補序列的引物以及耐熱 DNA 聚合酶是實現選擇性和重複擴增的關鍵成分。隨著 PCR 的進行,生成的 DNA 本身被用作複製的模板,啟動連鎖反應,其中 DNA 模板呈指數級擴增。PCR 可以被廣泛修改以執行各種遺傳操作。


PCR 用於擴增 DNA 鏈的特定區域(DNA 目標)。大多數 PCR 方法通常擴增 0.1 到 10 千鹼基對 (kbp) 的 DNA 片段,儘管一些技術允許擴增高達 40 kbp 的片段。擴增產物的數量由反應中可用的底物決定,隨著反應的進行,底物變得有限。
基本的 PCR 設定需要多種成分和試劑。這些成分包括
- 包含待擴增 DNA 區域的 DNA 模板。
- 兩個引物,它們與 DNA 目標的正鏈和反鏈的 3' 端互補。
- 一種耐熱的 DNA 聚合酶
- 脫氧核苷三磷酸 (dNTP)
- 緩衝溶液,為 DNA 聚合酶的最佳活性及穩定性提供合適的化學環境。
PCR 通常在 熱迴圈儀 中的小反應管(0.2-0.5 毫升體積)中,以 10-200 微升的反應體積進行。熱迴圈儀加熱和冷卻反應管,以實現反應每個步驟所需的溫度(見下文)。許多現代熱迴圈儀利用珀耳帖效應,透過簡單地反轉電流,就可以實現對裝有 PCR 管的模組進行加熱和冷卻。薄壁反應管具有良好的熱傳導性,可以快速熱平衡。大多數熱迴圈儀都有加熱蓋,以防止反應管頂部出現冷凝。缺少加熱蓋的較舊熱迴圈儀需要在反應混合物頂部放置一層油或在管內放置一個蠟球。

PCR 通常包括一系列 20-40 次重複的溫度變化,每次迴圈通常包括三個不同的溫度步驟。迴圈通常在高溫(>90°C)下進行單次溫度步驟,並在最後進行一次保持,以進行最終產物延伸或短暫儲存。使用的溫度以及它們在每個迴圈中應用的時間長度取決於多種引數。這些引數包括用於 DNA 合成的聚合酶、反應中二價離子和 dNTP 的濃度以及引物的熔解溫度 (Tm)。
- 初始化 (僅適用於需要透過熱啟動 PCR 進行熱活化的 DNA 聚合酶):此步驟包括將反應加熱到 94-96°C(或如果使用極耐熱的聚合酶,則為 98°C),並保持 1-9 分鐘。
- 變性:此步驟是第一個常規迴圈事件,包括將反應加熱到 94-98°C,持續 20-30 秒。它透過破壞互補鹼基之間的氫鍵,使 DNA 模板鏈分離,產生單鏈 DNA 分子。
- 退火:反應溫度降低到 50-65°C,持續 20-40 秒,允許引物退火到單鏈 DNA 模板。此溫度需要足夠低,以允許引物與鏈雜交,但需要足夠高,以確保雜交的特異性,即引物應僅與模板的完全互補部分結合。如果溫度過低,引物可能會不完全結合。如果溫度過高,引物可能不會結合。通常,退火溫度比所用引物的 Tm 低約 3-5°C。只有當引物序列與模板序列非常匹配時,才會形成穩定的 DNA-DNA 氫鍵。聚合酶與引物-模板雜交體結合,並開始 DNA 形成。
- 延伸:此步驟的溫度取決於所用的 DNA 聚合酶;Taq 聚合酶在 75-80°C 時具有最佳活性溫度,並且通常在這種酶的情況下使用 72°C 的溫度。在此步驟中,DNA 聚合酶透過新增與模板互補的 dNTP,以 5' 到 3' 的方向合成與 DNA 模板鏈互補的新 DNA 鏈,將 dNTP 的 5'-磷酸基團與新生 DNA 鏈末端的 3'-羥基結合。延伸時間既取決於所用的 DNA 聚合酶,也取決於待擴增的 DNA 片段的長度。作為經驗法則,在最佳溫度下,DNA 聚合酶每分鐘會聚合一千個鹼基。在最佳條件下,即如果由於底物或試劑限制而沒有限制,那麼在每個延伸步驟中,DNA 目標的數量都會加倍。延伸後,DNA 會再次變性,新合成的片段可以在下一個迴圈中用作模板,從而導致特定 DNA 片段的指數級擴增。
- 最終延伸:此單一步驟偶爾在 70-74°C(這是大多數用於 PCR 的聚合酶的最佳活性所需的溫度)下進行,持續 5-15 分鐘,以確保任何剩餘的單鏈 DNA 完全延伸。
- 最終保持:此步驟在 4-15°C 下進行無限時間,可用於短期儲存反應。
好的引物對於成功的 PCR 反應至關重要。設計引物時應考慮幾個因素
- 一般來說,引物的長度應該在 18-30 個核苷酸之間。
- 嘗試使引物的熔解溫度 (Tm) 在 65°C 到 75°C 之間,並且彼此相差 5°C 以內。
- 目標 GC 含量在 40% 到 60% 之間。
- 在每個引物的 3' 端使用 G 或 C(“GC 夾”)以促進結合。但是,3 個或更多個 G 或 C 鹼基在該端可能會穩定引物的非特異性退火。
- 引物不應自身互補,也不應與反應中的另一個引物互補,否則它們會形成二聚體。特別是引物的 3' 端至關重要。
- 引物不應形成穩定的二級結構。
- 嘗試避免 4 個或更多個相同鹼基的連續序列,或二核苷酸重複。
- 應將引物與模板序列進行比較,以檢測二級結合位點。
- 當在引物的 5' 端新增限制位點時,新增 3 到 4 個額外的核苷酸以允許有效切割。
以下公式可以用作經驗法則來估計引物的熔解溫度
由於GC鹼基對比AT鹼基對更穩定,因此假設每個G或C使熔解溫度升高4°C,而A或T僅貢獻2°C。有一些工具使用更復雜的演算法來計算Tm
- OligoAnalyzer 計算Tm,還可以檢查二聚體和髮夾結構。
- 寡核苷酸性質計算器 使用不同的演算法計算Tm。
- NEB Tm 計算器 考慮了聚合酶。
- AmplifX 評估引物的多種特性。
引物可以透過手動設計或使用軟體來設計,這些軟體可以根據預先確定的引數為給定的模板序列推薦引物對。
- Primer3 設計引物,並讓使用者對引物的性質有很大控制權。
- Primer-BLAST 使用Primer3設計引物,然後使用BLAST自動分析其特異性。
這些只是眾多用於設計和分析引物的工具中一些常用的例子。有些工具針對特殊應用進行了最佳化,例如即時PCR。以下網站提供了引物設計工具的概述
即時PCR
[edit | edit source]即時PCR或定量PCR是PCR的一種變體,用於擴增和同時檢測或定量DNA分子。該程式遵循聚合酶鏈式反應的一般原理;其關鍵特徵是在“即時”反應過程中檢測到擴增的DNA。與標準PCR相比,這是一種新方法,在標準PCR中,反應產物是在反應結束時檢測到的。定量PCR中用於檢測產物的兩種常用方法是
- 與任何雙鏈DNA插入的非特異性熒光染料。
- 由標記有熒光報告基因的寡核苷酸組成的序列特異性DNA探針。
MIQE指南(定量即時PCR實驗出版物的最低資訊)建議使用縮寫qPCR來表示定量即時PCR,而使用RT-qPCR來表示逆轉錄-qPCR。縮寫“RT-PCR”通常表示逆轉錄聚合酶鏈式反應,而不是即時PCR,但並非所有作者都遵循此慣例。
檢測方法
[edit | edit source]熒光染料
[edit | edit source]檢測和定量PCR產物的最簡單方法是使用DNA結合染料,如溴化乙錠或SYBR Green。這些熒光團的熒光強度在與DNA結合時會增加,這意味著PCR過程中DNA的積累與熒光強度的增加相關。測量是在每個迴圈的延伸結束時進行的。
這種方法的缺點是特異性低。無法區分不同的PCR產物,非特異性產物(如引物二聚體)會干擾目標序列的準確定量。
熒光探針
[edit | edit source]熒光報告探針僅檢測包含探針序列的DNA;因此,使用報告探針顯著提高了特異性,並且即使在非特異性DNA擴增存在的情況下也能實現定量。熒光探針可用於多重檢測——在同一反應中檢測多個基因——基於具有不同顏色標記的特異性探針,前提是所有靶基因的擴增效率相似。
這些方法依賴於熒光共振能量轉移(FRET)來檢測兩個熒光團是否在空間上接近。FRET是一種在兩個感光分子之間發生能量轉移的機制。最初處於電子激發態的供體髮色團可以透過非輻射偶極-偶極耦合將能量轉移到受體髮色團。這種能量轉移的效率與供體和受體之間的距離的六次方成反比,使得FRET對距離的微小變化極其敏感。因此,可以利用FRET效率的測量來確定兩個熒光團是否彼此之間的距離在一定範圍內。
LightCycler探針
[edit | edit source]LightCycler探針由兩個寡核苷酸組成,它們互補於靶序列的相鄰區域。一個探針攜帶一個FRET供體,另一個攜帶一個FRET受體。當兩個寡核苷酸都與靶序列退火時,就會發生FRET,並且可以利用熒光強度進行定量。

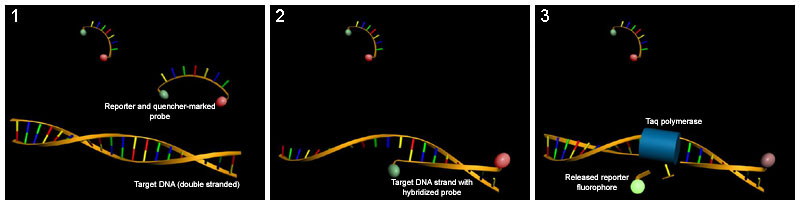
TaqMan探針
[edit | edit source]這種方法依賴於一個寡核苷酸,該寡核苷酸在一端有一個熒光報告基因,在另一端有一個熒光猝滅劑。只要探針完整,報告基因與猝滅劑的緊密接近就會阻止檢測其熒光。探針在兩個引物之間退火,並在延伸過程中被Taq聚合酶的5'-3'外切核酸酶活性降解。這打破了報告基因-猝滅劑的接近,從而允許未猝滅的熒光發射,這可以在用雷射激發後檢測到。因此,在每個PCR迴圈中,由報告探針靶向的產物增加會導致熒光比例增加,這是由於探針分解和報告基因釋放所致。
定量
[edit | edit source]
與終點PCR(傳統PCR)不同,即時PCR可以透過測量熒光來對擴增過程中的任何點進行目標產物的定量(實際上,測量的是其在給定閾值上的水平)。定量PCR中常用的DNA定量方法依賴於將熒光繪製成迴圈次數。用於檢測基於DNA的熒光的閾值略高於背景。熒光超過閾值的迴圈次數稱為閾值迴圈(Ct)或根據MIQE指南,定量迴圈(Cq)。
在指數擴增階段,目標 DNA 模板(擴增子)的數量每迴圈翻倍。例如,Cq 比另一個樣本早 3 個迴圈的 DNA 樣本,其模板量是後者的 2^3 = 8 倍。然而,不同引物和模板之間的擴增效率往往不同。因此,引物-模板組合的效率是在 DNA 模板的系列稀釋實驗中評估的,以建立 Cq 隨每次稀釋而變化的標準曲線。然後使用線性迴歸的斜率來確定擴增效率,如果 1:2 的稀釋導致 Cq 差異為 1,則擴增效率為 100%。迴圈閾值法對反應機制做了幾個假設,並且依賴於擴增曲線低信噪比區域的資料,這會在資料分析過程中引入很大差異。
為了量化基因表達,將目標基因的 RNA 或 DNA 的 Cq 從同一樣本中管家基因的 RNA/DNA 的 Cq 中減去,以消除不同樣本之間 RNA 量和質量差異的影響。這種歸一化程式通常稱為ΔCt 法,允許比較不同樣本中目標基因的表達。然而,要進行這種比較,需要在所有樣本中,正常化參考基因的表達非常相似。因此,選擇滿足此標準的參考基因非常重要,而且往往具有挑戰性,因為只有極少數基因在不同條件或組織中表現出相同的表達水平。雖然迴圈閾值分析已與許多商業軟體系統整合,但在可重複性成為問題的情況下,應該考慮更準確、更可靠的擴增曲線資料分析方法。
熔解曲線
[edit | edit source]
qPCR 允許透過分析其熔解溫度來鑑定特定的擴增 DNA 片段。這通常使用雙鏈 DNA 結合染料作為報告分子(例如 SYBR Green)來完成。DNA 熔解溫度對擴增片段具有特異性。該技術的實驗結果透過比較分析的 DNA 樣品的解離曲線獲得。
與傳統的 PCR 不同,這種方法避免了之前使用電泳技術來展示所有樣本的結果。這是因為,儘管是一種動力學技術,但定量 PCR 通常在不同的終點進行評估。因此,該技術通常提供更快的結果和/或使用比電泳更少的試劑。如果需要後續電泳,則只需測試那些即時 PCR 顯示結果存疑的樣本,或者對那些對特定決定因素檢測呈陽性的樣本進行結果驗證。
PCR 的其他變體
[edit | edit source]- 組裝 PCR(也稱為聚合酶迴圈組裝或 PCA)是透過對一組具有短重疊片段的長寡核苷酸進行 PCR 來合成長的 DNA 結構,將兩個或多個 DNA 片段組裝成一個片段。在聚合酶迴圈過程中,寡核苷酸與互補片段退火,然後被聚合酶填補。因此,每個迴圈都隨機增加了各種片段的長度,具體取決於哪些寡核苷酸相互找到。至關重要的是,所有片段之間都存在某種程度的互補性,否則將不會產生最終的完整序列。在這一初始構建階段之後,添加了涵蓋兩端的額外引物以執行常規的 PCR 反應,從而將目標序列從所有較短的不完整片段中擴增出來。然後可以使用凝膠純化來識別和分離完整的序列。這種技術可以替代基於連線的組裝。
- 在菌落 PCR中,細菌菌落透過 PCR 直接篩選,無需過夜培養和質粒製備。菌落 PCR 可以用作一種高通量方法,用於檢查細胞中的質粒是否包含插入片段。使用合適的引物,還可以確定插入片段的方向。使用無菌移液器吸頭對菌落進行取樣,將少量細胞轉移到 PCR 混合物中。在最初的變性步驟中,質粒從細胞中釋放出來,可以作為模板。延長變性步驟和使用裂解緩衝液可以促進細胞裂解。
- 熱啟動 PCR是一種手動操作的技術,在新增聚合酶之前,將反應成分加熱到 DNA 熔解溫度(例如 95 °C)。這樣可以防止在較低溫度下發生非特異性擴增。或者,特種試劑在環境溫度下抑制聚合酶的活性,要麼透過抗體的結合,要麼透過共價結合的抑制劑的存在,這些抑制劑僅在高溫活化步驟後解離。'熱啟動/冷終止 PCR' 是使用新的雜交聚合酶實現的,這些聚合酶在環境溫度下不活躍,僅在升高的溫度下被啟用。
- 多重 PCR使用幾對引物退火到不同的目標序列。這允許在單個樣本中同時分析多個目標。例如,在檢測基因突變時,可以組合六個或更多個擴增。在 DNA 指紋圖譜的標準方案中,檢測的目標通常以 3 或 4 組進行擴增。
- 巢狀 PCR用於提高 DNA 擴增的特異性。在兩個連續的反應中使用兩組引物。在第一次 PCR 中,使用一對引物產生 DNA 產物,這些產物可能包含從非目標區域擴增的產物。然後,第一次 PCR 的產物用作第二次 PCR 的模板,使用一個(半巢狀)或兩個不同的引物,其結合位點位於(巢狀)第一組內,從而提高了特異性。與傳統 PCR 相比,巢狀 PCR 在特異性地擴增長 DNA 產物方面往往更成功,但它需要更詳細地瞭解目標序列。


- 重疊延伸聚合酶鏈反應(OE-PCR)也稱為重疊延伸/重疊懸垂延伸(SOE)PCR。它用於在序列的特定位置插入特定的突變,或者將較小的 DNA 片段拼接成較大的多核苷酸。
與大多數 PCR 反應一樣,每個序列使用兩個引物 - 一個用於每個末端。為了拼接兩個 DNA 分子,在要連線的末端使用特殊的引物。對於每個分子,在要連線的末端處的引物被構建為使得它具有與另一個分子末端互補的 5' 懸垂。在第一步中,這些延伸片段被擴增。之後,將兩個 DNA 分子混合,並僅使用遠端引物進行 PCR。引入的重疊互補序列將充當引物,這兩個序列將被融合。這種方法相對於其他基因拼接技術具有一個優勢,即不需要限制性位點。為了獲得更高的產量,一些引物像不對稱 PCR 中一樣過量使用。
為了將突變插入 DNA 序列,設計了一個特定的引物。該引物可能包含單個替換,或者在其 5' 末端包含一個新序列。如果需要刪除,則新增一個位於刪除位置 5' 側的序列,因為引物的 3' 末端必須與模板鏈具有互補性,以便引物能夠充分退火到模板 DNA。
- cDNA 末端快速擴增(RACE)用於獲得 RNA 轉錄本的全長序列。RACE 導致產生感興趣的 RNA 序列的 cDNA 複製,該複製透過逆轉錄產生,然後透過 cDNA 複製的 PCR 擴增。RACE 可以提供從轉錄本中已知的小序列到 RNA 的 5' 端(5' RACE-PCR)或 3' 端(3' RACE-PCR)的 RNA 轉錄本的序列。這種技術有時被稱為單側 PCR 或錨定 PCR。
- 在降落 PCR中,退火溫度在後續迴圈中逐漸降低。早期迴圈中的退火溫度通常比所用引物的標準 Tm 高 3-5 °C,而在後期迴圈中,它比 Tm 低類似的量。初始較高的退火溫度導致引物結合的特異性更高,而較低的溫度允許在反應結束時更有效地擴增。
參考文獻
[edit | edit source]- Bustin, S.A., 2004. 定量 PCR 的 A-Z. 電泳 1–15。
- Higuchi, R., Dollinger, G., Walsh, P.S., Griffith, R., 1992. 特定 DNA 序列的同時擴增和檢測。生物技術。 (紐約)。10, 413–417. doi:10.1038/nbt0492-413
- Kubista, M., Andrade, J.M., Bengtsson, M., Forootan, A., Jonák, J., Lind, K., Sindelka, R., Sjöback, R., Sjögreen, B., Strömbom, L., Ståhlberg, A., Zoric, N., 2006. 即時聚合酶鏈反應。分子醫學的各個方面。
- Mullis, K.B., 1990. 聚合酶鏈反應的非凡起源。科學美國人。
- Powledge, T.M., 2004. 聚合酶鏈反應。生理學教育進展。28, 44–50。
- Saiki, R.., Scharf, S., Faloona, F., Mullis, K.B., Horn, G.T., 1985. β-珠蛋白基因組序列的酶促擴增和限制性位點分析用於診斷鐮狀細胞貧血。科學 (80-. )。239, 1350–54. doi:10.1126/science.2999980

