生命科學方法與概念/蛋白質的結構與功能
蛋白質是大型生物分子或大分子,由一個或多個氨基酸殘基的長鏈組成。蛋白質在活生物體中執行著各種各樣的功能,包括催化代謝反應、複製 DNA、響應刺激以及將分子從一個位置運輸到另一個位置。蛋白質之間的主要區別在於它們的氨基酸序列,該序列由其基因的核苷酸序列決定,並且通常會導致蛋白質摺疊成特定的三維結構,該結構決定其活性。

大多數蛋白質由從一系列高達 20 種不同的 L-α-氨基酸構建的線性聚合物組成。所有蛋白質基因氨基酸都具有共同的結構特徵,包括一個 α-碳,與其相連的是一個氨基、一個羧基和一個可變側鏈。只有脯氨酸不同於這種基本結構,因為它在 N 端胺基中含有一個不尋常的環,這迫使 CO–NH 醯胺部分處於固定構象。標準氨基酸的側鏈(在標準氨基酸列表中詳細說明)具有多種多樣的化學結構和性質;正是蛋白質中所有氨基酸側鏈的綜合效應最終決定了它的三維結構及其化學反應性。多肽鏈中的氨基酸透過肽鍵連線。一旦在蛋白質鏈中連線,單個氨基酸被稱為殘基,連線的一系列碳、氮和氧原子被稱為主鏈或蛋白質骨架。
肽鍵具有兩種共振形式,它們貢獻了一些雙鍵特徵並抑制了圍繞其軸的旋轉,因此 α-碳大致處於共面狀態。肽鍵中的另外兩個二面角決定了蛋白質骨架所假設的區域性形狀。具有遊離羧基的蛋白質末端被稱為 C 末端或羧基末端,而具有遊離氨基的末端被稱為 N 末端或氨基末端。蛋白質、多肽和肽這些詞語有點模稜兩可,並且在含義上可能重疊。蛋白質通常用於指代處於穩定構象中的完整生物分子,而肽通常保留用於指代短氨基酸寡聚體,這些寡聚體通常缺乏穩定的三維結構。然而,兩者之間的界限並不明確,通常位於 20-30 個殘基附近。多肽可以指代任何單一的線性氨基酸鏈,通常不考慮其長度,但通常意味著沒有定義的構象。

大多數蛋白質摺疊成獨特的 3 維結構。蛋白質自然摺疊成的形狀被稱為其天然構象。儘管許多蛋白質可以透過其氨基酸的化學性質簡單地進行無輔助摺疊,但另一些蛋白質則需要分子伴侶的幫助才能摺疊成其天然狀態。生物化學家通常會提到蛋白質結構的四個不同方面
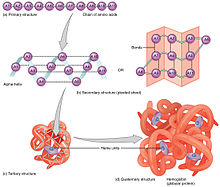
- 一級結構:氨基酸序列。蛋白質是聚醯胺。
- 二級結構:透過氫鍵穩定的規律重複的區域性結構。最常見的例子是 α-螺旋、β-摺疊和轉角。由於二級結構是區域性的,因此同一蛋白質分子中可以存在許多不同二級結構的區域。
- 三級結構*:單個蛋白質分子的整體形狀;二級結構之間的空間關係。三級結構通常由非區域性相互作用穩定,最常見的是形成疏水核心,但也透過鹽橋、氫鍵、二硫鍵,甚至翻譯後修飾。術語“三級結構”通常用作摺疊的同義詞。三級結構控制著蛋白質的基本功能。
- 四級結構:由多個蛋白質分子(多肽鏈)形成的結構,在本例中通常稱為蛋白質亞基,它們作為單個蛋白質複合物發揮作用。
蛋白質並非完全是剛性分子。除了這些結構層次之外,蛋白質在執行其功能時可能在幾個相關的結構之間轉換。在這些功能重排的背景下,這些三級或四級結構通常被稱為“構象”,它們之間的轉變被稱為構象變化。這種變化通常是由底物分子與酶的活性位點結合引起的,或者是由參與化學催化的蛋白質的物理區域引起的。在溶液中,蛋白質也透過熱振動和與其他分子的碰撞而發生結構變化。
蛋白質可以非正式地分為三個主要類別,這些類別與典型的三級結構相關:球狀蛋白、纖維狀蛋白和膜蛋白。幾乎所有球狀蛋白都是可溶的,許多是酶。纖維狀蛋白通常是結構性的,例如膠原蛋白,它是結締組織的主要成分,或角蛋白,它是頭髮和指甲的蛋白質成分。膜蛋白通常充當受體或為極性或帶電分子透過細胞膜提供通道。
