NCEA 1 級科學/物質結構

所有物質都是由稱為原子的極小粒子構成的。原子這個詞源於希臘語,意思是不可分割,即不能進一步分割的東西。原子是元素的基本組成部分。
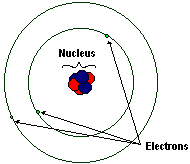
原子有三種亞原子粒子
- 質子 (+): 帶正電
- 電子 (-): 帶負電
- 中子 (0): 不帶電
它們有時可以寫成 (質子), (電子) 和 (中子)
通常,原子不帶總電荷(為中性),因為帶正電的質子數量等於帶負電的電子數量。中子的數量往往會有所不同,在氫的情況下,沒有中子。具有相同質子數量但質量不同的原子稱為同位素。

中子在原子功能中起著非常重要的作用。在原子核中,幾個質子聚集在一起。由於異性相吸,同性相斥,通常質子會相互排斥並散射原子核。然而,有一種強核力將原子核束縛在一起。這種不可思議的力量使核子(質子和中子)以比電磁力排斥它們的力量大得多的力量相互吸引,但這種力量只在極短的距離內起作用。
質子和中子數量之間存在微妙的平衡。質子透過強力相互吸引,但同時又受到它們電磁電荷的排斥,不能在原子核內大量存在而沒有中子的穩定作用,中子透過強力相互吸引,但不帶電。相反,中子將它們固有的不穩定性賦予原子核,太多的中子會使原子核不穩定。
遮蔽(或篩選)效應類似於有效核電荷。內層電子在一定程度上排斥價電子(外層電子)。內層電子層越多(週期表中每一行一個新層),遮蔽效應就越大。本質上,內層電子遮蔽價電子免受原子核的正電荷的影響。
原子序數是原子核中質子的數量。原子序數決定了原子的元素種類。元素週期表上元素的排列是根據它們的原子序數。每個元素都有一個獨特的識別符號。
如果用中子或加速器中的帶電粒子轟擊重金屬,如果質子數量增加,則原子序數也會增加。這就是創造新的稱為超鈾元素的人造元素的方法,它們是元素週期表上原子序數大於 92 的元素。
質量數是原子中質子和中子數量的總和。
| 原子質量數和元素的原子質量之間存在差異。質量數測量的是特定原子原子核中質子和中子的數量。原子質量測量的是元素所有原子的平均質量。例如,碳原子的質量數可能是 12 或 14(或其他),但碳通常的質量為 12.011 amu。 |
鎂的原子質量為 24.3051,但它的質量數為 24。
元素是一種只包含相同型別原子的物質。也就是說,具有相同質子數量的原子。
在原子核內部,有質子和中子。電子圍繞原子核執行,排列在不同的能級或電子層中。對於前 20 個元素,每個電子層的最大電子構型為
- 第 1 層:2
- 第 2 層:8
- 第 3 層:8
- 第 4 層:2(剩餘電子)
電子排列告訴我們每個電子層可以容納多少個電子。
- 示例
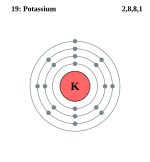
K(鉀;原子序數:19)的電子構型為 2,8,8,1。
這告訴我們第 1 層有 2 個電子,第 2 層有 8 個,第 3 層有 8 個,第 4 層有 1 個。
另一種計算前 20 個元素的電子構型的方法是檢視元素週期表。元素週期表上的行稱為週期,而列稱為族。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 H |
2 He | ||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
| 55 Cs |
56 Ba |
57 La |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 87 Fr |
88 Ra |
89 Ac |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn | ||||||
| 58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
||||
| 90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | ||||
要檢視更完整的元素週期表,請檢視 此元素週期表。 |
要計算電子排列,我們可以安全地假設對於前 20 個元素,元素所在的週期等於它具有的電子層數。我們還可以假設每個週期中元素的數量等於每個電子層中的電子數量。
- 示例
Cl(氯,原子序數:17)位於元素週期表第 7 或 17 族,第 3 週期。因此它有 3 個電子層,最外層有 7 個電子。它的電子排布式為 2,8,7。

元素所在的族(列)可以決定其反應活性。第 18 族元素的價電子層已滿,因此它們不活潑或穩定。這些元素不會形成化合物,如 O2 或 CO2。另一方面,第 1 族和第 17 族元素非常活潑,因為它們只有一個價電子,很容易失去,因此第 1 族和第 17 族元素在自然界中從未單獨存在 - 它們始終以化合物的形式存在,例如 H2 和 Cl2。第 2 族和第 16 族元素中等活潑,在自然界中也以化合物的形式存在。
| +1 | +2 | +3 | -2 | -1 |
|---|---|---|---|---|
| NH4+ | Ca 2+ | Al3+ | O2- | OH- |
| Na+ | Mg2+ | Fe3+ | S2- | Cl- |
| K+ | Cu2+ | CO32- | NO3- | |
| Ag + | Pb 2+ | SO42- | HCO3- | |
| H+ | Fe 2+ | |||
| Ba2+ | ||||
| Zn 2+ |
離子是原子或原子團,它們透過得失電子而成為帶電粒子。
元素週期表被分為兩類:金屬和非金屬。金屬位於左側,非金屬位於右側。中間的元素是金屬,但被稱為過渡金屬。金屬變成帶正電的,稱為陽離子。非金屬變成帶負電的,稱為陰離子。失去一個電子的金屬原子的質子數比電子數多,因此形成陽離子,例如 H+ 和 Al3+。而獲得電子的非金屬原子的電子數比質子數多,因此形成陰離子,例如 Cl- 和 HCO3-。
- 在化學反應中,氫原子失去其唯一的電子,形成一個包含 1 個質子和 0 個電子的離子。這個氫離子 (H+) 帶有 +1 的電荷,因為有一個質子,而沒有電子來平衡電荷。
- 氯 (2,8,7) 原子獲得一個電子,形成一個包含 17 個質子和 18 個電子的離子。這個氯離子 (Cl-) 帶有 -1 的電荷,因為有 17 個質子,而有 18 個電子。電子數量比質子數量多一個。
- 通常,鈉原子 (2,8,1) 在其外層有 1 個電子。在化學反應中,它會失去這個電子,形成 Na+ 離子 (2,8)。
- 氧 (2,6) 在化學反應中會獲得 2 個電子,以填滿其外層。它將形成 O2+ 離子。
原子希望擁有完整的價電子層,這樣它們就會變得不活潑並穩定。這可以透過在化學反應中得失電子來實現。化學反應不僅發生在科學實驗室中。第 1 族和第 17 族元素在自然界中並不存在。將第 1 族元素(如鈉)暴露在空氣中(空氣中含有 78% 氮氣、21% 氧氣、0.9% 氬氣和 0.03% 二氧化碳),特別是氧氣,會立即發生氧化反應。
| 失去電子 | 陽離子 |
|---|---|
| 獲得電子 | 陰離子 |
離子的反應活性和電荷與其在元素週期表中的位置有關。
- 第 1 族金屬在外層有 1 個電子,因此它們非常活潑,會失去這個電子形成 +1 的陽離子,例如 Li+ 和 Na +。
- 第 2 族金屬在外層有 2 個電子,因此它們中等活潑,會失去這兩個電子形成 +2 的陽離子,例如 Be2+ 和 Mg2+。
- 第 16 族非金屬在外層有 6 個電子,因此它們中等活潑,會獲得 2 個電子形成 -2 的陰離子,例如 O2-,S2-。
- 第 17 族非金屬在外層有 7 個電子。它們非常活潑,會獲得 1 個電子形成 -1 的陰離子,例如 F- ,Cl-。
- 第 18 族非金屬的外層已滿。它們不活潑,不會形成離子,例如 He,Ne,Ar。
| 元素 | 電子排布 | 電荷 |
|---|---|---|
| 氫 | H +1 | |
| 氦 | He 0 | |
| 鋰 | Li +1 | |
| 鈹 | Be +2 | |
| 氧 | O -2 | |
| 氟 | F -1 | |
| 氖 | Ne O |

當陽離子(金屬)和陰離子(非金屬)化學結合時,就會形成離子化合物。這個過程是反應物→生成物。
有兩種型別的方程式
- 文字方程式
- 化學方程式
文字方程式涉及識別反應物和生成物。化學方程式涉及使用文字和符號來寫方程式。在考試中,請確保正確閱讀問題,並寫下要求的方程式型別。
- 示例
- 文字方程式:鎂 + 氧氣→氧化鎂
- 化學方程式:Mg2+ + O2- → MgO

為了寫出離子化合物的化學式,可以使用交叉相乘規則。
步驟:
1. 在離子表中找到離子,然後去掉 + 和 – 符號。
2. 如果數字相同,則相互抵消。
3. 如果數字不同,則將它們交叉並放下。
4. 如果一個數字被放到一個化合物上,則需要插入括號。
| 化合物名稱 | 找到離子電荷 | 交叉相乘的數字 |
|---|---|---|
| 氧化鎂 | Mg2+ + O2- | MgO |
| 氫氧化鋁 | Al3+ + OH- | (Al(OH))3 [不平衡] |
| 硝酸鉀 | K+ + NO3- | KNO3 |
| 氯化鈣 | Ca2+ + Cl- | CaCl2 [不平衡] |
| 硝酸鋅 | Zn2+ + NO3- | Zn[(NO3)]2 [不平衡] |
| 硫酸鈉 | Na+ + SO42- | Na2SO4 [不平衡] |

當兩種或多種元素結合在一起時,就會形成化合物,例如 CaCl2。化學式中的下標數字告訴我們每種元素有多少個原子。
- 示例
-
- Ca(Cl)2 - 1 個 Ca,2 個 Cl
- Mg(OH)2 - 1 個 Mg,2 個 H,2 個 O
係數告訴我們有多少個化合物的分子。為了計算每個元素原子的數量,我們將係數乘以原子數。
- 示例
-
- 3Cu(SO)4 - 3 個 Cu,3 個 S,12 個 O
- 2CO2 - 2 個 C,4 個 O
- 5H2SO4 - 10 個 H,5 個 S 和 20 個 O
- 3Cu(OH)2 - 3 個 Cu,6 個 O,6 個 H




