OCR 高階普通教育證書化學/元素週期表:過渡元素

過渡元素被定義為d區元素,形成一個或多個具有未填滿d軌道的穩定離子。
如果我們看一下一些過渡元素的電子構型示例,我們可以看到它是如何工作的
鈧 (Sc) - [Ar] 3d1 4s2
鈦 (Ti) - [Ar] 3d2 4s2
記住電子首先從4s亞層移除
鈦可以形成2+、3+(和4+),它們都導致具有未填滿d軌道的離子
然而,鈧只形成3+離子,並且它們具有空的d亞層。因此,鈧不被歸類為過渡元素。鋅也是如此,因為它只形成2+離子,從4s亞層失去兩個電子並保持完整的d亞層。
因此,現在我們在第4族過渡元素的3d亞層中形成了一個電子數遞增的良好模式。然而,一如既往,此規則也存在例外情況
人們期望鉻具有如下電子結構
[Ar] 3d4 4s2
但實際上它的結構是
[Ar] 3d5 4s1
這是因為半滿亞層和完全填滿的亞層最穩定,因此它們更受青睞。銅也是如此
[Ar] 3d10 4s1
其中具有完整的d亞層比在4s亞層中具有9個電子和2個電子更受青睞
過渡元素可以形成多種氧化態的化合物。大多數元素只形成一種氧化態的化合物,因此過渡元素很少見。發生這種情況的原因與4s亞層之間以及d亞層內的能級有關;它們都非常相似,因此多個電子的移動不需要太多能量。
鐵和銅化合物的氧化態主要(必須知道的)如下
Fe +2 +3 +4 +5 +6
Cu +1 +2 +3
最常見的氧化態以粗體顯示
過渡金屬離子在水溶液中是有色的,因為它們具有部分填充的d軌道(這在過渡元素考試中會更多地發現)。因此,這表明鋅和鈧的化合物不會有顏色 - 這是真的。
需要學習的最重要的有色離子是
Fe2+ 綠色
Fe3+ 黃色
Cu2+ 藍色
透過具有部分填充的d軌道,過渡金屬可以吸收我們可見光譜中的光。這意味著反射的光(我們看到的光)將缺少吸收的光的波長。因此,吸收光的波長和顏色與我們看到的光的波長和顏色不同。

此色輪演示瞭如果化合物在可見光譜中只有一個吸收,它將呈現什麼顏色。例如,如果化合物吸收紅光,它將呈現綠色。
λ 吸收 與顏色 觀察
400nm 紫羅蘭色吸收,黃綠色觀察 (λ 560nm)
450nm 藍色吸收,黃色觀察 (λ 600nm)
490nm 藍綠色吸收,紅色觀察 (λ 620nm)
570nm 黃綠色吸收,紫羅蘭色觀察 (λ 410nm)
580nm 黃色吸收,深藍色觀察 (λ 430nm)
600nm 橙色吸收,藍色觀察 (λ 450nm)
650nm 紅色吸收,綠色觀察 (λ 520nm)
本節中有3個沉澱反應,必須學習並記住相應的觀察結果。它們都非常相似,過渡金屬離子的溶液與氫氧化鈉水溶液反應
- Cu2+(aq) + 2OH-(aq) ---> Cu(OH)2(s)
(藍色) --------> (淺藍色)
- Fe2+(aq) + 2OH-(aq) ---> Fe(OH)2(s)
(綠色) --------> (綠色)
- Fe3+(aq) + 3OH-(aq) ---> Fe(OH)3(s)
(黃色) --------> (鏽色)
這些反應產生固體“膠狀”沉澱物(稱為膠狀物,因為它們像果凍一樣)

過渡金屬有形成配合物(配位化合物)的趨勢,這是由於它們部分填充的d亞層接受來自其他離子或分子的供體電子對。
配合離子是指含有中心原子或離子且其他原子、離子或分子與之結合的離子。原子、離子或分子透過配位共價鍵與之結合,並被稱為配體
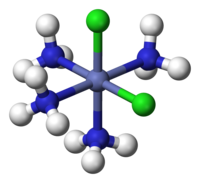
右側是六水合釩(III)配合離子的示例。中心釩3+金屬離子已與水分子配體提供的孤對電子形成了配位鍵。由於水是中性的,因此總電荷將保持為3+,但對於其他帶電配體(如Cl-和CN-),總電荷將受到影響。
中心金屬與配體之間形成的配位共價鍵(配位鍵)的數量稱為配位數。
最初,配合物的命名可能看起來很棘手,但一旦你習慣了命名化合物的系統方法,就很容易遵循這些規則
1. 確定配體的數量並使用適當的字首 - 1 一、2 二、3 三、4 四、5 五、6 六
2. 確定配體的名稱
- 如果配體是陰離子,則名稱以“o”結尾,例如氯 (Cl-)、氰 (CN-)、羥 (OH-)
- 大多數中性配體使用其常用名稱,但水為aqua、氨為ammine、一氧化碳為羰基。
3. 確定中心金屬並考慮配合物的總電荷
- 如果為中性或正電荷,則使用金屬的正常名稱,例如銅
- 如果為負電荷,則名稱以“ate”結尾,例如鐵酸鹽(鐵)、銅酸鹽(銅)、鉛酸鹽(鉛)
4. 確定中心金屬離子的氧化態,並在末尾用羅馬數字括號表示。

左側是一個總電荷為(2-)的配合物的例子,因此使用銅酸鹽而不是銅。
右側是具有兩種不同型別配體的配合物的示例,這除了必須分別執行步驟1和2兩次之外,不會影響命名過程。
以下是一些配合物的更多示例
[Co(H2O)6]2+ 六水合鈷(II)離子
[CuCl4]2- 四氯合銅(II)酸鹽離子
[FeCN6]4- 六氰合鐵(II)酸鹽離子
[CrCl2(NH3)4]+ 二氯四氨合鉻(III)離子
形狀 - 如上所示,六水合釩(III)的形狀為八面體,四氯合銅(II)酸鹽的形狀為四面體
當存在更穩定的配合物時,配體可以被其他配體取代。對於考試,必須知道3種配體取代
[Cu(H2O)6]2+(aq) + 4Cl-(aq) ---> [CuCl4]2-(aq) + 6H2O(l)
在此反應中,當逐滴加入濃鹽酸時,藍色的六水合銅(II)發生配體取代,形成黃色的四氯合銅(II)酸鹽。
[CuCl4]2-(aq) + 4NH3(aq) + 2H2O(l) ---> [Cu(NH3)4(H2O)2]2+(aq) + 4Cl-(aq)
然後,黃色四氯合銅(II)酸鹽會與濃氨水和水反應,生成深藍色的四氨二水合銅(II)。
因此,在我們提到的三個複雜離子中,四氨二水合銅(II)是最穩定的,六水合銅(II)是最不穩定的。
[Fe(H2O)6]3+(aq) + SCN-(aq) ---> [Fe(H2O)5SCN]2+(aq) + H2O(l)
這裡,黃色的六水合鐵(III)變成血紅色的五水硫氰合鐵(III)。
我們可以利用我們在配體取代反應中學到的顏色變化來確定配合物中配體與金屬的比例。這可以透過向原始配合物中加入不同體積的新配體來實現。然後,可以將一束窄光束照射到一個濾光片上,該濾光片只允許一種波長的光被溶液吸收(否則白光會被所有顏色吸收,顏色變化將毫無意義)。然後,溶液另一側的光電管檢測剩餘的光,並由儀表記錄結果。
濾光片的顏色應與新配合物將吸收的顏色(與反射的顏色相反)相同。這意味著隨著反應的進行,將吸收越來越多的光。
如果使用足夠的樣品,應該會出現一個模式,其中在達到一定體積後吸光度會達到極限。這是因為所有配體都已被取代。利用n=cv可以計算出第一次達到最大吸光度值時所用新配體和原始配合物的摩爾數。這兩個值之間的比率就是配合物中配體與金屬的比率。
氧化還原反應是指還原和氧化同時發生的反應。過渡金屬具有多種不同的氧化態,因此很容易被還原或氧化。一旦你有了兩個半反應方程式,構建氧化還原方程式就不太困難了。
例如:鐵(II)離子與酸性水溶液中的高錳酸根(VII)離子的氧化還原反應
Fe(II)氧化的半反應方程式
Fe2+(aq) ---> Fe3+(aq) + e-
酸性溶液中高錳酸鉀(VII)還原的半反應方程式
MnO4-(aq) + 8H+(aq) + 5e- ---> Mn2+(aq) + 4H2O(l)
為了構建完整的方程式,電子數必須相等,因此Fe方程式必須乘以5。
5Fe2+(aq) ---> 5Fe3+(aq) + 5e-
現在可以透過將兩個方程式的兩邊相加來構建完整的方程式。
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) + 5e- ---> 5Fe3+(aq) + 5e- + Mn2+(aq) + 4H2O(l)
去掉電子後的方程式
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) ---> 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
觀察結果:顏色從紫色變為非常淺的粉紅色(幾乎無色),並且Fe3+離子由於顏色太淡而無法看到。
利用上一節中學習的方程式,我們可以計算出(例如)藥店購買的鐵片中鐵的質量百分比。
在滴定反應中,將2.13克鐵片溶解在硫酸中,過濾並用水洗滌到一個標準容量瓶中,製成250cm3溶液。然後用0.01M高錳酸鉀(VII)溶液滴定25cm3溶液。經過3次一致的滴定後,平均滴定體積為12.0cm3。
記住,下面的方程式將確認反應在第一次出現永久粉紅色時完成。
5Fe2+(aq) + MnO4-(aq) + 8H+(aq) ---> 5Fe3+(aq) + Mn2+(aq) + 4H2O(l)
首先,必須使用n=cv計算MnO4-的摩爾數。
0.01 x 12 = 1.2x10-4 摩爾
然後,可以透過檢視方程式中的摩爾比來計算Fe2+的摩爾數。
1.2x10-4 x 5 = 6 x 10-4
這是25cm3溶液的摩爾數,為了找到所有鐵片(在250cm3溶液中)的總摩爾數,該值必須乘以10,得到6 x 10-3 摩爾。
最後,將溶液中的摩爾數乘以鐵的摩爾質量56,併除以5,得到一片鐵片的摩爾質量。
6 x 10-3 x 56 x 1/5 = 0.00672
因此:0.0672/0.425 x 100 = 15.77%
不幸的是,此值與包裝盒上的值不同,這是由於操作過程中存在誤差造成的。
1. 為什麼過渡金屬Cu和Cr不遵循通常的電子結構模式?
2. 什麼是過渡金屬?第4週期d區元素中哪些不是過渡金屬?為什麼?
3. 為什麼過渡金屬離子有顏色?
4. Fe2+(aq)離子的水溶液是什麼顏色?因此,它們最吸收哪種顏色和波長的光?
5. Fe3+(aq) + 3OH-(aq) ---> Fe(OH)3(s) 你會觀察到什麼現象?
6. 給出該配合物的名稱:[CrCl2(NH3)4]+
7. 寫出兩個涉及Cu的配體取代反應,並描述如何利用比色法確定配體與金屬的比例。
8. 將1.7克鋼溶解在稀硫酸中,然後用蒸餾水稀釋到250cm3的容量瓶中。取25cm3樣品用0.02M高錳酸鉀(VII)溶液滴定。完全反應需要26.05cm3的高錳酸鉀(VII)溶液。計算鋼樣品中鐵的百分含量。(Ar:Fe = 56)
