 > 反應簡介
> 反應簡介
化學平衡是反應正向和逆向方向之間相互關聯的比率。該比率用字母K表示,在以下等式中
K = 產物 / 反應物
反應速率是指化學反應發生的快慢,用每單位時間和每單位體積的摩爾數表示。一般反應 的速率r定義為
的速率r定義為

從上面的表示式可以看出,通常約定是將反應速率視為產物生成速率。
速率是反應物和產物濃度、溫度、壓力以及催化劑存在與否的函式。
反應速率的常見表示式是冪律

 稱為動力學常數,
稱為動力學常數, 、
、 等稱為相對於反應物 A、B 的反應級數(或A、B等的偏級數),分別。所有級數的總和是速率表示式的全域性級數。因此速率表示式
等稱為相對於反應物 A、B 的反應級數(或A、B等的偏級數),分別。所有級數的總和是速率表示式的全域性級數。因此速率表示式 是二級和一級,分別對 A 和 B。
是二級和一級,分別對 A 和 B。
對於基元反應,反應級數僅等於化學計量係數;在大多數情況下,它們必須透過實驗確定,並且在實驗條件範圍內有效。
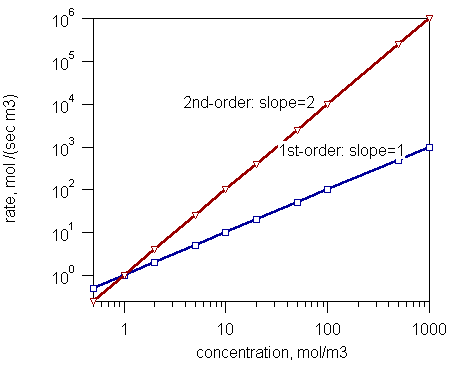
可以透過改變其中一種反應物的濃度 C,例如 A,並測量初始速率 r 來獲得關於反應級數的基本資料。繪製速率與濃度的對數-對數圖,得到一條直線,根據關係 ,該直線的斜率就是偏級數,例如 A。
,該直線的斜率就是偏級數,例如 A。

也被稱為阿累尼烏斯方程式
動力學研究最重要的應用是確定反應機理。事實上,速率表示式是反應機理的函式。
根據推測的反應機理(模型),可以推匯出速率方程,並用於分析實驗資料。如果得到的擬合在統計上不顯著,則該方案被拒絕。在複雜的體系中,幾種方案可以產生相容的速率表示式,模型辨別的問題至關重要。
反應通常有兩個或多個步驟。其中一步,通常是最後一步,是最慢的步驟,被稱為限速步驟。
有時在計算反應速率時,假設沒有特定的步驟是限速步驟是有用的。相反,反應中間體可以以相等的速率進行到產物或返回到原始反應物。這被稱為穩態近似。
一個典型的例子是滷代烷的 水解
- R-X + H2O → ROH + HX
這個反應可以透過兩種機理髮生:SN1 和 SN。前者是一分子取代:它的速率僅由 R-X 的濃度決定,與新取代基的濃度無關。後者是雙分子取代:它的速率對 R-X 和新取代基都是一級,總反應級數為 2。
化學平衡是指淨反應既不向前也不向後進行的狀態。這是一個動態平衡。正向反應的速率等於逆向反應的速率,因此兩者相互抵消,淨變化速率為零。
化學平衡由平衡常數(通常寫為Keq)決定,由質量作用定律表示

濃度C可以用任何尺度表示,例如摩爾分數、摩爾濃度、分壓。
如果溫度和壓力保持不變,無論初始濃度如何,體系都會發生變化,直到質量作用乘積等於 Keq。一般來說,體系中 在平衡時高度偏向反應物側(幾乎沒有轉化),而當
在平衡時高度偏向反應物側(幾乎沒有轉化),而當 反應會進行到底。
反應會進行到底。
從經典熱力學可以證明以下關係成立

其中 是反應的吉布斯自由能總變化(產物減去反應物)。
是反應的吉布斯自由能總變化(產物減去反應物)。
溫度的影響可以透過對上述方程求導得到

也稱為範特霍夫方程。因此,對於放熱反應( ),溫度升高會降低
),溫度升高會降低 的數量,導致較低的Keq,反之亦然,對於吸熱反應。
的數量,導致較低的Keq,反之亦然,對於吸熱反應。
![]() > 反應簡介
> 反應簡介

















