有機化學/有機化學基礎概念/原子結構
|
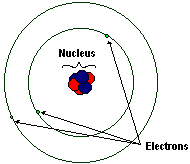
| 鋰原子的簡單模型。 不是按比例繪製的! |
原子由一個原子核和繞原子核執行的電子組成。原子核由質子和中子組成。處於自然狀態、未帶電的原子具有與質子數量相同的電子數量。
原子核由帶正電的質子和不帶電的中子組成。中子和質子具有幾乎相同的質量,它們共同構成了原子大部分的質量。
電子是帶負電的粒子。電子的質量約為質子或中子的 2000 分之一,為 0.00055 amu。電子繞原子核高速旋轉,無法確定電子在任何時間點的具體位置。圖示描繪了舊的玻爾原子模型,在該模型中,電子像行星圍繞太陽執行一樣,佔據原子核周圍的離散的“軌道”。這個模型已經過時了。目前的原子結構模型認為電子佔據原子核周圍的模糊雲,形狀各異,有的呈球形,有的呈啞鈴形,有的則更復雜。
電子在原子周圍以不同形狀和大小的雲層中執行。電子雲層一層層地疊加,形成被稱為電子層的單元,最內層電子層中的電子佔據最簡單的軌道,具有最低的能態,而最外層電子層中的電子佔據最複雜的軌道,具有最高的能態。能態越高,電子具有的能量就越高,就像山頂上的石頭比山谷底部的石頭具有更高的勢能一樣。電子存在於更高能態軌道的主要原因是任何軌道只能容納兩個電子。因此,電子會填充軌道,總是佔據可用的最低能態軌道。電子也可以被推到更高能態軌道,例如,透過光子。通常,這不是一個穩定的狀態,一段時間後,電子會透過自發發射光子而下降到較低的能態。這些概念對於理解後來的概念至關重要,例如手性化合物的旋光性,以及有機化學之外的許多有趣現象(例如,雷射的工作原理)。
每個不同的電子層都細分為一個或多個軌道,它們也具有不同的能級,儘管軌道之間的能級差小於電子層之間的能級差。
波長越長,能量越低;s 軌道具有圍繞原子核執行的電子允許的最長波長,觀察到該軌道具有最低的能量。
每個軌道都具有一個特徵形狀,該形狀顯示了電子最常存在的位置。軌道用字母命名。按照能量遞增的順序,軌道是:s、p、d 和f 軌道。
隨著人們向上穿過電子層(用主量子數n表示),更多的軌道型別成為可能。電子層用數字表示。因此,2s 軌道指的是第二電子層中的 s 軌道。
s 軌道是能量最低的軌道,呈球形。該軌道中的電子處於其基頻狀態。該軌道最多可以容納兩個電子。
下一個能量最低的軌道是p 軌道。它的形狀通常被描述為類似於啞鈴。有三個 p 軌道,分別沿三維座標 x、y 或 z 方向排列。這三個“p”軌道中的每一個最多可以容納兩個電子。
這三個不同的 p 軌道可以分別稱為 px、py 和 pz。
s 和 p 軌道對於理解大部分有機化學至關重要,因為這些軌道在有機化合物中最常見的原子型別中被佔據。
也存在 d 和 f 軌道。d 軌道存在於過渡金屬中。硫和磷具有空的 d 軌道。包含具有 d 軌道的原子的化合物確實會發揮作用,但很少是構成有機分子的部分。f 軌道存在於鑭系元素和錒系元素中。鑭系元素和錒系元素與有機化學大多無關。
當一個原子或離子接收到電子進入其軌道時,軌道和電子層會以特定的方式填充。
有三個原則支配著這一過程
- 泡利不相容原理,
- 鮑林(aufbau,逐步構建)原理,以及
- 洪特規則.
原子中的任何兩個電子不可能具有相同的四個量子數。就我們對軌道的理解而言,這意味著每個軌道只能容納兩個電子,一個“自旋向上”,另一個“自旋向下”。
這表明填充和半填充的電子層往往具有額外的穩定性。因此,在某些情況下,例如,4s 軌道將在 3d 軌道之前被填充。
此規則僅適用於具有 d 電子的元素,因此在有機化學中不太重要(儘管在有機金屬化學中很重要)。
八隅體規則指出,原子傾向於在其價層中有八個電子,因此它們傾向於結合以使每個原子在其價層中有八個電子,類似於惰性氣體的電子構型。簡單來說,當組成原子的外層電子殼層為空、滿或在外層電子殼層中有八個電子時,分子更穩定。
該規則的主要例外是氦,當它在其價層中有兩個電子時,能量最低。
其他值得注意的例外是鋁和硼,它們可以很好地使用六個價電子;並且週期表上第三族之後的某些原子可以有超過八個電子,例如硫。此外,一些惰性氣體在擴充套件其價層時可以形成化合物。
雜化是指兩個或多個共價鍵合原子軌道的組合。根據給定原子有多少個自由電子以及它形成多少個鍵,s 軌道和 p 軌道的電子將以某種方式組合形成鍵。
給定路易斯結構,很容易確定原子的雜化。首先,計算自由電子對的數量和σ鍵(單鍵)的數量。不要計算雙鍵,因為它們不會影響原子的雜化。一旦確定了這兩個的總和,雜化模式如下所示
Sigma Bonds + Electron Pairs Hybridization
2 sp
3 sp2
4 sp3
這裡的模式與電子軌道的模式相同,可以作為記憶指南。

