有機化學/烷烴
烷烴是最簡單的有機分子,僅由單鍵連線的碳和氫原子組成。烷烴被用作命名大多數有機化合物的基礎(它們的 **命名法**)。烷烴的通式為 CnH2n+2。儘管它們的反應性通常不太有趣,但它們為理解成鍵、構象和其他可以推廣到更“有用”的分子中的重要概念提供了良好的基礎。

烷烴的例子
烷烴是最簡單的,也是反應活性最低的 烴 類,只含有碳和氫。它們在商業上非常重要,是汽油和潤滑油的主要成分,在有機化學中得到廣泛應用;雖然純烷烴(如己烷)的作用主要侷限於溶劑。
烷烴的顯著特徵是它沒有 不飽和,這使其有別於其他僅含有碳和氫的化合物。也就是說,它不包含雙鍵或三鍵,它們在有機化學中具有高度反應性。
儘管烷烴並非完全沒有反應活性,但它們在大多數實驗室條件下缺乏反應性,使其成為有機化學中相對不有趣但非常重要的組成部分。正如您將在後面學到的,碳-碳鍵和碳-氫鍵中包含的能量相當高,它們的快速氧化會產生大量的熱,通常以火的形式出現。
正如所說,它很重要,但在化學中並不是一個非常重要的組成部分。
有機化合物按定義含有碳和氫,通常還含有其他元素(如氮和氧)。(CO2不是有機化合物,因為它沒有氫)。
烴是有機化合物,只含有碳和氫。
烷烴是由碳-碳單鍵組成的烴或有機化合物。因此它們是飽和的(與雙鍵和三鍵相反)。最簡單的烷烴是 **甲烷。**
甲烷(CH4,一個碳原子與四個氫原子鍵合)是最簡單的有機分子。它是 標準溫度和壓力 (STP) 下的氣體。

|
| 甲烷 |
這是一個扁平的、二維的甲烷表示,您將經常看到它。甲烷的真實三維形式在鍵合的氫之間沒有 90 度角。鍵指向四面體的四個角,形成 cos-1(-1/3) ≈ 109.5 度鍵角。

兩個碳原子透過單鍵彼此連線,並帶有六個氫原子,被稱為乙烷。
乙烷是第二簡單的烴分子。可以認為它是兩個甲烷分子連線在一起,但少了兩個氫原子。請注意,如果我們只是簡單地在兩個甲烷分子的碳中心之間建立一個新鍵,這將違反參與原子的八隅體規則。
有幾種常用的方法來繪製有機分子。它們經常互換使用,儘管有些方法更適合一種情況或另一種情況。熟悉常用方法很重要,因為這些是“語言”,有機化學家可以用來相互討論結構。
在寫出烷烴結構時,您可以根據需要使用不同級別的簡寫。例如,戊烷可以寫出來。它的化學式是 C5H12。
或 CH3–CH2–CH2–CH2–CH3,
或 CH3(CH2)3CH3,
雖然非環狀烷烴被稱為直鏈烷烴,但從技術上講它們是由連線的鏈組成的。這反映線上繪製方法中。線上的每個端點和彎曲都代表一個碳原子,每條短線代表一個單鍵的碳-碳鍵。假設每個碳都包圍著最大數量的氫原子,除非另有說明。
| 丙烷、丁烷、戊烷 |
沒有明確顯示所有碳原子的結構通常被稱為“骨架”結構,因為它們代表分子的骨架或主鏈。在有機化學中,碳的使用非常頻繁,因此化學家知道在沒有特別標記的每條線的端點處都有一個碳原子。
構象異構體,也稱為構象異構體或旋轉異構體或旋轉異構體,是同一個分子的排列,透過圍繞一個或多個單鍵在空間中的旋轉而變得暫時不同。
其他型別的異構體只能透過斷裂鍵從一種形式轉換為另一種形式,但構象異構體可以透過簡單地旋轉鍵來生成。
紐曼投影是一種用於表示分子不同部分在空間中相對位置的圖示方法。請記住,單鍵可以在空間中旋轉,除非受到阻礙。紐曼投影代表旋轉分子部分的不同位置。
| 構象異構體易於相互轉化,通常每秒發生數千次,因為分子的一部分會旋轉。 | 
|
| 在下圖中,甲基位於分子的前後端,一個圓圈代表所有位於其之間的部分。 |
 |
 |
|
|
(前端與後端重疊,也不穩定) |
構象和能量
[edit | edit source]不同的構象具有不同的勢能。交叉式構象的勢能低於重疊式構象,因此更穩定。在乙烷中,旋轉能壘約為 25 kJ/mol,表明每對重疊的氫原子會使能量升高約 8 kJ/mol。這個數字也適用於其他具有氫原子彼此距離相似的有機化合物。在極低溫度下,所有構象都會恢復到更穩定的(由於原子在平均位置振動最小)低能交叉式構象。
空間效應
[edit | edit source]空間效應與尺寸有關。兩個體積大的物體相互碰撞,侵入彼此的空間。如果我們用甲基或其他基團取代上述紐曼投影中的一個或多個氫原子,勢能會上升,特別是對於重疊式構象。
讓我們看一下丁烷在繞其軸逆時針旋轉時的紐曼投影。
 |
 |
 |
 | |||
當較大的基團重疊時,它們之間的排斥作用比氫原子之間的排斥作用更強,勢能會上升。
熵
[edit | edit source]熵,表示為ΔS,是一個數學概念,代表無序或機率。自然系統想要找到可能的最低能量或組織狀態,這轉化為最高的熵。
關於勢能的說明:如果你對這個概念生疏,請記住將一塊大石頭推到山頂的類比。在山頂,它具有最大勢能。當你推動它並讓它滾下山坡時,它所儲存的勢能會轉化為動能,可用於產生熱量或粉碎東西。
請注意,從統計學上講,乙烷分子處於鄰位構象的機會是處於反式構象的兩倍。然而,由於鄰位構象使甲基彼此靠近,這會產生高能的空間相互作用,因此在沒有能量輸入的情況下不會發生這種情況。因此,所示的丁烷分子幾乎不會處於這種不利構象。
烷烴的製備
[edit | edit source]武茲反應
[edit | edit source]武茲反應是在諸如無水乙醚之類的溶劑中使用鈉金屬偶聯滷代烷烴。
2R-X + 2Na → R-R + 2Na+X−
機理
[edit | edit source]該反應包括涉及自由基物種 R• 的鹵素金屬交換(與格氏試劑的形成方式類似,然後在親核取代反應中形成碳碳鍵)。
金屬中的一個電子轉移到鹵素,生成鹵化金屬和烷基自由基。
- R-X + M → R• + M+X−
然後烷基自由基從另一個金屬原子中接受一個電子,形成烷基陰離子,金屬變成陽離子。這種中間體在幾個案例中已被分離出來。
- R• + M → R−M+
然後烷基陰離子的親核碳在 SN2 反應中取代鹵素,形成新的碳碳共價鍵。
- R−M+ + R-X → R-R + M+X−
- 科裡-豪斯反應
- [也稱為“滷代烷烴與有機金屬化合物的偶聯”]。
- 它是比武茲反應更好的方法。滷代烷烴和二烷基銅鋰反應生成高階烴。
- R'-X + R2CuLi---->R-R' + R-Cu + LiX
- (R 和 R' 可以相同或不同)
- 它
克萊門森還原
[edit | edit source]克萊門森還原是使用鋅汞齊和鹽酸將酮(或醛)還原為烷烴的反應。
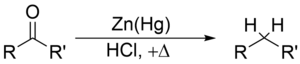
克萊門森還原在還原芳基烷基酮方面特別有效。對於脂肪族或環狀酮,鋅金屬還原更有效。
底物必須在克萊門森還原的強酸性條件下穩定。對酸敏感的底物應在沃爾夫-基希納還原中反應,該反應利用強鹼性條件;另一種更溫和的方法是莫辛戈還原。由於克萊門森還原,參與羰基的碳原子從 sp2 雜化轉變為 sp3 雜化。氧原子以一分子水的形式損失。
沃爾夫-基希納還原
[edit | edit source]
沃爾夫-基希納還原是一種化學反應,可以將酮(或醛)完全還原為烷烴。羰基化合物與肼縮合形成腙,然後用鹼處理,誘導碳還原,同時肼氧化為氮氣,生成相應的烷烴。
機理
[edit | edit source]
該機理首先涉及腙的形成,其機理可能類似於亞胺的形成。連續的去質子化最終導致氮氣的釋放。氮氣的釋放可以用作該反應的熱力學驅動力。該反應也被用於區分醛和酮。
莫辛戈還原
[edit | edit source]首先透過酮與適當的硫醇反應生成硫縮酮。然後使用雷尼鎳將產物氫解為烷烴。

烷烴的性質
[edit | edit source]與其他化學物質相比,烷烴的反應性很低。這是因為烷烴中的主鏈碳原子透過形成四個共價鍵(根據八隅體規則允許的最大鍵數;這就是為什麼碳的價數是 4)獲得了它們的八個電子。烷烴中碳形成的這四個鍵是 σ 鍵,由於碳的原子軌道與相鄰原子的原子軌道的重疊更大,因此比其他型別的鍵更穩定。為了使烷烴發生反應,需要輸入額外的能量;可以透過熱量或輻射來實現。
汽油是烷烴的混合物,與許多化學物質不同,它可以長期儲存和運輸而不會出現問題。只有在點燃時,它才具有足夠的能量來繼續反應。這種特性使得烷烴很難轉化為其他型別的有機分子。(只有幾種方法可以做到這一點)。烷烴的密度也低於水,正如人們觀察到的那樣,油(一種烷烴)漂浮在水上。
烷烴是非極性溶劑。由於只有 C 和 H 原子存在,烷烴是非極性的。烷烴在水中不溶,但在其他非極性溶劑中自由混溶。由弱偶極-偶極鍵組成的烷烴無法破壞水分子之間的強氫鍵,因此不溶於水。烯烴也表現出相同的性質。因為烷烴只含有碳和氫,所以燃燒會產生只含有碳、氫和/或氧的化合物。與其他烴類一樣,在大多數情況下燃燒主要產生二氧化碳和水。但是,烷烴需要更多的熱量才能燃燒,並且在燃燒時釋放的熱量不如其他型別的烴類多。因此,在與其他烴類在相同溫度下燃燒時,烷烴的燃燒會產生更高濃度的含氧有機化合物,如醛和酮。
烷烴的通式為 CNH2N+2;最簡單的烷烴是甲烷,CH4。下一個最簡單的烷烴是乙烷,C2H6;該系列可以無限延伸。烷烴中每個碳原子都具有 sp³ 雜化。
烷烴也稱為石蠟,或統稱為石蠟系。這些術語也用於碳原子形成單一、不分支鏈的烷烴。分支鏈烷烴稱為異石蠟。
甲烷到丁烷在標準溫度和壓力 (STP) 下是易燃氣體。戊烷是一種極易燃的液體,沸點為 36 °C,沸點和熔點從那裡開始穩定升高;十八烷是第一個在室溫下為固體的烷烴。更長的烷烴是蠟狀固體;蠟燭蠟通常含有 C20 到 C25 的鏈。隨著鏈長的增加,我們最終會得到聚乙烯,它由無限長的碳鏈組成,通常是硬的白色固體。
烷烴與離子或其他極性物質的反應非常差。所有烷烴的 pKa 值均高於 50,因此它們實際上對酸和鹼呈惰性。這種惰性是石蠟(拉丁語 para + affinis,意思是“缺乏親和力”)一詞的來源。在原油中,烷烴分子在數百萬年中保持化學不變。
然而,烷烴的氧化還原反應,特別是與氧氣和鹵素的反應,是可能的,因為碳原子處於強還原狀態;以甲烷為例,碳的最低可能氧化態(-4)被達到。與氧氣的反應導致燃燒,沒有任何煙霧;與鹵素反應,發生取代。此外,烷烴已被證明可以與某些過渡金屬配合物相互作用並與之結合。
自由基,即具有不成對電子的分子,在大多數烷烴反應中起著重要作用,例如裂解和重整,其中長鏈烷烴被轉化為短鏈烷烴,直鏈烷烴被轉化為支鏈異構體。
在高度支化的烷烴和環烷烴中,鍵角可能與最佳值 (109.5°) 有很大差異,以允許不同的基團有足夠的空間。這會導致分子中產生張力,稱為空間位阻,並且可以顯著提高反應性。烯烴也更喜歡這種結構。
在我們瞭解有機化學中的反應之前,我們必須首先了解一些關於化合物命名的基本知識。國際純粹與應用化學聯合會 (IUPAC) 命名法 是大多數有機化學家都同意的一個系統,它提供了一些指導方針,使他們能夠從彼此的工作中學習。換句話說,命名法為有機化學提供了語言基礎。
所有烷烴的名稱都以-烷結尾。無論是碳原子首尾相連形成環(稱為環狀烷烴或環烷烴),還是它們包含側鏈和分支,每個碳氫鏈的名稱,只要不含任何雙鍵或官能團,都將在後綴-烷結尾。
具有不分支碳鏈的烷烴,只需根據鏈中碳原子的數量來命名。該系列的前四個成員(按碳原子數排序)的名稱如下:
- CH4 = 甲烷 = 一個氫飽和的碳
- C2H6 = 乙烷 = 兩個氫飽和的碳
- C3H8 = 丙烷 = 三個氫飽和的碳
- C4H10 = 丁烷 = 四個氫飽和的碳
具有五個或更多個碳原子的烷烴,透過在適當的數字乘數後新增字尾-烷來命名,但基本數字詞中的-a被刪除。因此,C5H12 稱為戊烷,C6H14 稱為己烷,C7H16 稱為庚烷,等等。
直鏈烷烴有時用字首n-(代表正)來表示,以區別於具有相同碳原子數的支鏈烷烴。雖然這不是嚴格必要的,但在直鏈和支鏈異構體之間存在重要性質差異的情況下,這種用法仍然很常見:例如,正己烷是一種神經毒素,而它的支鏈異構體則不是。
該公式描述了烷烴中氫原子數與碳原子數之間的關係
- H = 2C + 2
其中“C”和“H”用於表示一個分子中存在的碳原子數和氫原子數。如果 C = 2,則 H = 6。
許多教科書將此公式寫成以下形式:
- CnH2n+2
其中“Cn”和“H2n+2”表示一個分子中存在的碳原子數和氫原子數。如果 Cn = 3,則 H2n+2 = 2(3) + 2 = 8。(對於此公式,請檢視“n”以獲得數字,“C”和“H”字母本身不會改變。)
可以製造越來越長的烴鏈,並根據最長鏈中碳原子的數量進行系統命名。
- 甲烷 (1 個碳原子)
- 乙烷 (2 個碳原子)
- 丙烷 (3 個碳原子)
- 丁烷 (4 個碳原子)
- 戊烷 (5 個碳原子)
- 己烷 (6 個碳原子)
- 庚烷 (7 個碳原子)
- 辛烷 (8 個碳原子)
- 壬烷 (9 個碳原子)
- 癸烷 (10 個碳原子)
- 十一烷 (11 個碳原子)
- 十二烷 (12 個碳原子)
前三個字首是德國化學家奧古斯特·威廉·霍夫曼的貢獻,他還在 1866 年建議使用 quartane 來表示 4 個碳原子。然而,but- 字首自 19 世紀 20 年代起就已經在使用,而 quartane 這個名字從未流行起來。他還建議使用母音 a、e、i(或 y)、o 和 u 作為結尾,或者 -ane、-ene、-ine 或 -yne、-one 和 -une。同樣,只有前三個被用於單鍵、雙鍵和三鍵,而 -one 已經用於酮。Pent、hex、hept、oct 和 dec 都來自古希臘數字(penta、hex、hepta、octa、deka),奇怪的是,non 來自拉丁語 novem。對於更長的烷烴,我們使用特殊的 IUPAC 乘數詞綴。例如,十五烷表示具有 5+10 = 15 個碳原子的烷烴。對於長度為 30、40、50 等等的鏈,基本字首被新增到 -contane。例如,C57H116 被命名為 heptapentacontane。當鏈包含 20-29 個原子時,我們有一個例外。C20H42 被稱為二十烷,然後我們有,例如,二十四烷(必要時省略“i”)。對於長度為 100,我們有“hecta”,但對於 200、300 ... 900,我們有“dicta”、“tricta”,等等,必要時省略“icta”上的“i”;對於 1000,我們有“kilia”,但對於 2000 等等,我們有“dilia”、“trilia”,等等,必要時省略“ilia”上的“i”。
然後我們將所有字首按反序排列在一起。具有 9236 個碳原子的烷烴則被稱為 hexatridinoniliane。
具有三個以上碳原子的烷烴中的原子可以以多種方式排列,從而導致大量潛在的不同構型(異構體)。所謂的“正”烷烴具有線性、不分支的構型,但任何給定烷烴的n-異構體只是該數量的碳原子和氫原子在某種鏈狀排列中可能存在的數百甚至可能數百萬種構型中的一種。
異構體定義為具有相同分子式的化合物,表現出不同分子式排列的化合物被稱為異構體。
例如,丁烷的分子式為 C4H10。
異構體的數量隨著給定烷烴分子中碳原子數的增加而迅速增加;對於僅含 12 個碳原子的烷烴,該分子可能存在超過 355 種可能的結構!
碳原子數 烷烴的異構體數 1 1 2 1 3 1 4 2 5 3 6 5 7 9 8 18 9 35 10 75 11 159 12 355
碳能夠向所有四個方向形成鍵,並很容易與其他碳原子形成牢固的鍵。當一個碳原子與兩個以上的其他碳原子形成鍵時,它就會形成一個分支。
 |
 |
上面你可以看到一個碳原子與三個和四個其他碳原子形成鍵。
- 注意:當一個甲烷基與另一個碳原子而不是第四個氫原子形成鍵時,它被稱為甲基基團。–CH3
常見的系統對碳鏈的命名規則與它們與分支的關係有關。
- 正烷烴是線性的
- 異烷烴有一個分支 R2CH—
- 新烷烴有兩個分支 R3C—
注意:“R”在有機化學中是一個佔位符,可以代表任何碳基團。
碳最重要的特性之一是它能夠在每個原子中形成多個相對牢固的鍵。正是由於這個原因,許多科學家認為碳是唯一能夠成為支援生命所需的許多複雜分子的基礎元素。
一個碳原子不僅可以連線形成單鏈所需的一個或兩個碳,還可以連線多達四個其他碳。正是這種多重鍵合能力使得異構現象成為可能。
異構體是兩種具有相同分子式但物理排列不同的分子。結構異構體的原子排列順序不同。丁烷的結構異構體的主鏈在末端分叉,並且其主鏈比丁烷短一個碳。
 |
 |
有機分子的命名法或命名方法有很多,但主要只有兩種。
- 傳統的非系統命名法。許多這樣的名稱仍然存在,特別是對於更簡單或更常見的分子。
- 系統的IUPAC(eye-YOU-pack(國際純粹與應用化學聯合會))命名法。
IUPAC 系統對於複雜的有機化合物是必要的。它為命名大型化合物提供了一系列統一規則,透過概念上將化合物細分為更小、更易於管理的命名單元。
許多傳統的(非 IUPAC)名稱在工業中仍然被普遍使用,尤其是在更簡單和更常見的化學品中,因為傳統名稱早已根深蒂固。
- 找到最長的碳鏈,確定最靠近 取代基 的末端,並從該末端依次編號碳原子。這將是主鏈。
- 將所有其他碳基團視為取代基。
- 按字母順序排列取代基。
- 根據取代基連線的碳原子對其進行編號。如果編號可以以多種方式進行,請使用導致編號最小的編號系統。
取代基的命名類似於母體,將-ane結尾替換為-yl。
上面的分子編號如下
2,3,7-三甲基辛烷
不是 2,6,7-三甲基辛烷。記住,編號是為了給取代基提供最小的編號。
3-乙基-3-甲基戊烷
乙基在按字母順序排列時位於甲基之前。
3-(1-甲基乙基)-2,4-二甲基戊烷
圖中主鏈編號為 1-5。支鏈取代基的主體,一個乙基,編號為 1' 和 2'。乙基取代基上的甲基取代基在圖中沒有編號。
要命名該化合物,將整個支鏈取代基名稱放在括號中,然後像簡單取代基一樣進行編號和按字母順序排列。
一些來自常用系統的詞綴在 IUPAC 系統中被接受。
為了按字母順序排列,iso-和neo-被認為是名稱的一部分,並按字母順序排列。Sec-和tert-不被視為名稱中可按字母順序排列的部分。
(在下圖中,R-表示任何碳結構。)
異-可以用於在倒數第二個碳處分叉並以兩個甲基結尾的取代基。異丁基共有四個碳
仲-可以用於在第一個碳處分叉的取代基。
新-指的是取代基,其鏈的倒數第二個碳是三取代的(有三個甲基連線到它)。新戊基共有五個碳。
叔-是叔的簡稱,指的是第一個碳連線有三個其他碳基團的取代基。







