地球/3e. 元素週期表和電子軌道
如果沒有原子內部的電子,原子就不會相互結合或相互作用形成分子、晶體和其他複雜材料。電子在化學中極其重要,因為它們決定了原子如何相互作用。難怪大多數科學教室裡都展示了元素週期表,而不是更繁瑣的核素圖表,因為元素週期表按質子和電子的數量而不是質子和中子的數量來組織元素。


如前所述,電子是任性的亞原子粒子,它們可以提高其能級,甚至完全離開原子形成等離子體,也稱為電流。電流是自由電子的流動,這些電子可以以接近光速的速度穿過導電材料,例如金屬線。在下一節中,我們將詳細研究電子是如何在原子中的軌道中排列的。但是,請記住,受到高能級電磁輻射轟擊的高激發態原子,例如溫度升高和高壓,電子可以離開原子,而在極低的溫度下,接近絕對零度開爾文,電子將非常靠近原子核,形成玻色-愛因斯坦凝聚態。當我們想到溫度(熱量)時,實際上指的是物質(無論是氣體、液體還是固體)原子內部電子的能級。物質越熱,電子具有的振動能量就越大。
電子以非常快的速度繞原子核旋轉,沒有離散的軌道路徑,而是作為一種稱為電子殼層的電磁場。海森堡原理描述了測量這些電子殼層的不可能性,因為每當科學家使用光子來測量電子的位置時,它都會移動並改變其能級。電子在原子核周圍軌道中的確切位置總是存在不確定性。因此,電子殼層是電子在任何時刻都可能存在的機率場。
帶負電荷的電子被吸引到帶正電荷的質子,因此在大多數原子中觀察到相同數量的電子和質子。

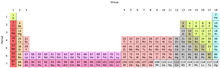
19世紀中期工作的早期化學家只知道少數幾種元素,這些元素被分為三大類,根據它們相互反應的方式,即鹵素、鹼金屬和鹼土金屬。到1860年,許多這些元素的原子質量都被報道出來,這使得俄羅斯科學家德米特里·門捷列夫能夠根據它們的反應特性和原子質量來排列元素。

在編寫化學教科書時,門捷列夫偶然發現了一個想法,即每一組元素都具有遞增的原子質量,因此,一組鹵素將具有不同質量的元素。雖然不知道背後的原因,但門捷列夫根據元素的原子序數(質子數)對元素進行了排列,原子序數與原子質量和電子軌道數有關,而電子軌道數與元素與其他元素結合的反應性有關。雖然這些早期的元素週期表與我們現代的元素週期表看起來毫不相干,但它們激發了化學家們去發現更多元素。下一個重大突破是惰性氣體的發現和廣泛接受,其中包括氦和氬,它們是已知反應性最小的元素。
那麼,原子的反應性如何與其原子質量相關呢?電子被吸引到原子核,數量與質子數相等,是原子質量的一半。原子質量越大,質子越多,被吸引的電子就越多。然而,電子更喜歡按組填充電子殼層,因此,不完整的電子殼層將吸引其他電子,儘管電子數量與質子數相等。如果一個原子具有一套完整的電子,與質子數匹配,那麼它將不具有反應性,而需要少一個或多一個電子來填充一個軌道組的元素是反應性最強的元素型別。
| 族 → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ 週期 | ||||||||||||||||||||
| 1 | 1 H |
2 He | ||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr | ||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe | ||
| 6 | 55 Cs |
56 Ba |
57 La |
58 Ce |
* |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
| 7 | 87 Fr |
88 Ra |
89 Ac |
90 Th |
** |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Uut |
114 Uuq |
115 Uup |
116 Uuh |
117 Uus |
118 Uuo |
| * 鑭系元素 | 59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||
| ** 錒系元素 | 91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||
| 鹼金屬2 | 鹼土金屬2 | 鑭系元素12 | 錒系元素12 | 過渡金屬2 |
| 貧金屬 | 類金屬 | 非金屬 | 鹵素3 | 惰性氣體3 |
1錒系元素和鑭系元素統稱為“稀土金屬”。2鹼金屬、鹼土金屬、過渡金屬、錒系元素和鑭系元素統稱為“金屬”。3鹵素和惰性氣體也是非金屬。
在標準溫度和壓力下的狀態
- 原子序數為藍色的元素在STP下未知
- 原子序數為紅色的元素在標準溫度和壓力 (STP) 下為氣體
- 原子序數為綠色的元素在STP下為液體
- 原子序數在 黑色 中的元素在 STP 下為固體。
自然存在
未知性質
- 具有青色背景的元素具有未知的化學性質。

元素週期表的第一行包含兩個元素,氫和氦。
氫有 1 個質子,因此吸引 1 個電子。然而,軌道殼層更傾向於包含 2 個電子,因此氫與其他元素非常容易發生反應,例如在氧氣存在下,它會爆炸!氫更傾向於在電子軌道殼層中具有 2 個電子,但由於它只有一個質子,所以它無法做到,因此它會盡可能從附近的原子“偷”或“借”其他電子。
氦有 2 個質子,因此吸引 2 個電子。由於 2 個電子是第一個軌道殼層的首選數量,氦不會與其他元素髮生反應,事實上,很難(幾乎不可能)將氦與其他元素結合。氦是一種惰性氣體,這意味著它在軌道殼層中包含了完整的電子集。
元素週期表的列根據每個軌道殼層中的電子數量排列,原子序數(質子數)由行表示。
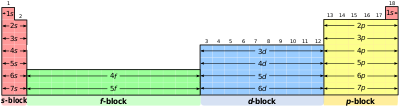

元素週期表的第一行是當前兩個電子填充第一個軌道殼層時,稱為 1s 軌道殼層。第二行是當接下來的兩個電子填充 2s 軌道殼層時,另外 6 個電子填充 2p 軌道殼層。第三行是當接下來的 6 個軌道填充 3p 軌道殼層時,另外 2 個電子填充 4s 軌道殼層。第四行是當接下來的 10 個軌道填充 3d 軌道殼層時,另外 6 個填充 4p 軌道,另外 2 個填充 5s 軌道。
一個 價電子 是一個外殼電子,它與一個原子有關,但沒有完全填充外層軌道殼層,因此參與原子之間的鍵合。價層是原子的最外層殼層。價層完整的元素(惰性氣體)的化學反應性最低,而價層只有一個電子的元素(鹼金屬)或僅僅缺少一個電子才能完成殼層的元素(鹵素)的化學反應性最高。氫在其價層中只有一個電子,但也僅僅缺少一個電子才能完成殼層,具有獨特的和非常容易發生反應的性質。
元素的價電子數量可以透過元素週期表中的族(豎列)來確定。除了第 3-12 族(過渡金屬和稀土元素)以外,列透過元素的中性原子的價電子數量來標識。每個 s 子層最多可以容納 2 個電子,而 p 子層可以容納 6 個,d 子層可以容納 10 個電子,然後是 f 可以容納 14 個,最後是 g 可以容納 18 個電子。觀察元素週期表的前幾行,看看它如何運作以確定特定元素中每個原子的價電子數量(<)。
| 元素 | 電子數 | 1s | 2s | 2p | 2p | 2p | 價電子數 電子 |
|---|---|---|---|---|---|---|---|
| 氫 | 1 | < | 1 | ||||
| 氦 | 2 | <> | 0 | ||||
| 鋰 | 3 | <> | < | 1 | |||
| 鈹 | 4 | <> | < | < | 2 | ||
| 硼 | 5 | <> | < | < | < | 3 | |
| 碳 | 6 | <> | < | < | < | < | 4 |
| 氮 | 7 | <> | <> | < | < | < | 3 |
| 氧 | 8 | <> | <> | <> | < | < | 2 |
| 氟 | 9 | <> | <> | <> | <> | < | 1 |
| 氖 | 10 | <> | <> | <> | <> | <> | 0 |
注意,氦和氖具有 0 個價電子,這意味著它們沒有反應性,也不會與其他原子形成鍵。然而,鋰具有 1 個價電子,如果去除這 1 個電子,它將具有 0 個價電子,這使得鋰具有很高的反應性。還要注意,氟只需要 1 個價電子就可以完成其 2s 和 2p 軌道的集合,這也使得氟具有很高的反應性。碳在這組元素中具有最高的價電子數量,它將吸引或放棄 4 個電子來完成 2s 和 2p 軌道的集合。
理解價電子數量對於理解原子如何相互形成鍵以形成分子至關重要。例如,元素週期表中包含鋰的第一列元素都具有 1 個價電子,並且很可能與需要 1 個價電子來填充軌道殼層的元素形成鍵,例如元素週期表中氟列的元素。
元素週期表中的一些列有特定的歷史名稱。包含鋰的第一列元素被稱為 鹼金屬(氫是一種氣體,它很獨特,通常不被認為是鹼金屬的一部分),包含氦的最後一列元素都有 0 個價電子,它們被稱為 惰性氣體。氟列下的元素需要 1 個價電子來填充軌道殼層,被稱為 鹵素,而鈹列下的元素被稱為 鹼土金屬,它們具有 2 個價電子。大多數其他列沒有特定的名稱(有時被稱為 過渡金屬),但可以用來確定價電子數量,例如,碳 和列出的元素將具有 4 個價電子,而 氧 下列出的所有元素將具有 2 個價電子。注意,在元素 鋇 之後,插入了兩行元素,它們是 鑭系元素 和 錒系元素,它們包含 4s、4p、4d、4f 軌道的電子,可能總共 32 個電子,在一個漂亮的表格中太長了,因此這些元素通常顯示在元素週期表的底部。
典型的大學化學課程將更詳細地介紹電子軌道殼層,但瞭解電子軌道的工作原理很重要,因為電子的構型決定了每個元素的原子如何在分子中形成鍵。在下一節中,我們將研究原子如何聚在一起形成鍵,以及如何以不同的方式組合在一起形成你在地球上觀察到的物質。
| 上一頁 | 當前頁 | 下一頁 |
|---|---|---|
