生物化學原理/細胞及其生物化學
| 此頁面已匯入,需要進行去維基化. 書籍應該謹慎使用維基連結,並且只用於引用理解內容至關重要的技術或深奧術語。大多數如果不是全部的維基連結應該被簡單地刪除。請在頁面去維基化後刪除{{dewikify}}。 |
生物化學的歷史大約跨越了 400 年。雖然“生物化學”一詞似乎最早出現在 1882 年,但普遍認為“生物化學”一詞是由德國化學家卡爾·諾伊貝格在 1903 年首次提出的。
生物化學是研究生物體中化學過程的學科。生物化學支配著所有生物體和生命過程。透過控制透過生化訊號傳遞的資訊流和透過代謝的化學能量流,生化過程產生了生命不可思議的複雜性。生物化學的很大一部分涉及細胞成分(如蛋白質、碳水化合物、脂類、核酸和其他生物分子)的結構和功能,儘管越來越多的過程而不是單個分子成為主要關注點。在過去 40 年中,生物化學在解釋生命過程方面取得了巨大成功,現在從植物學到醫學的幾乎所有生命科學領域都從事生物化學研究。今天,純生物化學的主要關注點是瞭解生物分子如何產生髮生在活細胞內的過程,這反過來與對整個生物體的研究和理解密切相關。在數量龐大的不同生物分子中,許多是複雜的、大型分子(稱為聚合物),它們由相似的重複亞基(稱為單體)組成。每類聚合生物分子都有不同的亞基型別集。例如,蛋白質是一種聚合物,其亞基是從 20 種或更多種氨基酸集合中選擇的。生物化學研究重要生物分子(如蛋白質)的化學性質,特別是酶催化反應的化學性質。細胞代謝和內分泌系統的生物化學已被廣泛描述。生物化學的其他領域包括遺傳密碼(DNA、RNA)、蛋白質合成、細胞膜轉運和訊號轉導。[1]
酶
[edit | edit source]
早在 18 世紀後期和 19 世紀初期,胃分泌物對肉類的消化[2]和植物提取物和唾液將澱粉轉化為糖類是已知的。但是,發生這種現象的機制尚未確定。[3]
在 19 世紀,在研究發酵糖類產生酒精時,路易斯·巴斯德得出的結論是,這種發酵是由酵母細胞中的一種稱為“發酵劑”的生命力催化的,人們認為這些發酵劑只在生物體中起作用。他寫道,“酒精發酵是與酵母細胞的生命和組織相關聯的行為,而不是與細胞的死亡或腐爛相關聯的行為”。[4]
1878 年,德國生理學家威廉·庫恩 (1837–1900) 創造了酶一詞,該詞源於希臘語“在酵母中”,用來描述這個過程。酶一詞後來用於指代無生命物質,例如胃蛋白酶,而發酵劑一詞用於指代由生物體產生的化學活性。
1897 年,愛德華·布赫納 開始研究酵母提取物在沒有活酵母細胞的情況下發酵糖的能力。在一系列在柏林洪堡大學進行的實驗中,他發現即使混合物中沒有活酵母細胞,糖類也會發酵。[5] 他將導致蔗糖發酵的酶命名為“齊酶”。[6] 1907 年,他獲得了諾貝爾化學獎,“表彰他在生化研究和無細胞發酵發現方面的貢獻”。繼布赫納的例子之後,酶通常根據它們進行的反應命名。通常,將字尾-ase新增到底物的名稱(例如,乳糖酶是裂解乳糖的酶)或反應型別(例如,DNA 聚合酶形成 DNA 聚合物)。
已經證明酶可以在活細胞外起作用,下一步是確定它們的生化性質。許多早期研究人員注意到酶活性與蛋白質相關,但一些科學家(如諾貝爾獎獲得者理查德·維爾施泰特)認為蛋白質僅僅是真正酶的載體,蛋白質本身不具備催化能力。然而,1926 年,詹姆斯·B·薩默 證明了酶脲酶是一種純蛋白質,並將其結晶化;薩默也對過氧化氫酶進行了類似的操作,時間是 1937 年。純蛋白質可以作為酶的結論最終由諾斯羅普和斯坦利證明,他們研究了消化酶胃蛋白酶 (1930)、胰蛋白酶和胰凝乳蛋白酶。這三位科學家獲得了 1946 年諾貝爾化學獎。[7] 酶可以被結晶化的發現最終使得透過X 射線晶體學解決它們的結構成為可能。這最早是在溶菌酶上完成的,溶菌酶是一種存在於眼淚、唾液和蛋清中的酶,它消化某些細菌的塗層;該結構由大衛·奇爾頓·菲利普斯領導的小組解決,並於 1965 年發表。[8] 溶菌酶的高解析度結構標誌著結構生物學領域的開端以及在原子水平上理解酶如何工作的努力。[9]
新陳代謝
[edit | edit source]
代謝一詞源於希臘語 Metabolismos,意思是“變化”或“顛覆”。[10] 代謝科學研究史跨越 400 年。關於人體代謝的第一個受控實驗是由桑托里奧·桑托里奧於 1614 年在他的書Ars de statica medecina中發表的。[11] 這本書描述了他如何在進食、睡眠、工作、性交、禁食、飲酒和排洩前後稱重。他發現他攝入的大部分食物都透過他稱之為“無形排汗”的方式流失了。[12]
20 世紀
[edit | edit source]從那時起,生物化學取得了進步,特別是在 20 世紀中葉以後,隨著色譜法、X 射線衍射、核磁共振波譜、放射性同位素標記、電子顯微鏡和分子動力學模擬等新技術的開發。這些技術使人們能夠發現和詳細分析細胞的許多分子和代謝途徑,例如糖酵解和克雷布斯迴圈(檸檬酸迴圈)。這些現代生物化學家中最有成就的一位是 漢斯·阿道夫·克雷布斯,他對代謝研究做出了巨大貢獻。 [13] 他發現了尿素迴圈,後來與漢斯·科恩伯格合作發現了檸檬酸迴圈和乙醛酸迴圈。 [14] [15] [16] 1960 年,生物化學家 羅伯特·克萊恩 揭示了他發現鈉-葡萄糖 協同運輸 作為腸道葡萄糖吸收機制的過程。 [17] 這是第一個關於離子通量和底物通量之間的偶聯的提議,被視為引發了生物學領域的革命。如今,生物化學的發現被應用於許多領域,從遺傳學到分子生物學,以及從農業到 醫學。 [18]
生物能學
[edit | edit source]生物能學是生物化學的一個分支,它關注生物體中分子化學鍵的形成和斷裂所涉及的能量。生長、發育和代謝是生物體研究中的一些核心現象。能量的作用對於這些生物過程至關重要。從各種代謝途徑中獲取能量的能力是所有生物體的一個特性。生命依賴於能量轉化;生物體之所以能存活,是因為在內部和外部之間存在著能量交換。在活生物體中,化學鍵斷裂和形成是能量交換和轉化的組成部分。當弱鍵斷裂而形成強鍵時,能量可用於做功(例如機械功)或用於其他過程(例如化學合成和生長中的合成代謝過程)。更強鍵的形成允許釋放可用能量。 [19]
生物體從有機和無機材料中獲取能量。例如,化能無機營養生物可以氧化硝酸鹽或硫的各種形式,例如元素硫、亞硫酸鹽和硫化氫來產生 ATP。在光合作用中,自養生物可以利用光能產生 ATP。異養生物必須消耗有機化合物。這些主要是碳水化合物、脂肪和蛋白質。生物體實際獲得的能量量低於食物中存在的能量量;在消化、代謝和產熱過程中會產生能量損失。這些材料通常與氧氣結合釋放能量,儘管一些材料也可以被各種生物體厭氧氧化。與保持二氧化碳和水分子結合在一起的化學鍵相比,保持營養物質分子結合在一起的鍵以及保持自由氧分子結合在一起的鍵都相對較弱。利用這些材料是一種緩慢燃燒的形式。這就是為什麼可以用彈式量熱計估計食物的能量含量的原因。這些材料氧化得足夠慢,以至於生物體實際上不會產生火焰。氧化釋放能量,因為形成了更強的鍵(對應於更低的能量)。這種淨能量可能以熱量的形式釋放出來,或者其中的一部分可能被生物體用於其他目的,例如斷裂其他鍵以進行化學反應。
生物體透過氧化磷酸化從能量來源產生 ATP。ATP 的末端磷酸鍵與 ATP 降解為腺嘌呤單磷酸和磷酸鹽(溶解在水中)時形成的更強鍵相比相對較弱。在這裡,水合作用的能量導致能量釋放。這種 ATP 水解被用作電池,用於在細胞中儲存能量,以進行中間代謝。從這種分子鍵重排中利用化學能為每個生物體中的生物過程提供動力。 [20]
熵 [21]
[edit | edit source]熵的概念由熱力學第二定律定義,該定律指出封閉系統的熵總是增加或保持不變。
熵變 當理想氣體發生變化時,其熵也可能發生變化。對於比熱容不變且體積、壓力或溫度也保持不變的情況,熵變可以很容易地計算出來。 [22]
當比熱容和體積保持不變時,熵變由下式給出
- .
當比熱容和壓力保持不變時,熵變由下式給出
- .
當比熱容和溫度保持不變時,熵變由下式給出
- .
在這些方程中 是恆容比熱容, 是恆壓比熱容, 是 理想氣體常數, 是氣體的 摩爾 數。
對於其他一些轉化,並非所有這些性質(比熱容、體積、壓力或溫度)都是恆定的。在這些情況下,對於 1 摩爾的理想氣體,熵變可以用下式給出: [23]
- 或者
- .
焓[24]
[edit | edit source]焓是熱力學體系總能量的量度。它包括內能,即建立體系所需的能量,以及透過取代其環境並建立其體積和壓力而為其騰出空間所需的能量。
體系的焓定義為
其中
請注意,U 項等效於建立體系所需的能量,而 pV 項等效於如果環境壓力保持恆定,則為體系“騰出空間”所需的能量。
pV 項可以透過以下等壓過程的示例來理解。考慮氣體在氣缸中改變其體積(例如,透過化學反應),推動活塞,保持恆定壓力 p。力由活塞的面積 A 和壓力的定義 p = F/A 計算:力為 F = pA。根據定義,所做的功 W 為 W = Fx,其中 x 是活塞移動的距離。結合起來得到 W = pAx,而乘積 Ax 是活塞移動的體積:Ax = V。因此,氣體所做的功為 W = pV,其中 p 為恆定壓力,V 為體積膨脹。包含此 pV 項意味著在恆定壓力膨脹期間,任何作為對環境工作的損失的內能不會影響焓值。焓變可以定義為 ΔH = ΔU + W = ΔU + Δ(pV),其中 ΔU 是因膨脹而損失的熱能,W 是因對活塞所做的功而獲得的能量。[25]
吉布斯自由能
[edit | edit source]在熱力學中,吉布斯自由能(IUPAC 推薦名稱:吉布斯能或吉布斯函式;也稱為自由焓[1],以將其與亥姆霍茲自由能區分開來)是熱力學勢,它測量從等溫等壓熱力學系統中可以獲得的“有用”或過程啟動功。
吉布斯自由能最初被稱為可用能,是由美國數學家約西亞·威拉德·吉布斯在 1870 年代發展起來的。1873 年,吉布斯將這種“可用能”描述為從給定量的某種物質在給定初始狀態中獲得的最大機械功,前提是不增加其總體積,也不允許熱量傳遞到外部物體或從外部物體傳遞到內部物體,除了在過程結束時留下的那些物體處於其初始狀態。[26]
反應的自由能
[edit | edit source]為了推匯出孤立系統的吉布斯自由能方程,設Stot為孤立系統的總熵,即不能與周圍環境交換熱量或質量的系統。根據熱力學第二定律
如果 ΔStot = 0,則該過程是可逆的。對於絕熱系統,熱傳遞 Q 消失。任何絕熱過程,如果也是可逆的,則被稱為等熵 過程。
現在考慮具有內部熵 Sint 的系統。這樣的系統與周圍環境發生熱連線,周圍環境具有熵 Sext。熵形式的第二定律只適用於系統及其周圍環境形成的封閉系統。因此,如果
- .
如果 Q 是從周圍環境傳遞到系統的熱量,那麼 −Q 是周圍環境損失的熱量
- 因此 對應於周圍環境的熵變。
- 現在我們有
- 將等式兩邊乘以T
Q 是傳遞到系統的熱量;如果現在假設該過程為等壓,則 Qp = ΔH
ΔH 是反應焓變(對於恆壓下的化學反應)。那麼
對於一個可能的程序。令吉布斯自由能的變化 ΔG 定義為
- (eq.1)
注意,它沒有用任何外部狀態函式定義,例如 ΔSext 或 ΔStot。那麼第二定律變為,它也告訴我們反應的自發性
- 有利反應(自發)
- 正向和逆向反應都沒有佔優 (平衡)
- 不利反應(非自發)
吉布斯自由能 G 本身定義為
- (eq.2)
但請注意,要從等式 (1) 獲得等式 (2),我們必須假設 T 是恆定的。因此,吉布斯自由能最適用於恆溫和恆壓的熱化學過程:等溫和等壓。這種過程不會在 P-V 圖上移動,例如純物質的相變,它發生在飽和壓力和溫度下。然而,化學反應確實會經歷 化學勢 的變化,化學勢是一個狀態函式。因此,熱力學過程並不侷限於二維 P-V 圖。對於 n,即氣體量,還有一個第三維。對於爆炸性化學物質的研究,這些過程不一定是等溫和等壓的。對於這些研究,使用亥姆霍茲自由能。[27]
如果一個孤立系統 (Q = 0) 處於恆壓 (Q = ΔH),那麼
因此,孤立系統的吉布斯自由能為
如果 ΔG ≤ 0,那麼這意味著 ΔS ≥ 0,回到我們開始推導 ΔG 的地方
有用恆等式
[edit | edit source]- 在恆溫下
- (參見 化學平衡).
並重新排列得到
將反應的電勢與該反應的平衡係數聯絡起來 (能斯特方程).
其中
ΔG = 吉布斯自由能變化,ΔH = 焓變化,T = 絕對溫度,ΔS = 熵變化,R = 氣體常數,ln = 自然對數,ΔrG = 反應吉布斯自由能變化,ΔrG° = 反應吉布斯自由能標準變化,K = 平衡常數,Qr = 反應商,n = 每摩爾產物的電子數,F = 法拉第常數 (庫侖每摩爾),E = 反應的電極電勢。此外,我們還有
將平衡常數與吉布斯自由能聯絡起來。[28]
細胞是生命的基本單位
[edit | edit source]細胞是生命的基本功能單位。細胞是由羅伯特·胡克發現的,是所有已知生物體的功能單位。它是生命中最小的單位,被歸類為生物,通常被稱為生命的積木。一些生物,例如大多數細菌,是單細胞的(由單個細胞組成)。其他生物,例如人類、貓、狗和鳥類,是多細胞的。人類大約有100萬億或10 14 個細胞;典型的細胞大小為10 µm,典型的細胞質量為1納克。最大的細胞約為135 µm,位於脊髓前角,而小腦中的顆粒細胞,是最小的,可以小到4 µm,最長的細胞可以從腳趾延伸到下腦幹(假單極細胞)。
已知最大的細胞是未受精的鴕鳥卵細胞,重量為3.3磅。1835年,在最終的細胞學說發展之前,揚·埃萬格利斯塔·普爾基涅在顯微鏡下觀察植物組織時,觀察到了小的“顆粒”。細胞學說,由馬蒂亞斯·雅各布·施萊登和西奧多·施旺於1839年首次提出,指出所有生物都由一個或多個細胞組成,所有細胞都來自現有的細胞,生物體的生命功能發生在細胞內,所有細胞都包含調節細胞功能和將資訊傳遞給下一代細胞的遺傳資訊。“細胞”一詞來自拉丁語“cellula”,意思是“小房間”。對最小生物結構的描述性術語是由羅伯特·胡克在1865年出版的一本書中創造的,當時他將他在顯微鏡下看到的軟木細胞比作僧侶居住的小房間。細胞有兩種型別:真核細胞和原核細胞。原核細胞通常是獨立的,而真核細胞通常存在於多細胞生物中。 [29]
生命起源和米勒實驗[30]
實驗 地球早期的大氣一些證據表明,地球最初的大氣可能比米勒-尤里實驗時所認為的還原性分子更少。有大量證據表明,40億年前發生了重大火山噴發,這些噴發會將二氧化碳、氮氣、硫化氫 (H2S) 和二氧化硫 (SO2) 釋放到大氣中。除了米勒-尤里實驗中使用的氣體外,使用這些氣體進行的實驗產生了更多樣化的分子。實驗創造了一種外消旋混合物(包含 L 和 D 對映異構體),後來的實驗表明,“在實驗室裡,兩種版本出現的可能性相同”。[31] 然而,在自然界中,L 氨基酸占主導地位;後來的實驗已經證實,L 或 D 方向的對映異構體可能存在不均衡的量。[32]
最初人們認為,原始次要大氣主要包含氨和甲烷。然而,很可能大多數大氣碳是CO2,可能還有一些CO,氮氣主要是N2。在實踐中,只要沒有O2,包含CO、CO2、N2等的混合氣體與包含CH4和NH3的混合氣體產生的產物幾乎相同。氫原子主要來自水蒸氣。事實上,為了在原始地球條件下生成芳香族氨基酸,必須使用氫含量較低的混合氣體。在米勒實驗的變體中,已經制造了大多數天然氨基酸、羥基酸、嘌呤、嘧啶和糖。[33]
最近的結果可能對這些結論提出質疑。滑鐵盧大學和科羅拉多大學於2005年進行了模擬,結果表明,地球早期的大氣可能包含高達40%的氫——這意味著對前生物有機分子形成可能是一個更加有利的環境。根據對高層大氣溫度的修正估計,氫從地球大氣逃逸到太空的速度可能只有之前認為速度的百分之一。[34] 作者之一歐文·圖恩指出:“在這種新的情況下,有機物可以在早期大氣中有效地產生,這讓我們回到了海洋中富含有機物的湯的概念......我認為這項研究使米勒和其他人的實驗再次變得相關。”使用早期地球的球粒隕石模型進行的脫氣計算補充了滑鐵盧/科羅拉多大學的結果,重新確立了米勒-尤里實驗的重要性。[35]
與米勒-尤里實驗類似的條件存在於太陽系的其他區域,通常用紫外線光代替閃電作為化學反應的能量來源。默奇森隕石於1969年墜落在澳大利亞默奇森,維多利亞附近,發現其中含有超過90種不同的氨基酸,其中19種存在於地球生命中。 彗星和其他冰冷的外太陽系天體被認為含有大量的複雜碳化合物(如託林),這些化合物是透過這些過程形成的,使這些天體表面變暗。[36] 早期的地球受到彗星的猛烈轟擊,可能為地球提供了大量的複雜有機分子,以及它們貢獻的水和其他揮發物。這已被用來推斷地球生命起源於地球之外:泛種論假說。米勒和尤里實驗[37](或尤里-米勒實驗)[38]是一個實驗,模擬了當時認為存在於早期地球上的假設條件,並測試了生命的化學起源的發生情況。具體來說,該實驗測試了亞歷山大·奧巴林和J. B. S. 霍爾丹的假設,即原始地球上的條件有利於將無機前體合成有機化合物的化學反應。被認為是生命起源的經典實驗,它是在1952年進行的[39],並於1953年由斯坦利·米勒和哈羅德·尤里在芝加哥大學發表。[40][41][42]
米勒於2007年去世後,科學家們檢查了從原始實驗中儲存下來的密封小瓶,結果表明米勒最初的實驗中實際上產生了超過20種不同的氨基酸。這比米勒最初報告的要多得多,也比自然界中存在的20種氨基酸要多。此外,一些證據表明,地球最初的大氣可能與米勒-尤里實驗中使用的氣體成分不同。有大量證據表明,40億年前發生了重大火山噴發,這些噴發會將二氧化碳、氮氣、硫化氫 (H2S) 和二氧化硫 (SO2) 釋放到大氣中。除了米勒-尤里實驗中使用的氣體外,使用這些氣體進行的實驗產生了更多樣化的分子。[31]
實驗
實驗使用了水 (H2O)、甲烷 (CH4)、氨 (NH3) 和氫 (H2)。這些化學物質都被密封在一個無菌的玻璃管和燒瓶陣列中,這些管和燒瓶連線成一個迴圈,其中一個燒瓶中裝有一半液體水,另一個燒瓶中裝有一對電極。加熱液體水使其蒸發,在電極之間放電以模擬穿過大氣的水蒸汽中的閃電,然後冷卻大氣,使水蒸汽凝結並以連續迴圈的方式流回第一個燒瓶。
在一個星期的持續執行結束後,米勒和尤里觀察到,系統中高達10%-15%的碳現在以有機化合物的形式存在。2%的碳形成了氨基酸,這些氨基酸用於製造活細胞中的蛋白質,其中甘氨酸含量最豐富。還形成了糖和液體。在反應中沒有形成核酸。但是,形成了常見的20種氨基酸,但濃度不同。
斯坦利·米勒在一次採訪中說:“在基本的預生物實驗中,只要開啟電火花,就會產生20種氨基酸中的11種。”[43]
正如在所有後續實驗中觀察到的那樣,左手性 (L) 和右手性 (D) 旋光異構體是在外消旋混合物中產生的。
最初的實驗至今仍由米勒和尤里的前學生傑弗裡·巴達教授在加州大學聖地亞哥分校的斯克裡普斯海洋研究所保管。[44]
混合物成分之間的一步反應可以產生氰化氫 (HCN)、甲醛 (CH2O)[45]和其他活性中間體化合物(乙炔、氰基乙炔等)
- CO2 → CO + [O](原子氧)
- CH4 + 2[O] → CH2O + H2O
- CO + NH3 → HCN + H2O
- CH4 + NH3 → HCN + 3H2 (BMA 過程)
然後,甲醛、氨和 HCN 透過施特雷克合成反應生成氨基酸和其他生物分子。
- CH2O + HCN + NH3 → NH2-CH2-CN + H2O
- NH2-CH2-CN + 2H2O → NH3 + NH2-CH2-COOH(甘氨酸)
此外,水和甲醛可以透過布特列洛夫反應生成各種糖,如核糖。
其他實驗 這個實驗激發了其他許多實驗。1961 年,Joan Oró 發現,在水溶液中,氫氰酸 (HCN) 和氨可以生成腺嘌呤核苷酸鹼基。他的實驗產生了大量的腺嘌呤,這些分子由 5 個 HCN 分子形成。[46] 此外,在這些條件下,許多氨基酸都是由 HCN 和氨形成的。[47] 後來的實驗表明,其他RNA 和 DNA 核苷酸鹼基可以透過模擬的原始生命化學過程,在具有還原性大氣的環境中獲得。[48]
與米勒-尤里實驗同時進行的,還有其他一些與生命起源相關的類似放電實驗。1953 年 3 月 8 日,《紐約時報》上的一篇名為“回顧二十億年”的文章描述了俄亥俄州立大學沃爾曼(威廉)·M·麥克尼文在米勒發表《科學》論文之前所做的一些研究。麥克尼文在甲烷和水蒸氣中通入 100,000 伏的電火花,併產生了“樹脂狀固體”,這些固體“太複雜而無法分析”。這篇文章描述了麥克尼文進行的其他早期地球實驗。目前尚不清楚他是否在主要的科學文獻中發表過這些結果。
1952 年 12 月 15 日,在米勒於 1953 年 2 月 14 日向《科學》雜誌提交論文之前,K. A. 維爾德向該雜誌提交了一篇論文。維爾德的論文於 1953 年 7 月 10 日發表。[49] 維爾德在二元混合物(二氧化碳 (CO2) 和水)的流動系統中使用了最高 600 伏的電壓。他只觀察到少量二氧化碳還原為一氧化碳,沒有其他顯著的還原產物或新形成的碳化合物。其他研究人員正在研究紫外線-光解 水蒸氣與一氧化碳。他們發現,在反應混合物中合成了各種醇、醛和有機酸。[50]
加州大學聖地亞哥分校斯克裡普斯海洋研究所(位於拉霍亞,加州)的化學家傑弗裡·巴達最近進行的實驗與米勒進行的實驗相似。然而,巴達指出,在當前的早期地球條件模型中,二氧化碳和氮氣 (N2) 會產生亞硝酸鹽,亞硝酸鹽會以氨基酸形成的速度破壞氨基酸。然而,早期地球可能含有大量的鐵和碳酸鹽礦物,可以中和亞硝酸鹽的影響。當巴達在米勒型實驗中新增鐵和碳酸鹽礦物時,產物中富含氨基酸。這表明,即使在地球大氣中含有二氧化碳和氮氣的情況下,地球上也可能產生了大量的氨基酸。[51]。
原核生物
[edit | edit source]
原核生物是單細胞生物,沒有細胞核、線粒體或任何其他膜結合的細胞器。換句話說,它們的 DNA 以及它們的任何其他代謝活性部位都不會集中在某個離散的膜封閉區域。相反,所有東西都在細胞內自由存取,其中一些是自由漂浮的[3]。原核生物和真核生物(意思是真核,也拼寫為“真核生物”)之間的區別在於,真核生物確實擁有包含其 DNA 的“真”核。與原核生物不同,真核生物可以是單細胞的,如變形蟲,也可以是多細胞的,如植物和動物。原核生物和真核生物的結構差異非常大,以至於有時被認為是生物體群體之間最重要的區別。原核生物的細胞結構與真核生物的細胞結構有很大差異。其決定性特徵是缺乏細胞核。此外,原核生物的核糖體大小也比真核生物的核糖體小,現在,核糖體是呼吸作用發生的地方。原核生物的基因組被儲存在細胞質中一個不規則的 DNA/蛋白質複合物中,稱為擬核,它沒有核膜。[52]
一般來說,原核生物缺乏以下膜結合的細胞隔室:線粒體和葉綠體。相反,氧化磷酸化和光合作用等過程發生在原核生物的質膜中。然而,原核生物確實擁有一些內部結構,例如細胞骨架,而細菌目浮黴菌目在其擬核周圍有一個膜,並且包含其他膜結合的細胞結構。真核生物和原核生物都包含稱為核糖體的大型 RNA/蛋白質結構,這些結構產生蛋白質。原核生物通常比真核細胞小得多。原核生物還不同於真核生物,因為它們只包含一個位於稱為擬核的區域的穩定染色體 DNA 環,而真核生物的 DNA 則位於緊密結合和有序的染色體上。儘管一些真核生物具有稱為質粒的衛星 DNA 結構,但通常認為這些是原核生物的特徵,而原核生物中的許多重要基因都儲存在質粒中。原核生物具有更大的表面積與體積比,使其具有更高的代謝率、更高的生長速率,以及與真核生物相比更短的世代時間。對這種分類的一個批評是,“原核生物”這個詞是基於這些生物體不是什麼(它們不是真核生物),而不是它們是什麼(是古細菌或細菌)。1977 年,卡爾·沃斯提出將原核生物分為細菌和古細菌(最初為真細菌和古細菌),因為這兩類生物體的結構和遺傳學存在重大差異。這種真核生物(也稱為“真核生物”)、細菌和古細菌的排列被稱為三域系統,取代了傳統的兩界系統。[53]
真核細胞
[edit | edit source]
真核細胞的起源是生命進化史上的一個里程碑,因為它們包括所有複雜細胞和幾乎所有多細胞生物。這一系列事件的時間很難確定;諾爾(2006)認為它們大約在 16 億到 21 億年前形成。已知一些疑源類生物至少存在於 16.5 億年前,而可能存在的藻類格里潘尼亞(Grypania)可以追溯到 21 億年前。與現代群體明顯相關的化石開始出現在大約 12 億年前,以紅藻的形式出現,儘管最近的研究表明,在文德盆地存在可以追溯到 16 億到 17 億年前的化石絲狀藻類。生物標記表明,至少莖真核生物出現得更早。在澳大利亞頁岩中存在甾烷表明,真核生物存在於 27 億年前。[54]
真核細胞有許多不同的型別,儘管動物和植物是最常見的真核生物,因此它們為理解真核生物結構提供了一個極好的起點。然而,真菌和許多原生生物有一些實質性的差異。
動物細胞
動物細胞是真核細胞的一種形式,構成動物體內的許多組織。動物細胞不同於其他真核生物,最明顯的是植物細胞,因為它們缺乏細胞壁和葉綠體,並且它們具有更小的液泡。由於缺乏堅硬的細胞壁,動物細胞可以採用各種形狀,吞噬細胞甚至可以吞噬其他結構。
細胞型別有很多。例如,成年人體內大約有 210 種不同的細胞型別。[55]
植物細胞
植物細胞與其他真核生物的細胞有很大不同。它們的獨特特徵包括:一個大的中央液泡(被一層膜包圍,稱為液泡膜),它維持細胞的膨壓並控制細胞質和液泡之間分子的運動。 細胞壁由纖維素、半纖維素和果膠組成,由原生質體沉積在細胞膜外側;這與真菌的細胞壁(含有幾丁質)和原核生物的細胞外被(其中肽聚糖是主要的結構分子)形成對比。 胞間連絲,連線細胞壁中的孔隙,使每個植物細胞能夠與相鄰的細胞進行通訊;這與動物細胞之間功能相似的間隙連線不同。 質體,特別是含有葉綠素的葉綠體,葉綠素是賦予植物綠色並使它們能夠進行光合作用的色素。 高等植物,包括針葉樹和開花植物(被子植物),缺乏動物細胞中存在的鞭毛和中心體。
真菌細胞
真菌細胞與動物細胞最相似,但有以下例外:細胞壁含有幾丁質。 細胞之間界限不明確;高等真菌的菌絲有稱為隔膜的多孔隔板,允許細胞質、細胞器,有時還有細胞核透過。 原始真菌幾乎沒有隔膜,因此每個生物體本質上都是一個巨大的多核超細胞;這些真菌被稱為具核菌。 只有最原始的真菌,壺菌,有鞭毛。[56]
其他真核細胞 真核生物是一個非常多樣化的群體,它們的細胞結構也同樣多樣化。 許多真核生物有細胞壁,許多沒有。 許多真核生物有葉綠體,這些葉綠體源於初級、次級甚至三次內共生;許多沒有。 一些群體有獨特的結構,例如藍藻體的藍藻體,頂絲藻的頂絲,或隱藻的射出體。 其他結構,如偽足,以不同的形式存在於各種真核生物群體中,例如無定形變形蟲或網狀有孔蟲。
| 原核生物 | 真核生物 | |
|---|---|---|
| 典型生物體 | 細菌,古細菌 | 原生生物,真菌,植物,動物 |
| 典型尺寸 | ~ 1–10 µm | ~ 10–100 µm (精子除尾巴外,尺寸更小) |
| 細胞核型別 | 核區;沒有真正的細胞核 | 被雙層膜包圍的真核 |
| DNA | 環狀(通常) | 線性分子(染色體)與組蛋白 蛋白質 |
| RNA-/蛋白質合成 | 在細胞質中耦合 | RNA在細胞核內合成 蛋白質在細胞質中合成 |
| 核糖體 | 50S+30S | 60S+40S |
| 細胞質結構 | 很少結構 | 由內膜系統和細胞骨架高度結構化 |
| 細胞運動 | 鞭毛由鞭毛蛋白構成 | 鞭毛和纖毛包含微管;片狀偽足和絲狀偽足包含肌動蛋白 |
| 線粒體 | 沒有 | 一個到幾千個(儘管一些沒有線粒體) |
| 葉綠體 | 沒有 | 在藻類和植物中 |
| 組織 | 通常是單細胞 | 單細胞、群體、具有特化細胞的高階多細胞生物 |
| 細胞分裂 | 二元裂殖(簡單分裂) | 有絲分裂(裂殖或出芽) 減數分裂 |
植物細胞與動物細胞不同
[edit | edit source]

植物細胞是真核細胞,在幾個關鍵方面與其他真核生物的細胞不同。 它們的獨特特徵包括:一個大的中央液泡,一個充滿水的體積,被一層稱為液泡膜的膜包圍,它維持細胞的膨壓,控制細胞質和液泡之間分子的運動,儲存有用的物質並消化廢棄的蛋白質和細胞器。
細胞壁由纖維素和半纖維素、果膠以及在許多情況下由木質素組成,由原生質體分泌到細胞膜外側。 這與真菌(由幾丁質構成)和細菌(由肽聚糖構成)的細胞壁形成對比。 稱為胞間連絲的特殊細胞間通訊途徑,即穿過初生細胞壁的孔隙,相鄰細胞的質膜和內質網在其中是連續的。
質體,其中最著名的是葉綠體,它包含葉綠素和用於光捕獲和光合作用的生化系統,但也包括專門用於澱粉儲存的澱粉體,專門用於脂肪儲存的油質體,以及專門用於色素合成和儲存的色素體。 與線粒體一樣,線粒體擁有編碼 37 個基因的基因組,質體也有自己的基因組,包含大約 100-120 個獨特的基因,並且據推測,質體起源於早期真核生物祖先細胞中存在的原核內共生體。
與動物細胞不同,植物細胞是靜止的。 透過在胞質分裂後期建立細胞板作為構建細胞壁模板的方式進行細胞分裂是陸地植物和少數藻類群體的特徵,其中最著名的是輪藻綱和絲藻目。 苔蘚植物的精子有與動物精子相似的鞭毛,但高等植物(包括裸子植物和開花植物)缺乏動物細胞中存在的鞭毛和中心體。[57]
| 典型動物細胞 | 典型植物細胞 | |
|---|---|---|
| 細胞器 |
真核細胞器起源和內共生理論
[edit | edit source]內共生理論(源於希臘語:endo- 意為內部,-symbiosis 意為共居)最初由俄羅斯植物學家康斯坦丁·梅列什科夫斯基於 1905 年提出。 梅列什科夫斯基熟悉植物學家安德烈亞斯·施萊姆佩爾的著作,施萊姆佩爾於 1883 年觀察到綠色植物中葉綠體的分裂與自由生活的藍藻非常相似,並且他自己曾試探性地提出(在腳註中)綠色植物起源於兩種生物體的共生結合。 伊萬·沃林在 1920 年代將內共生起源的概念擴充套件到線粒體。 這些理論最初被駁回或忽視。 對藍藻和葉綠體之間進行的更詳細的電子顯微鏡比較(例如漢斯·里斯的研究),再加上發現質體和線粒體包含它們自己的 DNA(在那時,人們已經認識到 DNA 是生物體的遺傳物質),導致了這一概念在 1960 年代的復興。 內共生理論由琳·馬古利斯在 1967 年發表的論文《有絲分裂真核細胞的起源》中用微生物學證據進一步闡述和證實。[58]
在她 1981 年的著作《細胞進化中的共生》中,她論證了真核細胞起源於相互作用的實體的群體,包括演化為真核鞭毛和纖毛的內共生螺旋體。 最後一個想法沒有得到廣泛認可,因為鞭毛缺乏 DNA 並且在超微結構上與細菌或古細菌沒有相似之處。 根據馬古利斯和多里昂·薩根的說法,“生命不是透過戰鬥,而是透過網路來接管地球”(即透過合作)。 人們也認為過氧化物酶可能具有內共生起源,儘管它們缺乏 DNA。 克里斯蒂安·德·杜夫提出,它們可能是最早的內共生體,使細胞能夠承受地球大氣中不斷增加的遊離氧氣分子。 然而,現在看來它們可能是從頭開始形成的,這與它們具有共生起源的想法相矛盾。
據信,在漫長的歲月中,這些內共生體在從共生群體到建立的真核細胞的進化轉變過程中,將它們自身的一些 DNA 轉移到了宿主細胞的細胞核中(稱為“串聯內共生”)。 這種假設被認為是可能的,因為如今從科學觀察中已知,即使是親緣關係不密切的細菌之間也會發生 DNA 轉移。 細菌可以從周圍環境中吸收 DNA,並且具有有限的能力將其整合到自己的基因組中。[59]
真核生物是結構複雜的細胞型別之一,根據定義,它們在一定程度上由更小的內部隔室組織,這些隔室本身被類似於最外層細胞膜的脂質膜包裹。較大的細胞器,如細胞核和液泡,在光學顯微鏡下很容易看到。它們是顯微鏡發明後最早的生物學發現之一。[60]
並非所有真核細胞都具有下面列出的所有細胞器。特殊的生物體擁有不包含某些細胞器的細胞,這些細胞器可能被認為是真核生物的普遍存在(例如線粒體)。[61] 下面的表格中也有一些關於細胞器周圍膜的數量的例外情況(例如,有些被列為雙層膜,有時也被發現只有一層或三層膜)。此外,在特定細胞中發現的每種型別細胞器的數量會根據該細胞的功能而變化。
| 細胞器 | 主要功能 | 結構 | 生物體 | 說明 |
|---|---|---|---|---|
| 葉綠體 (質體) | 光合作用 | 雙層膜隔室 | 植物,原生生物 (罕見的 盜食質體生物) | 具有一些基因;被認為是被祖先真核細胞吞噬(內共生) |
| 內質網 | 新蛋白質的翻譯和摺疊(粗麵內質網),脂質的表達(光面內質網) | 單層膜隔室 | 所有真核生物 | 粗麵內質網表面覆蓋著核糖體,具有扁平囊狀的摺疊;光面內質網具有管狀的摺疊 |
| 高爾基體 | 蛋白質的分類和修飾 | 單層膜隔室 | 所有真核生物 | 順面(凸面)靠近粗麵內質網;反面(凹面)遠離粗麵內質網 |
| 線粒體 | 能量產生(房子),線粒體是自複製的細胞器,存在於所有真核細胞的細胞質中,數量、形狀和大小各不相同。 | 雙層膜隔室 | 大多數真核生物 | 具有一些 DNA;被認為是被祖先真核細胞吞噬(內共生) |
| 液泡 | 儲存,有助於維持 穩態 | 單層膜隔室 | 真核生物 | |
| 細胞核 | 它容納細胞的染色體,也是幾乎所有 DNA 複製、RNA 轉錄 發生的地方 | 雙層膜隔室 | 所有真核生物 | 包含大多數 基因組 |
線粒體和葉綠體具有雙層膜和自己的 DNA,被認為起源於未完全消耗或入侵的 原核生物,這些生物被作為入侵細胞的一部分而被接納。這個想法在 內共生理論 中得到支援。
| 細胞器/大分子 | 主要功能 | 結構 | 生物體 |
|---|---|---|---|
| 頂體 | 幫助精子與卵子融合 | 單層膜隔室 | 許多動物 |
| 自噬體 | 包裹細胞質物質和細胞器以進行降解的囊泡 | 雙層膜隔室 | 所有真核細胞 |
| 中心粒 | 是 細胞骨架 的錨點,幫助細胞分裂 | 微管 蛋白質 | 動物 |
| 纖毛 | 在外部介質中或內部介質中的運動;“關鍵的發育訊號通路”。[62] | 微管 蛋白質 | 動物,原生生物,少數植物 |
| 眼點裝置 | 檢測光線,允許進行 趨光性 | 綠藻 和其他單細胞 光合作用 生物,如 眼蟲 | |
| 糖體 | 進行 糖酵解 | 單層膜隔室 | 一些 原生動物,如錐蟲。 |
| 乙醛酸體 | 將脂肪轉化為糖 | 單層膜隔室 | 植物 |
| 氫化酶體 | 能量和氫氣的產生 | 雙層膜隔室 | 一些單細胞真核生物 |
| 溶酶體 | 分解大分子(例如,蛋白質 + 多糖) | 單層膜隔室 | 大多數真核生物 |
| 黑色素體 | 色素儲存 | 單層膜隔室 | 動物 |
| 線粒體體 | 尚未被描述 | 雙層膜隔室 | 一些單細胞真核生物 |
| 肌原纖維 | 肌肉收縮 | 成束的細絲 | 動物 |
| 核仁 | 核糖體的產生 | 蛋白質-DNA-RNA | 大多數真核生物 |
| 副核體 | 尚未被描述 | 尚未被描述 | 真菌 |
| 過氧化物酶體 | 分解代謝產生的過氧化氫 | 單層膜隔室 | 所有真核生物 |
| 核糖體 | 翻譯 RNA 為蛋白質 | RNA-蛋白質 | 真核生物,原核生物 |
| 囊泡 | 物質運輸 | 單層膜隔室 | 所有真核生物 |
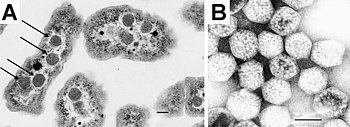
原核生物不如真核生物結構複雜,曾經被認為沒有任何被脂質膜包裹的內部結構。過去,人們通常認為它們內部結構組織很少;但隨著時間的推移,人們對原核生物內部結構的認識逐漸加深。20 世紀 70 年代,人們提出了一個錯誤的觀點,即細菌可能含有被稱為 間體 的膜摺疊,但後來證明這些間體是用來準備細胞進行電子顯微鏡觀察的化學物質產生的假象。[64] [65]
然而,最近的研究表明,至少一些原核生物具有 微隔室,如 羧化體。這些亞細胞隔室直徑為 100-200 奈米,被一層蛋白質外殼包圍。[66] 更引人注目的是,人們描述了細菌中的膜結合磁小體,[67] [68] 以及浮黴菌中的類核結構,這些結構被 脂質雙層膜 包圍。[69]
| 細胞器/大分子 | 主要功能 | 結構 | 生物體 |
|---|---|---|---|
| 羧化體 | 碳固定 | 蛋白質外殼隔室 | 一些細菌 |
| 葉綠素體 | 光合作用 | 光捕獲複合體 | 綠硫細菌 |
| 鞭毛 | 在外部介質中的運動 | 蛋白質絲 | 一些原核生物和真核生物 |
| 磁小體 | 磁性定向 | 無機晶體,脂質膜 | 磁性細菌 |
| 擬核 | DNA 維持,轉錄 為 RNA | DNA-蛋白質 | 原核生物 |
| 質粒 | DNA 交換 | 環狀 DNA | 一些細菌 |
| 核糖體 | 翻譯 RNA 為蛋白質 | RNA-蛋白質 | 真核生物,原核生物 |
| 類囊體 | 光合作用 | 光系統蛋白質和色素 | 主要為藍細菌 |
大腸桿菌是微生物學研究中常用的模式生物。培養菌株(例如大腸桿菌K12)已很好地適應實驗室環境,與野生型菌株不同,它們失去了在腸道中生存的能力。許多實驗室菌株失去了形成生物膜的能力。這些特徵保護野生型菌株免受抗體和其他化學攻擊,但需要大量能量和物質資源。1946年,喬舒亞·萊德伯格和愛德華·塔特姆首次描述了細菌接合現象,以大腸桿菌作為模式細菌,它仍然是研究接合的主要模型。[需要引用] 大腸桿菌是第一個理解噬菌體遺傳學實驗不可或缺的一部分,早期研究人員,如西摩·本澤,利用大腸桿菌和T4噬菌體來理解基因結構的地形。在Benzer的研究之前,人們不知道基因是線性結構,還是有分支模式。大腸桿菌是首批完成基因組測序的生物之一;大腸桿菌K12的完整基因組於1997年由《科學》雜誌發表。
由理查德·倫斯基於1988年開始的長期大腸桿菌進化實驗,使人們能夠直接觀察到實驗室中主要的進化轉變。在這個實驗中,大腸桿菌的一個種群意外地進化出能夠有氧代謝檸檬酸鹽的能力。這種能力在大腸桿菌中極其罕見。由於不能有氧生長通常被用作鑑別大腸桿菌與其他密切相關的細菌(如沙門氏菌)的診斷標準,因此這種創新可能標誌著一個在實驗室中觀察到的物種形成事件。透過將奈米技術與景觀生態學相結合,可以生成具有奈米尺度細節的複雜棲息地景觀。在這些合成生態系統中,已經進行了大腸桿菌的進化實驗,以研究適應在晶片上的島嶼生物地理學中的空間生物物理學。
由於大腸桿菌在實驗室培養中的悠久歷史和易於操作,它在現代生物工程和工業微生物學中也發揮著重要作用。斯坦利·諾曼·科恩和赫伯特·博耶在大腸桿菌中使用質粒和限制性內切酶建立重組DNA的工作,成為了生物技術的基礎。被認為是生產異源蛋白的非常通用的宿主,研究人員可以使用質粒將基因引入微生物,從而在工業發酵過程中實現蛋白質的大規模生產。還開發了遺傳系統,允許使用大腸桿菌生產重組蛋白。重組DNA技術的第一個實用應用之一是對大腸桿菌進行改造以生產人胰島素。經過修飾的大腸桿菌已被用於疫苗開發、生物修復和固定酶的生產。然而,大腸桿菌不能用於生產一些更大、更復雜的蛋白質,這些蛋白質含有多個二硫鍵,尤其是未配對的硫醇,或者需要翻譯後修飾才能具有活性的蛋白質。目前還正在進行研究,研究如何對大腸桿菌進行程式設計,以解決複雜的數學問題,如哈密頓路徑問題。

1. 出芽
2. 接合
3. 孢子
模式生物
當研究人員尋找用於研究的生物體時,他們會尋找幾種特徵。其中包括大小、世代時間、可及性、可操作性、遺傳學、機制的保守性和潛在的經濟效益。釀酒酵母和裂殖酵母都是研究得很透徹的物種;這兩個物種在大約3億到6億年前分化,是研究DNA損傷和修復機制的重要工具。釀酒酵母的α因子,已被與真菌Tremella mesenterica產生的親脂性肽進行比較。釀酒酵母已發展成為一種模式生物,因為它在許多這些標準上得分很高。作為單細胞生物,釀酒酵母很小,世代時間短(在30°C(86°F)下倍增時間為1.25-2小時),並且可以輕鬆培養。這些都是積極的特徵,因為它們允許以低成本快速生產和維護多個標本系。釀酒酵母可以被轉化,允許透過同源重組新增新基因或刪除基因。此外,以單倍體形式培養釀酒酵母的能力簡化了基因敲除菌株的建立。作為真核生物,釀酒酵母與動植物共享複雜的內部細胞結構,而沒有高比例的非編碼DNA,這可能會使高等真核生物的研究變得複雜。釀酒酵母研究是一個強大的經濟驅動因素,至少在最初階段是如此,因為其在工業中的成熟應用。[70]
基因組測序 釀酒酵母是第一個完成測序的真核生物基因組。該基因組序列於1996年4月24日釋出到公共領域。從那時起,釀酒酵母基因組資料庫 (SGD) 一直保持著定期更新。該資料庫是酵母研究人員高度註釋和交叉引用的資料庫。慕尼黑蛋白質序列資訊中心 (MIPS) 維護著另一個重要的釀酒酵母資料庫。基因組由大約12,156,677個鹼基對和6,275個基因組成,緊湊地組織在16條染色體上。只有大約5,800個被認為是真正的功能基因。據估計,酵母與人類的基因組共享約23%。
釀酒酵母基因組序列和完整缺失突變體的可用性進一步增強了釀酒酵母作為理解真核細胞調控模型的潛力。正在進行的專案將透過合成遺傳陣列分析來分析所有雙重缺失突變體的遺傳相互作用,將這項研究更進一步。酵母科學家已經開發出可應用於生物和醫藥科學許多不同領域的方法。這些方法包括用於研究蛋白質相互作用的酵母雙雜交和四聯體分析。
- ↑ 生物化學
- ↑ de Réaumur, RAF (1752). "Observations sur la digestion des oiseaux". Histoire de l'academie royale des sciences. 1752: 266, 461.
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York)
- ↑ Dubos J. (1951). "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)--chance and the prepared mind". Trends Biotechnol. 13 (12): 511–515. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ↑ 諾貝爾獎獲得者Eduard Buchner的傳記,見http://nobelprize.org
- ↑ Eduard Buchner 1907年諾貝爾演講的文字,見http://nobelprize.org
- ↑ 1946 年諾貝爾化學獎獲得者,請訪問 http://nobelprize.org
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution". Nature. 22 (206): 757–761. doi:10.1038/206757a0. PMID 5891407.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (link) - ↑ 生物化學史
- ↑ "代謝". 線上詞源詞典. 檢索於 2007 年 2 月 20 日.
- ↑ Eknoyan G (1999). "Santorio Sanctorius (1561-1636) - founding father of metabolic balance studies". Am J Nephrol. 19 (2): 226–33. doi:10.1159/000013455. PMID 10213823.
- ↑ 生物化學史
- ↑ Kornberg H (2000). "Krebs and his trinity of cycles". Nat Rev Mol Cell Biol. 1 (3): 225–8. doi:10.1038/35043073. PMID 11252898.
- ↑ Krebs, H. A. & Henseleit, K. (1932) "Untersuchungen über die Harnstoffbildung im tierkorper." Z. Physiol. Chem. 210, 33–66.
- ↑ Krebs H, Johnson W (1937 年 4 月 1 日). "動物組織中酮酸的代謝". Biochem J. 31 (4): 645–60. PMC 1266984. PMID 16746382.
- ↑ Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988–91. doi:10.1038/179988a0. PMID 13430766.
- ↑ Robert K. Crane, D. Miller 和 I. Bihler。 “腸道糖類轉運的可能機制限制”。 載於:膜轉運與代謝。 1960 年 8 月 22-27 日在布拉格舉行的研討會論文集。 由 A. Kleinzeller 和 A. Kotyk 編輯。 捷克科學院,布拉格,1961 年,第 439-449 頁。
- ↑ 生物化學史
- ↑ 生物能學
- ↑ 生物能學
- ↑ http://en.wikipedia.org/wiki/Entropy
- ↑ http://www.grc.nasa.gov/WWW/k-12/Numbers/Math/Mathematical_Thinking/ideal_gases_under_constant.htm
- ↑ http://www.grc.nasa.gov/WWW/K-12/airplane/entropy.html
- ↑ http://en.wikipedia.org/wiki/Enthalpy
- ↑ http://en.wikipedia.org/wiki/Enthalpy
- ↑ 吉布斯自由能
- ↑ 吉布斯自由能
- ↑ 吉布斯自由能
- ↑ 細胞生物學
- ↑ 米勒-尤里實驗
- ↑ a b "右旋氨基酸被遺留下來". 新科學家 (Reed Business Information Ltd) (2554): pp. 18. 2006-06-02. http://www.newscientist.com/channel/life/mg19025545.200-righthanded-amino-acids-were-left-behind.html. 檢索於 2008-07-09.
- ↑ Kojo, Shosuke (2004). "Racemic D,L-asparagine causes enantiomeric excess of other coexisting racemic D,L-amino acids during recrystallization: a hypothesis accounting for the origin of L-amino acids in the biosphere". Chemical Communications (19): 2146–2147. doi:10.1039/b409941a. PMID 15467844.
{{cite journal}}:|access-date=requires|url=(help); Unknown parameter|coauthors=ignored (|author=suggested) (help); Unknown parameter|month=ignored (help) - ↑ "MICR 425:微生物的生理學和生物化學:生命的起源". SIUC/科學學院. 檢索於 2005 年 12 月 17 日.
- ↑ "早期地球大氣層有利於生命:研究". 滑鐵盧大學. 檢索於 2005 年 12 月 17 日.
- ↑ Fitzpatrick, Tony (2005). "計算支援早期地球還原性大氣 - 米勒-尤里實驗正確嗎?". 華盛頓大學聖路易斯分校. 檢索於 2005-12-17.
- ↑ Thompson WR, Murray BG, Khare BN, Sagan C (1987). "帶電粒子輻射對甲烷籠合物和其他冰的著色和變暗:對太陽系外層的應用". 地球物理研究雜誌. 92 (A13): 14933–47. doi:10.1029/JA092iA13p14933. PMID 11542127.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護:作者列表的多個名稱 (連結) - ↑ Hill HG, Nuth JA (2003). "宇宙塵埃的催化潛力:對太陽星雲和其他原行星系統中前生物化學的影響". 天體生物學. 3 (2): 291–304. doi:10.1089/153110703769016389. PMID 14577878.
- ↑ Balm SP, Hare J.P., Kroto HW (1991). "彗星質譜資料的分析". 空間科學評論. 56: 185–9. doi:10.1007/BF00178408.
{{cite journal}}: CS1 維護:作者列表的多個名稱 (連結) - ↑ Bada, Jeffrey L. (2000). "斯坦利·米勒 70 歲生日" (PDF). 生命起源和生物圈的演化. 荷蘭:克魯維爾學術出版社. 30: 107–12. doi:10.1023/A:1006746205180.
- ↑ Miller, Stanley L. (1953). "在可能存在的原始地球條件下產生氨基酸" (PDF). 科學. 117 (3046): 528. doi:10.1126/science.117.3046.528. PMID 13056598.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Miller, Stanley L. (1959). "原始地球上的有機化合物合成". 科學. 130 (3370): 245. doi:10.1126/science.130.3370.245. PMID 13668555.
{{cite journal}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助); 未知引數|month=被忽略 (幫助) 米勒指出,他在 1953 年的實驗中進行了“更完整的產物分析”,列出了額外的結果。 - ↑ A. Lazcano, J. L. Bada (2004). "1953 年斯坦利·L·米勒實驗:50 年的前生物有機化學". 生命起源和生物圈的演化. 33 (3): 235–242. doi:10.1023/A:1024807125069. PMID 14515862.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ "外生物學:斯坦利·L·米勒的訪談". Accessexcellence.org. 檢索於 2009-08-20.
- ↑ Dreifus, Claudia (2010-05-17). "與傑弗裡·L·巴達的對話:一位海洋化學家研究生命起源". nytimes.com. http://www.nytimes.com/2010/05/18/science/18conv.html.
- ↑ http://books.nap.edu/openbook.php?record_id=11860&page=85 探索太陽系中的有機環境 (2007)
- ↑ Oró J, Kimball AP (1961). “在可能的原始地球條件下嘌呤的合成。I. 氫氰酸合成腺嘌呤”. 生物化學與生物物理學檔案. 94: 217–27. doi:10.1016/0003-9861(61)90033-9. PMID 13731263.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Oró J, Kamat SS (1961). “在可能的原始地球條件下由氫氰酸合成氨基酸”. 自然. 190: 442–3. doi:10.1038/190442a0. PMID 13731262.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Oró J (1967). Fox SW (ed.). 原始生物系統及其分子基質的起源. 紐約學術出版社. p. 137.
- ↑ Wilde, Kenneth A. (1953). “在高頻電弧中 CO2, 2O 混合物中發生的反應”. 科學. 118 (3054): 43–44. doi:10.1126/science.118.3054.43-a. PMID 13076175. 檢索於 2008-07-09.
{{cite journal}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助); 未知引數|month=被忽略 (幫助) - ↑ 從一氧化碳和水中透過紫外線光解合成有機化合物
- ↑ Fox, Douglas (2007-03-28). “原始湯”回來了:科學家重複了進化中最著名的實驗. 科學美國人 (科學美國人公司). http://www.sciam.com/article.cfm?id=primordial-soup-urey-miller-evolution-experiment-repeated. 檢索於 2008-07-09.
- ↑ 原核生物
- ↑ 原核生物
- ↑ 真核生物
- ↑ 真核生物
- ↑ 真核生物
- ↑ 植物細胞
- ↑ 內共生學說
- ↑ 內共生學說
- ↑ 細胞器
- ↑ Fahey RC, Newton GL, Arrack B, Overdank-Bogart T, Baley S (1984). “溶血性阿米巴:一種沒有谷胱甘肽代謝的真核生物”. 科學. 224 (4644): 70–72. doi:10.1126/science.6322306. PMID 6322306.
{{cite journal}}: CS1 maint: 多個名字:作者列表 (連結) - ↑ Badano, Jose L. (2006). “纖毛病:一類新興的人類遺傳疾病”. 基因組學和人類遺傳學年度回顧. 7: 125–148. doi:10.1146/annurev.genom.7.080505.115610. PMID 16722803. 檢索於 2008-06-15.
{{cite journal}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助); 未知引數|month=被忽略 (幫助) - ↑ Tsai Y,Sawaya MR,Cannon GC,Cai F,Williams EB,Heinhorst S,Kerfeld CA,Yeates TO(2007)。"CsoS1A 和嗜鹽硫桿菌 carboxysome 蛋白外殼的結構分析" (免費全文)。PLoS biology。5(6):e144。doi:10.1371/journal.pbio.0050144。PMC 1872035。PMID 17518518.
{{cite journal}}: 未知引數|month=忽略(幫助)CS1 maint: 多個名稱:作者列表 (連結) - ↑ Ryter A(1988)。“新的冷凍方法對更好地瞭解細菌解剖結構的貢獻”。Ann. Inst. Pasteur Microbiol。139(1):33–44。doi:10.1016/0769-2609(88)90095-6。PMID 3289587.
- ↑ 細胞器
- ↑ Kerfeld CA,Sawaya MR,Tanaka S,Nguyen CV,Phillips M,Beeby M,Yeates TO(2005)。“形成原始細菌細胞器的蛋白質結構”。Science。309(5736):936–8。doi:10.1126/science.1113397。PMID 16081736.
{{cite journal}}: 未知引數|month=忽略(幫助)CS1 maint: 多個名稱:作者列表 (連結) - ↑ Komeili A,Li Z,Newman DK,Jensen GJ(2006)。“磁小體是由類似肌動蛋白的蛋白 MamK 組織的細胞膜內陷”。Science。311(5758):242–5。doi:10.1126/science.1123231。PMID 16373532.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ Scheffel A,Gruska M,Faivre D,Linaroudis A,Plitzko JM,Schüler D(2006)。“一種酸性蛋白將磁小體沿磁性細菌的絲狀結構排列”。Nature。440(7080):110–4。doi:10.1038/nature04382。PMID 16299495.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ Fuerst JA(2005)。“浮游菌中的細胞內區室化”。Annu. Rev. Microbiol。59:299–328。doi:10.1146/annurev.micro.59.030804.121258。PMID 15910279.
- ↑ Saccharomyces cerevisiae




































