生物化學原理/細胞膜和受體

| 此頁面已匯入,需要進行去維基化. 書籍應該謹慎使用維基連結,並且只用於引用理解內容至關重要的技術或深奧術語。大多數,如果不是全部,維基連結都應該簡單地刪除。請在頁面去維基化後刪除 {{dewikify}}。 |
細胞膜是一種生物膜,將所有細胞的內部與外部環境隔開。細胞膜對離子和小分子具有選擇性滲透性,控制物質進出細胞的運動。它由嵌入蛋白質的磷脂雙層組成。細胞膜參與各種細胞過程,如細胞粘附、離子傳導和細胞訊號傳導,並作為細胞外糖萼和細胞壁以及細胞內細胞骨架的附著表面。
細胞膜包含多種生物分子,特別是脂類和蛋白質。物質透過多種機制被整合到膜中或從膜中刪除。
- 細胞內囊泡與膜融合(胞吐作用)不僅排出囊泡的內容物,而且將囊泡膜的成分整合到細胞膜中。膜可以在細胞外物質周圍形成小泡,這些小泡會收縮並變成囊泡(內吞作用)。
- 如果膜與由膜物質製成的管狀結構連續,則可以將管狀結構中的物質連續地吸入膜中。
- 雖然膜成分在水相中的濃度很低(穩定的膜成分在水中的溶解度很低),但脂類和水相之間存在分子交換。
細胞膜由三類兩親性脂類組成:磷脂、糖脂和膽固醇。每種脂類的含量取決於細胞型別,但在大多數情況下,磷脂含量最豐富。在紅細胞研究中,30% 的質膜是脂類。
磷脂和糖脂中的脂肪鏈通常含有偶數個碳原子,通常在 16 到 20 之間。16 碳和 18 碳脂肪酸最常見。脂肪酸可以是飽和的或不飽和的,雙鍵的構型幾乎總是順式。脂肪酸鏈的長度和不飽和度對膜流動性有很大影響[1],因為不飽和脂類會產生一個扭結,阻止脂肪酸緊密堆積在一起,從而降低膜的熔化溫度(提高流動性)。某些生物體透過改變脂類成分來調節其細胞膜流動性的能力稱為穩態粘度適應。
整個膜透過疏水尾部的非共價相互作用保持在一起,但結構非常流動,沒有固定在適當的位置。在生理條件下,細胞膜中的磷脂分子處於液晶態。這意味著脂類分子可以自由擴散並沿其存在的層快速橫向擴散。然而,磷脂分子在雙層細胞內和細胞外小葉之間的交換是一個非常緩慢的過程。脂筏和caveolae是細胞膜中富含膽固醇的微域的例子。
在動物細胞中,膽固醇通常以不同程度分散在整個細胞膜中,存在於膜脂類疏水尾部之間的不規則空間中,在那裡它賦予膜強化和增強作用。
脂質囊泡或脂質體是脂質雙層封閉的圓形口袋。這些結構在實驗室中用於研究化學物質對細胞的影響,方法是將這些化學物質直接遞送到細胞,以及更深入地瞭解細胞膜的滲透性。脂質囊泡和脂質體是透過首先將脂類懸浮在水溶液中,然後透過超聲處理攪拌混合物而形成的,從而形成均勻的圓形囊泡。透過測量從囊泡內部到周圍溶液的流出速率,研究人員可以更好地瞭解膜滲透性。囊泡可以透過在存在所需分子或離子的溶液中形成囊泡來形成,囊泡內部包含分子和離子。蛋白質也可以透過在存在去垢劑的情況下溶解所需的蛋白質並將它們連線到形成脂質體所用的磷脂中來嵌入膜中。這些為研究人員提供了一種研究各種膜蛋白功能的工具。
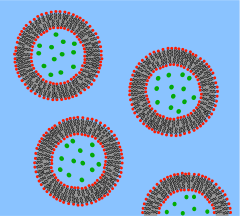
囊泡是脂質雙層捲成球形外殼,包裹少量水,並將它與囊泡外部的水隔開。由於這種與細胞膜的根本相似性,囊泡已被廣泛用於研究脂質雙層的特性。囊泡被如此頻繁地使用的原因還在於它們比較容易製備。如果將脫水的脂類樣品暴露在水中,它會自發形成囊泡。[2] 這些最初的囊泡通常是多層(多壁)的,並且尺寸範圍很廣,從幾十奈米到幾微米。[3] 需要諸如超聲處理或透過膜擠壓之類的方法來將這些最初的囊泡分解成更小的、單壁囊泡,這些囊泡具有被稱為小單層囊泡 (SUVs) 的均勻直徑。[4] 或者,與其合成囊泡,不如從細胞培養物或組織樣本中簡單地分離它們。[5] 囊泡用於在細胞內以及進出細胞運輸脂類、蛋白質和許多其他分子。這些天然分離的囊泡由不同脂類和蛋白質的複雜混合物組成,因此,儘管它們為研究特定的生物現象提供了更大的真實性,但簡單的合成囊泡更適合研究基本的脂類特性。
由於人工 SUV 可以大量生產,因此它們適用於批次材料研究,例如 X 射線衍射以確定晶格間距[6] 和差示掃描量熱法以確定相變。[7] 雙極化干涉儀 可以測量單層和多層結構,以及在無標記分析格式中插入和破壞囊泡[8]。囊泡也可以用熒光染料標記,以允許靈敏的基於 FRET 的融合分析。[9] 儘管進行了這種熒游標記,但由於 SUV 太小,因此通常很難對 SUV 進行詳細成像。為了解決這個問題,研究人員開發了巨型單層囊泡 (GUV)。GUV 足夠大(幾十微米),可以用傳統的熒光顯微鏡進行研究。由於這個原因,許多關於人工脂質系統中脂筏的研究都是用 GUV 進行的。[10] 與支撐雙層相比,GUV 提供了更“自然”的環境,因為沒有附近的固體表面會導致缺陷或使蛋白質變性。然而,GUV 相對脆弱,製作起來耗時,而且與 SUV 相比,產量有限。
為了規避這些問題,人們報道了一種針對 GUV 的微流體組裝線方法。[11]
碳水化合物
[edit | edit source]質膜還含有碳水化合物,主要是糖蛋白,但也有一些糖脂(腦苷脂和神經節苷脂)。在大多數情況下,細胞內的膜不會發生糖基化;相反,糖基化通常發生在質膜的細胞外表面。
糖萼是所有細胞的重要特徵,尤其是具有微絨毛的上皮細胞。最近的資料表明糖萼參與細胞粘附、淋巴細胞歸巢以及許多其他功能。
倒數第二個糖是半乳糖,末端糖是唾液酸,因為糖骨架在高爾基體中被修飾。唾液酸帶負電荷,為帶電粒子提供外部屏障。
蛋白質
[edit | edit source]膜內的蛋白質是整體膜功能的關鍵。這些蛋白質主要在膜之間運輸化學物質和資訊。每種膜的蛋白質含量都不同。蛋白質可以是外周蛋白或整合蛋白的形式。
| 型別 | 描述 | 示例 |
| 整合蛋白 或 *跨膜蛋白* |
跨越膜並具有親水性胞質結構域(與內部分子相互作用)、疏水性跨膜結構域(將蛋白錨定在細胞膜內)和親水性細胞外結構域(與外部分子相互作用)。疏水結構域由一個、多個或組合的 α螺旋 和 β摺疊 蛋白質 基序 組成。 | 離子通道、質子泵、G蛋白偶聯受體 |
| 脂質錨定蛋白 | 共價結合到一個或多個脂質分子上;疏水性插入細胞膜並錨定蛋白質。蛋白質本身不與膜接觸。 | G 蛋白 |
| 外周蛋白 | 附著在整合膜蛋白上,或與脂質雙層的周邊區域相關聯。這些蛋白質往往與生物膜只有短暫的相互作用,並且,一旦反應後,分子就會解離以在細胞質中繼續發揮作用。 | 一些酶、一些激素 |
細胞膜是大量蛋白質的宿主,這些蛋白質負責其各種活動。不同物種之間的蛋白質含量不同,並且根據功能而不同,但是細胞膜中典型的蛋白質含量為 50%。[1] 這些蛋白質無疑對細胞很重要:大約三分之一的 基因 在 酵母 中專門編碼這些蛋白質,而在多細胞生物中,這個數字甚至更高。
細胞膜暴露在外部環境中,是細胞間通訊的重要場所。因此,膜表面存在大量蛋白質受體和識別蛋白,如 抗原。膜蛋白的功能還可以包括細胞間接觸、表面識別、細胞骨架接觸、訊號傳導、酶活性或跨膜運輸物質。
大多數膜蛋白必須以某種方式插入膜中。為了實現這一點,氨基酸的 N 端“訊號序列”將蛋白質引導至內質網,內質網將蛋白質插入脂質雙層中。插入後,蛋白質在囊泡中被運輸到其最終目的地,囊泡與靶膜融合。

膜以淺棕色表示。
跨膜蛋白 (TP)
[edit | edit source]跨膜蛋白 (TP) 是一種從膜的一側穿過膜到另一側的蛋白質。許多 TP 充當“閘門”或“裝貨碼頭”,以拒絕或允許特定物質跨越生物膜運輸,進入細胞,或像廢物副產品一樣從細胞中排出。作為對某些分子形狀的響應,這些“貨物處理”TP 可能具有特殊的摺疊或彎曲方式,這些方式將透過生物膜移動物質。跨膜蛋白是一種跨越整個生物膜的多拓撲蛋白。跨膜蛋白在水中聚集和沉澱。它們需要去垢劑或非極性溶劑進行提取,儘管其中一些(β 桶)也可以使用變性劑提取。
所有跨膜蛋白都是整合膜蛋白,但並非所有 IMP 都是跨膜蛋白。
跨膜蛋白主要有兩種型別:α 螺旋。這些蛋白質存在於細菌細胞的內膜或真核生物的質膜中,有時也存在於外膜中。這是跨膜蛋白的主要類別。據估計,人類所有蛋白質中有 27% 是 α 螺旋膜蛋白。β 桶。到目前為止,這些蛋白質僅在革蘭氏陰性菌的外膜、革蘭氏陽性菌的細胞壁以及線粒體和葉綠體的外膜中發現。所有 β 桶跨膜蛋白都具有最簡單的上下拓撲結構,這可能反映了它們的共同進化起源和類似的摺疊機制。另一種分類是指 N 端和 C 端結構域的位置。I、II 和 III 型是單次跨膜分子,而 IV 型是多次跨膜分子。I 型跨膜蛋白透過停止轉移錨定序列錨定在脂質膜上,並且在合成過程中將其 N 端結構域靶向 ER 腔(如果成熟形式位於質膜上,則靶向細胞外空間)。II 和 III 型透過訊號錨定序列錨定,II 型將其 C 端結構域靶向 ER 腔,而 III 型將其 N 端結構域靶向 ER 腔。IV 型細分為 IV-A,其 N 端結構域靶向胞質溶膠,IV-B,其 N 端結構域靶向腔。四種類型劃分的意義在易位和與 ER 結合的翻譯時尤其明顯,此時蛋白質必須穿過 ER 膜,其方向取決於蛋白質型別。
整合膜蛋白 (IMP)
[edit | edit source]整合膜蛋白 或穿透 脂質雙層 的外圍區域。例如,許多離子通道和 跨膜受體 的調節蛋白亞基可以定義為外周膜蛋白。與整合膜蛋白不同,外周膜蛋白往往在 蛋白質純化 程式中提取的所有蛋白質的水溶性組分或部分中聚集。具有 GPI 錨的蛋白質是此規則的例外,並且可以具有與 整合膜蛋白 相似的純化特性。整合膜蛋白 (IMP) 是永久附著在生物膜上的蛋白質分子(或蛋白質組裝體)。穿過膜的蛋白質被“環狀”脂質包圍,這些脂質被定義為直接與膜蛋白接觸的脂質。此類蛋白質只能使用去垢劑、非極性溶劑或有時使用變性劑從生物膜中分離出來。IMP 構成生物體基因組中編碼的蛋白質的很大一部分。所有跨膜蛋白都是 IMP,但並非所有 IMP 都是跨膜蛋白。
外周膜蛋白是指僅暫時附著在與其相關的生物膜上的蛋白質。這些分子附著在跨膜蛋白上,或穿透脂雙層的周邊區域。例如,許多離子通道和跨膜受體的調節蛋白亞基可以定義為外周膜蛋白。與跨膜蛋白不同,外周膜蛋白傾向於在蛋白質純化過程中提取的所有蛋白質的水溶性組分或級分中收集。具有 GPI 錨的蛋白質是這一規則的例外,並且可以具有與跨膜蛋白類似的純化特性。蛋白質與生物膜的可逆結合已證明透過多種機制調節細胞訊號傳導和許多其他重要的細胞事件。例如,許多酶與生物膜之間的緊密結合可能會使它們與它們的脂質底物(s)緊密接近。膜結合也可能促進許多蛋白質結構域內的重排、解離或構象變化,從而導致其生物活性的啟用。此外,許多蛋白質的定位被定位於其駐留膜的內表面或外表面或小葉。這透過提高任何適當的蛋白質-蛋白質相互作用的機率來促進多蛋白複合物的組裝。
外周膜蛋白可能與其他蛋白質或直接與脂雙層相互作用。在後一種情況下,它們被稱為兩親蛋白。某些蛋白質,如 G 蛋白和某些蛋白激酶,同時與跨膜蛋白和脂雙層相互作用。某些多肽激素、抗菌肽和神經毒素在定位和與它們的細胞表面受體靶點相互作用之前會在膜表面積累,這些靶點本身可能就是外周膜蛋白。構成細胞表面膜的磷脂雙層由一個疏水性內芯區域夾在兩個親水性區域之間,一個在細胞膜的內表面,另一個在細胞膜的外表面(有關細胞膜的更詳細結構描述,請參閱脂雙層文章)。模型磷脂雙層的內表面或介面區域已被證明具有大約 8 到 10 Å 的厚度,儘管這在包含大量神經節苷脂或脂多糖的生物膜中可能更寬。透過小角 X 射線散射 (SAXS) 估計,典型生物膜的疏水性內芯區域可能具有大約 27 到 32 Å 的厚度。疏水性內芯與親水性介面區域之間的邊界區域非常窄,大約為 3 Å(有關其組成化學基團的描述,請參閱脂雙層文章)。從疏水性核心區域向外移動並進入介面親水性區域,水的有效濃度在這個邊界層上迅速變化,從幾乎為零到大約 2M 的濃度。[8][9] 磷脂雙層內的磷酸基團被完全水化或飽和水,並位於疏水性核心區域邊界之外約 5 Å 處(見圖)。某些水溶性蛋白質與脂雙層不可逆地結合,並且可以形成跨膜 α-螺旋或 β-桶通道。這種轉化發生在孔形成毒素中,例如大腸桿菌素 A、α-溶血素等。它們也可能發生在 [[Bcl-2 相關 X 蛋白|BcL-2 樣蛋白]]、某些兩親性抗菌肽以及某些膜聯蛋白中。這些蛋白質通常被描述為外周蛋白質,因為它們的構象狀態之一是水溶性的或僅鬆散地與膜結合。

在生物化學中,受體是一種蛋白質分子,嵌入細胞的質膜或細胞質中,一種或多種特定型別的訊號分子可以附著到該蛋白質分子上。與受體結合(附著)的分子被稱為配體,可以是肽(短蛋白質)或其他小分子,例如神經遞質、激素、藥物或毒素。每種受體只能結合某些配體形狀。每個細胞通常具有許多不同種類的受體。簡單地說,受體充當一個鑰匙孔,當插入適當的配體時,會開啟神經通路。配體結合穩定受體的一種特定構象(受體蛋白的三維形狀,沒有序列變化)。這通常與獲得或失去蛋白質活性有關,通常導致某種細胞反應。然而,某些配體(例如拮抗劑)僅阻斷受體,而不會誘導任何反應。配體誘導的受體變化導致細胞變化,這些變化構成配體的生物活性。人體的許多功能都由這些受體對諸如此類特定分子做出獨特反應來調節。
受體的形狀和作用透過 X 射線晶體學、雙偏振干涉測量法、計算機建模和結構-功能研究進行研究,這些研究促進了對受體結合位點藥物作用的理解。結構活性關係將誘導的構象變化與生物分子活性相關聯,並使用迴圈二色性和雙偏振干涉測量法等動態技術進行研究。
根據其功能和配體,可以識別幾種型別的受體:一些受體蛋白是外周膜蛋白。許多激素和神經遞質受體是跨膜蛋白:跨膜受體嵌入細胞膜的磷脂雙層中,允許訊號轉導途徑在響應結合分子或配體的啟用而啟用。代謝型受體與 G 蛋白偶聯,並透過控制離子通道的酶間接影響細胞。離子型受體(也稱為配體門控離子通道)包含一箇中央孔,該孔響應配體的結合而開啟。另一類主要的受體是胞內蛋白,例如類固醇和胞內肽激素受體。這些受體通常可以進入細胞核,並響應配體的啟用來調節基因表達。膜受體透過使用溶劑、去垢劑和/或親和純化的複雜提取程式從細胞膜中分離出來。
代謝型受體是真核細胞表面或囊泡中膜受體的一種亞型。在神經系統中,根據其結構和功能特徵,神經遞質受體可以分為兩大類:代謝型受體和離子型受體。與後者相反,代謝型受體不形成離子通道孔;相反,它們透過訊號轉導機制(通常是 G 蛋白)間接與細胞質膜上的離子通道連線。因此,它們是 G 蛋白偶聯受體的一種型別。其他是酪氨酸激酶或鳥苷酸環化酶受體。這兩種受體型別的共同點是它們被特定神經遞質啟用。當離子型受體被啟用時,它會開啟一個通道,允許諸如 Na+、K+ 或 Cl- 等離子流過。相反,當代謝型受體被啟用時,會觸發一系列細胞內事件,這些事件也會導致離子通道開啟,但必須涉及一系列第二信使化學物質。
配體門控離子通道 (LGICs) 是一種離子型受體或通道連線受體。它們是一組跨膜離子通道,響應化學信使(即配體,如神經遞質)的結合而開啟或關閉。內源性配體在 LGICs 蛋白複合物上的結合位點通常位於蛋白質的不同部分(變構結合位點),而不是離子傳導孔所在的位點。配體結合與離子通道開啟或關閉之間直接聯絡是配體門控離子通道的特徵,這與代謝型受體的間接功能形成對比,代謝型受體使用第二信使。LGICs 也不同於電壓門控離子通道(根據膜電位開啟和關閉)和牽張啟用離子通道(根據細胞膜的機械變形開啟和關閉)。
G蛋白偶聯受體(GPCR),也稱為七跨膜結構域受體、7TM受體、七螺旋受體、蛇形受體和G蛋白連線受體(GPLR),是一個大型跨膜受體蛋白家族,它們感知細胞外的分子並激活細胞內的訊號轉導途徑,最終導致細胞反應。G蛋白偶聯受體僅存在於真核生物中,包括酵母、領鞭毛蟲和動物。與這些受體結合並激活它們的配體包括光敏化合物、氣味、資訊素、激素和神經遞質,大小從小的分子到肽再到大的蛋白質不等。G蛋白偶聯受體參與許多疾病,也是約30%現代藥物的靶點。
GPCR超家族的確切大小尚不清楚,但從基因組序列分析中預測出近800個不同的基因(或約佔整個蛋白質編碼基因組的4%)。儘管已經提出了許多分類方案,但超家族通常分為三個主要類別(A、B和C),類別之間沒有可檢測到的共享序列同源性。迄今為止,最大的類別是A類,佔GPCR基因的近85%。在A類GPCR中,預計超過一半編碼嗅覺受體,而其餘的受體則由已知的內源性化合物配體化,或被歸類為孤兒受體。儘管類別之間缺乏序列同源性,但所有GPCR都共享一個共同的結構和訊號轉導機制。

總的來說,GPCR可以根據序列同源性和功能相似性分為6類
A類(或1類)(視紫紅質樣)
B類(或2類)(促胰液素受體家族)
C類(或3類)(代謝型穀氨酸/資訊素)
D類(或4類)(真菌交配資訊素受體)
E類(或5類)(環狀腺苷酸受體)
F類(或6類)(Frizzled/Smoothened)
非常大的視紫紅質A組被進一步細分為19個亞組(A1-A19)。最近,提出了一種名為GRAFS(穀氨酸、視紫紅質、粘附、Frizzled/Taste2、促胰液素)的替代分類系統。人類基因組編碼數千個G蛋白偶聯受體,其中約350個檢測激素、生長因子和其他內源性配體。人類基因組中發現的約150個GPCR功能未知。一些網路伺服器和生物資訊學預測方法已被用於根據GPCR的氨基酸序列單獨預測其分類,透過偽氨基酸組成方法。
GPCR的結構
[edit | edit source]在結構上,GPCR的特徵是細胞外N端,之後是七個跨膜(7-TM)α-螺旋(TM-1到TM-7),由三個細胞內(IL-1到IL-3)和三個細胞外環(EL-1到EL-3)連線,最後是細胞內C端。GPCR自身排列成類似桶狀的三級結構,七個跨膜螺旋在質膜內形成一個腔,該腔充當配體結合域,通常被EL-2覆蓋。然而,配體也可能結合在其他地方,例如體積較大的配體(如蛋白質或大肽)與細胞外環相互作用,或者,如C類代謝型穀氨酸受體(mGluR)所示,與N端尾部相互作用。C類GPCR以其大的N端尾部為特徵,該尾部也包含配體結合域。穀氨酸與mGluR結合後,N端尾部會發生構象變化,導致其與細胞外環和TM域的殘基相互作用。三種類型的激動劑誘導啟用的最終效應是TM螺旋的相對方向發生變化(類似於扭曲運動),導致更寬的細胞內表面和“揭示”對訊號轉導功能至關重要的細胞內螺旋和TM域的殘基(即,G蛋白偶聯)。逆向激動劑和拮抗劑也可能結合到許多不同的位點,但最終的效應必須是防止這種TM螺旋重新定向。GPCR的N端和C端尾部的結構也可能在配體結合之外發揮重要作用。特別是,C端通常包含絲氨酸(Ser)或蘇氨酸(Thr)殘基,當磷酸化時,會增加細胞內表面與稱為β-arrestin(β-arr)的支架蛋白的結合親和力。一旦結合,β-arrestin既可以空間阻止G蛋白偶聯,也可以招募其他蛋白質,導致形成參與細胞外訊號調節激酶(ERK)途徑啟用或受體內吞(內化)的訊號複合物。由於這些Ser和Thr殘基的磷酸化通常是GPCR啟用的結果,因此β-arr介導的G蛋白解偶聯和GPCR內化是脫敏的重要機制。GPCR中的一種最終的共同結構主題是C端尾部或細胞內環的一個或多個位點的棕櫚醯化。棕櫚醯化是透過新增疏水醯基來對半胱氨酸(Cys)殘基進行的共價修飾,它具有將受體靶向質膜中稱為脂筏的富含膽固醇和鞘磷脂的微域的作用。由於GPCR的許多下游轉導器和效應分子(包括參與負反饋途徑的那些分子)也被靶向到脂筏,因此這有利於促進快速的受體訊號傳導。GPCR響應由各種激動劑介導的細胞外訊號,從蛋白質到生物胺再到質子,但所有這些訊號都是透過G蛋白偶聯機制進行轉導的。這得益於主要由IL-2和IL-3以及相關的TM螺旋的相鄰殘基組成的鳥嘌呤核苷酸交換因子(GEF)結構域。
受體酪氨酸激酶 (RTK)
[edit | edit source]受體酪氨酸激酶 (RTK) 是許多多肽生長因子、細胞因子和激素的高親和力細胞表面受體。在人類基因組中鑑定的90個獨特的酪氨酸激酶基因中,58個編碼受體酪氨酸激酶蛋白。受體酪氨酸激酶已被證明不僅是正常細胞過程的關鍵調節因子,而且在許多型別的癌症的發生和發展中也起著至關重要的作用。
大多數RTK是單亞基受體,但有些以多聚體複合物的形式存在,例如胰島素受體,在沒有激素的情況下形成二硫鍵連線的二聚體;此外,配體與細胞外域的結合會誘導受體二聚體的形成。每個單體都有一個由25-38個氨基酸組成的單一疏水性跨膜結構域、一個細胞外N端區域和一個細胞內C端區域。細胞外N端區域表現出多種保守元件,包括免疫球蛋白 (Ig) 樣或表皮生長因子 (EGF) 樣結構域、纖連蛋白 III 型重複序列或富含半胱氨酸的區域,這些區域是每種RTK亞家族的特徵;這些結構域主要包含配體結合位點,該位點結合細胞外配體,例如特定的生長因子或激素。細胞內C端區域顯示出最高水平的保守性,幷包含負責這些受體激酶活性的催化結構域,該結構域催化受體自身磷酸化和RTK底物的酪氨酸磷酸化。
RTK家族
[edit | edit source]表皮生長因子受體家族
ErbB蛋白家族或表皮生長因子受體 (EGFR) 家族是一個由四個結構相關的受體酪氨酸激酶組成的家族。人類中ErbB訊號傳導不足與神經退行性疾病的發生有關,如多發性硬化症和阿爾茨海默病。在小鼠中,ErbB家族中任何成員的訊號傳導缺失會導致胚胎致死,並伴有肺、皮膚、心臟和大腦等器官的缺陷。ErbB訊號傳導過度與多種型別的實體瘤的發生有關。ErbB-1 和 ErbB-2 在許多人類癌症中被發現,它們過度的訊號傳導可能是這些腫瘤發生和惡性增殖的關鍵因素。
成纖維細胞生長因子受體 (FGFR) 家族
成纖維細胞生長因子包括 23 個成員,是最大的生長因子配體家族。四個成纖維細胞生長因子受體 (FGFR) 基因的自然選擇性剪接導致產生超過 48 種不同的 FGFR 同種型。這些同種型在配體結合特性和激酶結構域方面有所不同;但是,它們都共享一個由三個免疫球蛋白 (Ig) 樣結構域 (D1-D3) 組成的共同細胞外區域,因此屬於免疫球蛋白超家族。與 FGF 的相互作用發生在 FGFR 結構域 D2 和 D3 處。每個受體可以被幾種 FGF 啟用。在許多情況下,FGF 本身也可以啟用不止一個受體,但 FGF-7 除外,它只能啟用 FGFR2b。一個第五個 FGFR 蛋白 FGFR5 的基因也被鑑定出來。與 FGFR 1-4 相比,它缺乏細胞質酪氨酸激酶結構域,並且一個同種型 FGFR5γ 僅包含細胞外結構域 D1 和 D2。
血管內皮生長因子受體 (VEGFR) 家族
血管內皮生長因子 (VEGF) 是血管內皮細胞增殖和血管通透性的主要誘導劑之一。兩種 RTK 在細胞表面結合 VEGF,即 VEGFR-1 (Flt-1) 和 VEGFR-2 (KDR/Flk-1)。VEGF 受體有一個由七個 Ig 樣結構域組成的細胞外部分,因此,與 FGFR 一樣,屬於免疫球蛋白超家族。它們還擁有一個單一的跨膜跨越區域和一個包含分裂酪氨酸激酶結構域的細胞內部分。VEGF-A 與 VEGFR-1 (Flt-1) 和 VEGFR-2 (KDR/Flk-1) 結合。VEGFR-2 似乎介導了 VEGF 的幾乎所有已知細胞反應。VEGFR-1 的功能尚不清楚,儘管它被認為可以調節 VEGFR-2 的訊號傳導。VEGFR-1 的另一個功能可能是作為假受體/誘餌受體,將 VEGF 從 VEGFR-2 結合中隔離出來(這似乎在胚胎血管生成過程中尤其重要)。第三個受體已被發現 (VEGFR-3);但是,VEGF-A 不是該受體的配體。VEGFR-3 介導響應於 VEGF-C 和 VEGF-D 的淋巴管生成。
RET 受體家族
RET 基因的自然選擇性剪接導致產生 3 種不同的 RET 蛋白異構體。RET51、RET43 和 RET9 分別在其 C 末端尾部含有 51、43 和 9 個氨基酸。異構體 RET51 和 RET9 的生物學作用在體內得到了最深入的研究,因為它們是 RET 存在的最常見異構體。RET 是神經生長因子 (GDNF) 家族的細胞外訊號分子或配體 (GFL) 的受體。為了啟用 RET,首先 GFL 必須與一個糖基磷脂醯肌醇 (GPI) 錨定的共受體形成複合物。共受體本身被歸類為 GDNF 受體-α (GFRα) 蛋白家族的成員。GFRα 家族的不同成員 (GFRα1-GFRα4) 對特定的 GFL 表現出特異性結合活性。在 GFL-GFRα 複合物形成後,該複合物然後將兩個 RET 分子聚集在一起,觸發每個 RET 分子中酪氨酸激酶結構域內特定酪氨酸殘基的順式自磷酸化。這些酪氨酸的磷酸化隨後啟動細胞內訊號轉導過程。
Eph 受體家族
Ephrin 和 Eph 受體是 RTK 最大的亞家族。
- ↑ a b Jesse Gray, Shana Groeschler, Tony Le, Zara Gonzalez (2002). "膜結構" (SWF). Davidson College. Retrieved 2007-01-11.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ↑ A D Bangham and R W Horne."磷脂的負染色及其表面活性劑結構修飾在電子顯微鏡下的觀察."《分子生物學雜誌》. 8. (1964) 660-668.
- ↑ D D Lasic."囊泡形成的機制."《生物化學雜誌》. 256. (1988) 1-11.
- ↑ F Szoka and D Papahadjopoulos."脂質囊泡 (脂質體) 的比較性質和製備方法."《生物物理學和生物工程年度回顧》. 9. (1980) 467-508.
- ↑ W S Trimble, D M Cowan, and R H Scheller."VAMP-1:一種突觸囊泡相關整合膜蛋白."《美國國家科學院院刊》. 85. (1988) 4538-4542.
- ↑ D Papahadjapoulos and N Miller."磷脂模型膜 I. 水合液晶的結構特徵."《生物化學與生物物理學報》. 135. (1967) 624-638.
- ↑ H Trauble and D H Haynes."脂質雙層薄片層狀結構在晶體-液晶相變時的體積變化."《化學物理學脂質》. 7. (1971) 324-335.
- ↑ J Popplewell, M Swann, N Freeman, C McDonnell and R Ford, "定量研究蜂毒肽對脂質體的影響."《生物化學與生物物理學報》(2007)1768 13-20
- ↑ L Guohua and R C Macdonald."脂質雙層囊泡融合:高速顯微熒光光譜捕獲的中間體."《生物物理學雜誌》. 85. (2003) 1585-1599.
- ↑ C Dietrich, L A Bagatolli, Z N Volovyk, N L Thompson, et al."在模型膜中重建的脂筏."《生物物理學雜誌》. 80. (2001) 1417-1428.
- ↑ Matosevic, S.; Paegel, B. 美國化學學會雜誌 文章 ASAP DO1: 10.1021/ja109137s
