生物化學原理/脂類
在生物化學中,脂肪酸是具有長而不分支的脂肪族尾部(鏈)的羧酸,該尾部要麼是飽和的,要麼是不飽和的。大多數天然存在的脂肪酸具有偶數個碳原子的鏈,從 4 到 28 不等。脂肪酸通常來自甘油三酯或磷脂。當它們不連線到其他分子時,它們被稱為“遊離”脂肪酸。脂肪酸是重要的燃料來源,因為它們的代謝會產生大量的 ATP。許多細胞型別可以使用葡萄糖或脂肪酸來實現這一點。特別是心臟和骨骼肌更喜歡脂肪酸。大腦不能使用脂肪酸作為燃料來源;它依賴於葡萄糖或酮體。

脂肪酸使用幾種不同的命名系統。下表描述了最常見的系統。
| 系統 | 示例 | 解釋 |
|---|---|---|
| 普通命名法 | 棕櫚油酸 | 普通名稱(或俗名)是非系統的歷史名稱,它們是文獻中最常用的命名系統。最常見的脂肪酸除了它們的系統名稱(見下文)之外還有普通名稱。這些名稱通常不遵循任何模式,但它們簡潔明瞭,並且通常是不含糊的。 |
| 系統命名法 | (9Z)-十八碳烯酸 | 系統名稱(或IUPAC 名稱)來自 1979 年釋出的標準有機化學命名法 IUPAC 規則,[1] 以及 1977 年專門針對脂類釋出的一項建議。[2] 計數從羧酸端開始。雙鍵用順反異構體-/反式-符號或E-/Z-符號標記,在適當的情況下。這種符號通常比普通命名法更冗長,但優點是它在技術上更清晰和描述性。 |
| Δx 命名法 | 順式,順式-Δ9,Δ12 十八碳二烯酸 | 在Δx(或delta-x)命名法中,每個雙鍵用 Δx 表示,其中雙鍵位於從羧酸端計數的第x個碳-碳鍵上。每個雙鍵前都有一個順式-或反式-字首,指示分子繞鍵的構象。例如,亞油酸被命名為“順式-Δ9,順式-Δ12 十八碳二烯酸”。這種命名法具有比系統命名法更簡潔的優勢,但技術上並不比系統命名法更清晰或更具描述性。 |
| n−x 命名法 | n−3 | n−x(n 減 x;也稱為ω−x 或omega-x)命名法既為單個化合物命名,又根據它們在動物體內可能的生物合成特性對其進行分類。雙鍵位於從末端甲基碳(指定為n 或 ω)到羰基碳的第x個碳-碳鍵上。例如,α-亞麻酸被歸類為n−3 或 omega-3 脂肪酸,因此它可能與該型別的其他化合物共享生物合成途徑。ω−x、omega-x 或“omega”符號在流行的營養文獻中很常見,但 IUPAC 已在技術檔案中將其棄用,而採用n−x 符號。[1] 研究最多的脂肪酸生物合成途徑是n−3 和n−6,它們被假設[by whom?] 會增加或減少[citation needed] 炎症。 |
| 脂類編號 | 18:3 18:3, n−6 18:3, 順式,順式,順式-Δ9,Δ12,Δ15 |
脂類編號採用C:D 的形式,其中C 是脂肪酸中碳原子的數量,D 是脂肪酸中雙鍵的數量。這種符號可能很模糊,因為一些不同的脂肪酸可能具有相同的數字。因此,當存在歧義時,這種符號通常與 Δx 或n−x 術語配對。[1] |
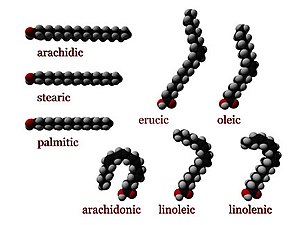
脂肪酸可以根據雙鍵飽和或不飽和。它們在長度上也有所不同。
除了飽和度之外,脂肪酸還有不同的長度,通常分為短鏈、中鏈或長鏈。
- 短鏈脂肪酸 (SCFA) 是脂肪酸,其脂肪族尾部少於 6 個碳。
- 中鏈脂肪酸 (MCFA) 是脂肪酸,其脂肪族尾部為 6-12。[3] 個碳,可以形成中鏈甘油三酯。
- 長鏈脂肪酸 (LCFA) 是脂肪酸,其脂肪族尾部長於 12 個碳。[4]
- 超長鏈脂肪酸 (VLCFA) 是脂肪酸,其脂肪族尾部長於 22 個碳

不飽和脂肪酸類似於飽和脂肪酸,除了鏈中有一個或多個碳原子之間的雙鍵。雙鍵兩側相鄰的兩個碳原子可以處於順式或反式構型。
- 順式
- 順式構型意味著相鄰的氫原子位於雙鍵的同一側。雙鍵的剛性使其構象固定,並且在順式異構體的情況下,會導致鏈彎曲並限制脂肪酸的構象自由度。鏈中順式構型的雙鍵越多,它就越不靈活。當一條鏈在順式構型中具有許多雙鍵時,它在其最易接近的構象中變得相當彎曲。例如,具有一個雙鍵的油酸具有一個“扭結”,而具有兩個雙鍵的亞油酸具有更明顯的彎曲。具有三個雙鍵的亞麻酸有利於鉤狀形狀。這樣做的結果是,在受限的環境中(例如,當脂肪酸是脂雙層中磷脂的一部分,或脂滴中甘油三酯的一部分時),順式鍵會限制脂肪酸緊密堆積的能力,因此會影響膜或脂肪的熔點。
- 反式
- 相反,反式構型意味著接下來的兩個氫原子繫結到雙鍵的相對側。因此,它們不會導致鏈彎曲太多,並且它們的形狀類似於直的飽和脂肪酸。
在大多數天然存在的非飽和脂肪酸中,每個雙鍵之後都有三個n個碳原子,對於某個n,並且都是順式鍵。大多數反式構型 (反式脂肪) 的脂肪酸在自然界中不存在,是人為加工 (例如氫化) 的結果。
各種型別的非飽和脂肪酸之間的幾何差異,以及飽和脂肪酸和非飽和脂肪酸之間的幾何差異,在生物過程和生物結構 (如細胞膜) 的構建中起著重要作用。
| 常用名稱 | 化學結構 | Δx | C:D | n−x |
|---|---|---|---|---|
| 肉豆蔻油酸 | CH3(CH2)3CH=CH(CH2)7COOH | 順式-Δ9 | 14:1 | n−5 |
| 棕櫚油酸 | CH3(CH2)5CH=CH(CH2)7COOH | 順式-Δ9 | 16:1 | n−7 |
| 二十碳四烯酸 | CH3(CH2)8CH=CH(CH2)4COOH | 順式-Δ6 | 16:1 | n−10 |
| 油酸 | CH3(CH2)7CH=CH(CH2)7COOH | 順式-Δ9 | 18:1 | n−9 |
| 亞油酸 | CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH | 順式,順式-Δ9,Δ12 | 18:2 | n−6 |
| α-亞麻酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH | 順式,順式,順式-Δ9,Δ12,Δ15 | 18:3 | n−3 |
| 花生四烯酸 | CH3(CH2)4CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOHNIST | 順式,順式,順式,順式-Δ5Δ8,Δ11,Δ14 | 20:4 | n−6 |
| 二十碳五烯酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)3COOH | 順式,順式,順式,順式,順式-Δ5,Δ8,Δ11,Δ14,Δ17 | 20:5 | n−3 |
| 芥酸 | CH3(CH2)7CH=CH(CH2)11COOH | 順式-Δ13 | 22:1 | n−9 |
| 二十二碳六烯酸 | CH3CH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CHCH2CH=CH(CH2)2COOH | 順式,順式,順式,順式,順式,順式-Δ4,Δ7,Δ10,Δ13,Δ16,Δ19 | 22:6 | n−3 |
必需脂肪酸
[edit | edit source]人體必需但無法從其他底物中合成足夠的量,因此必須從食物中獲取的脂肪酸稱為必需脂肪酸。哺乳動物缺乏在脂肪酸中引入碳9和10以外的雙鍵的能力,因此ω-6亞油酸 (18:2,9,12),簡稱為LA,和ω-3亞麻酸 (18:3,9,12,15),簡稱為ALA,是人類飲食中必需的。在人類中,花生四烯酸 (20:4,5,8,11,14) 可以透過脫飽和和鏈延長從LA合成 (儘管一些肉食動物如貓無法做到這一點,並且需要飲食中的花生四烯酸)。此外,人體可以從ω-3 ALA合成一些長鏈ω-3 PUFA (EPA 和 DHA)。在1930年到1950年之間,花生四烯酸和亞麻酸被稱為“必需”,因為它們或多或少都能滿足給予無脂肪飲食的大鼠的生長需求。進一步的研究表明,人類代謝需要ω-3和ω-6脂肪酸。在一定程度上,任何ω-3和ω-6都能緩解其類別中脂肪酸缺乏症的最嚴重症狀。某些特定的脂肪酸在關鍵的生命階段 (例如哺乳期) 和某些疾病狀態下仍然是必需的。在非科學寫作中,常用用法是指必需脂肪酸包括所有ω-3或-6脂肪酸。共軛脂肪酸,如calendic酸,通常不被認為是必需的。權威來源包括所有家族,無條件。傳統上來說,LC-PUFA不是必需的。參見 (Cunnane 2003) 關於“必需”一詞的當前狀態的討論。由於LC-PUFA有時是必需的,因此它們可能被認為是“條件必需的”,或者對健康的成年人不是必需的。一項2005年的研究表明,ω-6脂肪酸γ-亞麻酸GLA已被證明可以抑制Her2/neu的乳腺癌促進基因。必需脂肪酸不應該與精油混淆,精油指的是濃縮精華[5]。
命名法和術語
[edit | edit source]脂肪酸是具有羧基 (COOH) 基團的直鏈烴。羧酸鹽旁邊的碳原子稱為α,下一個碳原子稱為β,依此類推。由於生物脂肪酸可能具有不同的長度,因此最後一個位置被標記為“ω”,是希臘字母表中的最後一個字母。由於非飽和脂肪酸的生理特性主要取決於第一個不飽和位置相對於末端位置,而不是相對於羧酸鹽的位置,因此該位置由 (ω 減去 n) 表示。例如,ω-3 脂肪酸 (ω-3) 表示第一個雙鍵存在於碳鏈的末端 CH3 (ω) 的第三個碳-碳鍵上。碳原子數和雙鍵數也列出。ω-3 18:4 (硬脂油酸) 或 18:4 ω-3 或 18:4 n−3 表示一條具有 4 個雙鍵的 18 個碳原子的鏈,並且第一個雙鍵位於 CH3 末端處的第三個位置[citation needed]。雙鍵為順式,除非另有說明,否則它們之間由一個亞甲基 (CH2) 基團隔開。因此,在遊離脂肪酸形式中,硬脂油酸的化學結構為[6]: 
例子
[edit | edit source]必需脂肪酸以短鏈多不飽和脂肪酸 (SC-PUFA)開始
- ω-3 脂肪酸
- α-亞麻酸或ALA (18:3)
- ω-6 脂肪酸
- 亞油酸或LA (18:2)
這兩種脂肪酸不能被人體合成,因為人類缺乏產生它們的脫飽和酶。
它們構成更長和更不飽和脂肪酸的起點,這些脂肪酸也被稱為長鏈多不飽和脂肪酸 (LC-PUFA)
- omega-3 脂肪酸 (ω-3 脂肪酸)
- 二十碳五烯酸或EPA (20:5)
- 二十二碳六烯酸或DHA (22:6)
- Omega-6 脂肪酸 (ω-6 脂肪酸)
- γ-亞麻酸或GLA (18:3)
- 二同型γ-亞麻酸或DGLA (20:3)
- 花生四烯酸或AA (20:4)
ω-9 脂肪酸對人體來說不是必需的,因為人類通常擁有合成它們的所需酶。
飽和脂肪酸
[edit | edit source]飽和脂肪酸是長鏈羧酸,通常具有 12 到 24 個碳原子,沒有雙鍵。因此,飽和脂肪酸被氫飽和 (因為雙鍵會減少每個碳原子的氫原子數)。由於飽和脂肪酸只有單鍵,因此鏈內的每個碳原子都有 2 個氫原子 (除了末端的ω碳原子具有 3 個氫原子)。
| 常用名稱 | 化學結構 | C:D |
|---|---|---|
| 月桂酸 | CH3(CH2)10COOH | 12:0 |
| 肉豆蔻酸 | CH3(CH2)12COOH | 14:0 |
| 棕櫚酸 | CH3(CH2)14COOH | 16:0 |
| 硬脂酸 | CH3(CH2)16COOH | 18:0 |
| 花生酸 | CH3(CH2)18COOH | 20:0 |
| 山嵛酸 | CH3(CH2)20COOH | 22:0 |
| 木蠟酸 | CH3(CH2)22COOH | 24:0 |
| 蜂蠟酸 | CH3(CH2)24COOH | 26:0 |
脂肪酸合成
[edit | edit source]在人體中,脂肪酸主要在肝臟和泌乳乳腺中形成,在脂肪組織中形成的量較少。大多數乙醯輔酶A是由丙酮酸脫氫酶線上粒體中由丙酮酸形成的。線上粒體中產生的乙醯輔酶A透過檸檬酸合成酶與草醯乙酸縮合形成檸檬酸,檸檬酸然後被轉運到胞質溶膠中,並透過ATP檸檬酸裂解酶分解產生乙醯輔酶A和草醯乙酸。胞質溶膠中的草醯乙酸透過胞質溶膠蘋果酸脫氫酶還原為蘋果酸,蘋果酸被轉運回線粒體以參與檸檬酸迴圈。
脂肪酸合酶 (FAS) 是一種多酶,在脂肪酸合成中起著關鍵作用。它不是單一酶,而是一個完整的酶系統,由 272 kDa 多功能多肽組成,其中底物從一個功能域傳遞到下一個功能域。
脂肪酸合酶主要分為兩類。
I 型系統 使用單個大型多功能多肽,在哺乳動物和真菌中很常見(儘管真菌和哺乳動物合酶的結構排列不同)。在 CMN 類細菌(棒狀桿菌、分枝桿菌和諾卡氏菌)中也發現了一種 I 型脂肪酸合酶系統。在這些細菌中,FAS I 系統產生棕櫚酸,並與 FAS II 系統協同作用以產生更多種類的脂類產物。
II 型 存在於古細菌和真細菌中,其特徵在於使用離散的單功能酶進行脂肪酸合成。該途徑的抑制劑(FASII)正在被研究作為可能的抗生素。FAS I 和 FAS II 延長和還原的機制是相同的,因為 FAS II 酶的域與 FAS I 多酶多肽中的域對應物高度同源。然而,酶組織上的差異——FAS I 中整合,FAS II 中離散——導致了許多重要的生化差異。脂肪酸合酶的進化史與聚酮合酶 (PKS) 的進化史密切相關。聚酮合酶使用類似的機制和同源域來產生次生代謝脂類。此外,聚酮合酶也表現出 I 型和 II 型組織。動物體內的 FAS I 被認為是透過真菌體內 PKS I 的修飾產生的,而真菌和 CMN 類細菌體內的 FAS I 似乎是透過 FAS II 基因的融合而獨立產生的[7]。
哺乳動物 FAS 由兩個相同的多功能多肽組成,其中 N 末端部分的三個催化域(-酮醯基合酶 (KS)、丙二醯/乙醯基轉移酶 (MAT) 和脫水酶 (DH))透過 600 個殘基的核心區域與四個 C 末端域(烯醯還原酶 (ER)、-酮醯基還原酶 (KR)、醯基載體蛋白 (ACP) 和硫酯酶 (TE))分開。[8][9]
FAS 組織的傳統模型(參見右側的“頭尾”模型)主要基於以下觀察結果:雙功能試劑 1,3-二溴丙酮 (DBP) 能夠交聯一個 FAS 單體中 KS 域的活性位點半胱氨酸硫醇與另一個單體中 ACP 域的磷酸泛醯巰基乙胺前體。[10][11] 攜帶不同突變的 FAS 二體的互補分析表明,KS 和 MAT 域可以與任一單體的 ACP 協同作用。[12][13] 以及對 DBP 交聯實驗的重新研究表明,KS 活性位點 Cys161 硫醇可以與任一單體的 ACP 4'-磷酸泛醯巰基乙胺硫醇交聯。[14] 此外,最近報道稱,只包含一個有能力單體的異二聚體 FAS 能夠合成棕櫚酸酯。[15]
上述觀察結果似乎與 FAS 組織的經典“頭尾”模型不一致,因此提出了一種替代模型,預測兩個單體的 KS 和 MAT 域更靠近 FAS 二聚體的中心,在那裡它們可以訪問任一亞基的 ACP(參見右上角的圖形)。[16]
最近,豬(同型二聚體)[17]和酵母 FAS(異十二聚體)[18]的低解析度 X 射線晶體學結構的闡明,為這種重要酶提供了關鍵的結構和機制見解。
脂肪醯基
脂肪醯基,一個用於描述脂肪酸、它們的綴合物和衍生物的通用術語,是一組多種多樣的分子,它們透過在稱為脂肪酸合成的過程中使用乙醯輔酶 A 引物與丙二醯輔酶 A 或甲基丙二醯輔酶 A 基團鏈延長而合成。它們由一個以羧酸基團結束的烴鏈組成;這種排列賦予分子極性親水端和非極性疏水端,該端不溶於水。脂肪酸結構是生物脂類中最基本的類別之一,通常用作結構更復雜的脂類的組成部分。碳鏈通常長 4 到 24 個碳原子,可以是飽和的或不飽和的,並且可以連線到包含氧、鹵素、氮和硫的功能基團。在存在雙鍵的情況下,可能存在順式或反式幾何異構體,這會顯著影響分子的分子構型。順式雙鍵會導致脂肪酸鏈彎曲,這種效應隨著鏈中雙鍵數量的增加而更加明顯。這反過來又在細胞膜的結構和功能中起著重要作用。大多數天然存在的脂肪酸是順式構型,儘管反式形式確實存在於一些天然和部分氫化的脂肪和油中。生物學上重要的脂肪酸的例子是類二十烷酸,主要源自花生四烯酸和二十碳五烯酸,包括前列腺素、白三烯和血栓烷。脂肪酸類別的其他主要脂類類別是脂肪酯和脂肪醯胺。脂肪酯包括重要的生化中間體,如蠟酯、脂肪酸硫酯輔酶 A 衍生物、脂肪酸硫酯 ACP 衍生物和脂肪酸肉鹼。脂肪醯胺包括 N-醯基乙醇胺,如大麻素神經遞質花生四烯乙醇胺[19]。
甘油脂 甘油脂主要由單、二和三取代甘油組成,其中最著名的是甘油的脂肪酸酯(三醯基甘油),也稱為甘油三酯。在這些化合物中,甘油的三個羥基分別被酯化,通常是不同的脂肪酸。由於它們充當食物儲存,這些脂類構成了動物組織中大部分儲存脂肪。三醯基甘油酯的酯鍵水解以及甘油和脂肪酸從脂肪組織中釋放出來被稱為脂肪動員。甘油脂的其他亞類由糖基甘油表示,其特徵在於存在一個或多個糖殘基透過糖苷鍵連線到甘油。此類別的結構示例包括植物膜中的二半乳糖基二醯基甘油和哺乳動物精子細胞中的半乳糖脂[20]。
甘油磷脂,也稱為磷脂,在自然界中普遍存在,是細胞脂質雙層的關鍵成分,同時也參與代謝和細胞訊號傳導。神經組織(包括大腦)含有相對大量的甘油磷脂,其組成的改變與各種神經系統疾病有關。甘油磷脂可以根據真核生物和真細菌中甘油骨架的 sn-3 位或古細菌中 sn-1 位的極性頭部基團的性質進行細分[21]。
甘油磷脂是指任何含有至少一個 O-醯基、O-烷基或 O-烯丙基殘基連線到甘油部分,以及由含氮鹼基、甘油或肌醇單元組成的極性頭部,衍生自 sn-甘油-3-磷酸的衍生物。它包含一個帶有脂肪酸的甘油核心。這些脂肪酸亞基可以相同或不同。碳 1(尾部,非極性)包含一個脂肪酸,通常為飽和碳 2(尾部,非極性)包含一個脂肪酸,通常為不飽和且處於順式構象,因此看起來“彎曲”碳 3(頭部,極性)包含一個磷酸基團或連線到磷酸基團的醇
命名法和立體化學 一般來說,甘油磷脂使用“sn”符號,代表立體化學編號。當命名法中出現字母“sn”時,按照慣例,甘油第二個碳的羥基(sn-2)在費歇爾投影中位於左側。編號遵循費歇爾投影的編號,sn-1 為頂部的碳,sn-3 為底部的碳。
這種特定符號的優點是可以直觀地透過 sn-1 和 sn-3 位置上的殘基來確定甘油分子的空間構象(R 或 L)。
例如,sn-甘油-3-磷酸和 sn-甘油-1-磷酸是對映異構體。
甘油磷脂的例子
| 名稱 | 影像 | 頭部 | 影像 | 電荷 |
| 磷脂醯膽鹼(卵磷脂) |  |
膽鹼 |  |
中性 |
| 磷脂醯乙醇胺(腦磷脂) | 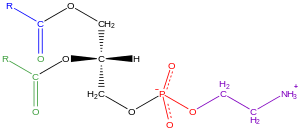 |
乙醇胺 | 中性 | |
| 磷脂醯肌醇 |  |
肌醇 | 負 | |
| 磷脂醯絲氨酸 |  |
絲氨酸 |  |
負 |
| 雙磷脂醯甘油(心磷脂) |  |
- | - | 負 |
卵磷脂和腦磷脂在大多數人類膜中比其他甘油磷脂更常見,但心磷脂線上粒體的內膜中非常常見。
磷脂醯乙醇胺 在生物膜中發現的甘油磷脂的例子包括磷脂醯膽鹼(也稱為 PC、GPCho 或卵磷脂)、磷脂醯乙醇胺(PE 或 GPEtn)和磷脂醯絲氨酸(PS 或 GPSer)。除了作為細胞膜的主要成分和細胞內和細胞間蛋白質的結合位點之外,真核細胞中的一些甘油磷脂,如磷脂醯肌醇和磷脂酸,要麼是膜衍生二線信使的前體,要麼本身就是膜衍生二線信使。通常,這兩個羥基中的一個或兩個被長鏈脂肪酸醯化,但也存在烷基連線和 1Z-烯丙基連線(縮醛磷脂)甘油磷脂,以及古細菌中的二烷基醚變體。

黑色:鞘氨醇
紅色:磷酸膽鹼
藍色:脂肪酸
鞘脂
[edit | edit source]鞘脂是一個複雜的化合物家族,它們共享一個共同的結構特徵,即鞘氨醇鹼骨架,它是從氨基酸絲氨酸和長鏈脂肪醯輔酶 A 從頭合成,然後轉化為神經醯胺、磷鞘脂、糖鞘脂和其他化合物。哺乳動物的主要鞘氨醇鹼通常被稱為鞘氨醇。神經醯胺(N-醯基鞘氨醇鹼)是鞘氨醇鹼衍生物的一個主要亞類,具有醯胺連線的脂肪酸。脂肪酸通常為飽和或單不飽和,鏈長為 16 到 26 個碳原子。哺乳動物的主要磷鞘脂是鞘磷脂(神經醯胺磷酸膽鹼),而昆蟲主要含有神經醯胺磷酸乙醇胺,真菌有植物神經醯胺磷酸肌醇和含甘露糖的頭部基團。糖鞘脂是一個多樣化的分子家族,由一個或多個糖殘基組成,透過糖苷鍵連線到鞘氨醇鹼。這些的例子包括簡單的和複雜的糖鞘脂,如腦苷脂和神經節苷脂[22]。
鞘脂型別
- 神經醯胺是所有鞘脂共有的基本結構單元。它們僅由透過醯胺鍵連線到鞘氨醇的脂肪酸鏈組成。
鞘脂主要有三種類型,它們在頭部基團上有所不同
- 鞘磷脂具有磷酸膽鹼或磷酸乙醇胺分子,並透過酯鍵連線到神經醯胺的 1-羥基。
鞘磷脂(SPH,sfing-goh-mahy-uh-lin)是動物細胞膜中發現的一種鞘脂,特別是在包圍某些神經細胞軸突的髓鞘膜中。它通常由磷酸膽鹼和神經醯胺組成。在人類中,SPH 代表所有鞘脂的 ~85%。
- 糖鞘脂,它們在頭部基團上的取代基不同(見圖)。糖鞘脂是神經醯胺,在其 1-羥基位置具有一個或多個透過 β-糖苷鍵連線的糖殘基[23]。
- 腦苷脂在 1-羥基位置具有單個葡萄糖或半乳糖。
- 硫腦苷脂是硫酸化腦苷脂。
- 腦苷脂在 1-羥基位置具有單個葡萄糖或半乳糖。
- 神經節苷脂至少有三種糖,其中一種必須是唾液酸。
鞘脂貯積症是一類與鞘脂代謝有關的疾病。
| 疾病 | 缺乏的酶 | 積累的產物 | 症狀 | 遺傳方式 |
|---|---|---|---|---|
| 尼曼-匹克病 | 鞘磷脂酶 | 腦和紅細胞中的鞘磷脂 |
|
常染色體隱性遺傳 |
| 法布里病 | α-半乳糖苷酶 A | 腦、心臟、腎臟中的糖脂 |
|
X 連鎖[25] |
| 克萊布病 | 半乳糖腦苷脂酶 | 少突膠質細胞中的糖脂 |
|
常染色體隱性遺傳 |
| 戈謝病 | 葡萄糖腦苷脂酶 | 紅細胞、肝臟和脾臟中的葡萄糖腦苷脂 |
|
常染色體隱性遺傳,在阿什肯納茲猶太人中流行 |
| 泰-薩克斯病 | 己糖胺酶 A | 神經元中的 GM2 神經節苷脂 |
|
常染色體隱性遺傳,在阿什肯納茲猶太人中流行 |
| 亞急性硬化性腦白質營養不良 | 芳基硫酸酯酶 A 或前鞘氨醇 | 神經組織中的硫腦苷脂化合物 | 中樞神經系統和周圍神經系統的脫髓鞘
|
常染色體隱性遺傳[26] |
甾醇脂類 甾醇脂類,如膽固醇及其衍生物,是膜脂類的重要組成部分,與甘油磷脂和鞘磷脂一起。類固醇,所有這些都是從相同的融合四環核心結構衍生而來,具有不同的生物學作用,如激素和訊號分子。十八碳 (C18) 類固醇包括雌激素家族,而 C19 類固醇包括雄激素,如睪酮和雄酮。C21 亞類包括孕激素以及糖皮質激素和鹽皮質激素。維生素 D 的各種形式組成的甾醇類,其特徵是核心結構的 B 環斷裂。膽汁酸及其結合物是類固醇的另一個例子,在哺乳動物中,膽汁酸是膽固醇的氧化衍生物,在肝臟中合成。植物等價物是植物甾醇,如 β-谷甾醇、豆甾醇和油菜甾醇;後一種化合物也被用作藻類生長的生物標誌物。真菌細胞膜中主要的甾醇是麥角甾醇[27]。
異戊二烯脂類 異戊二烯脂類由 5-碳前體異戊烯基焦磷酸和二甲基烯丙基焦磷酸合成,這些前體主要透過甲羥戊酸 (MVA) 途徑產生。簡單的異戊二烯類 (線性醇、二磷酸酯等) 是透過連續新增 C5 單元形成的,並根據這些萜類單元的數量進行分類。含有超過 40 個碳原子的結構被稱為多萜類。類胡蘿蔔素是重要的簡單異戊二烯類,它們充當抗氧化劑並作為維生素 A 的前體。醌類和氫醌類是另一個生物學上重要的分子類別,它們包含連線到非異戊二烯來源的醌核心的異戊二烯尾部。維生素 E 和維生素 K 以及泛醌都是這一類別的例子。原核生物合成多異戊二烯類 (稱為細菌異戊二烯類),其中連線到氧的末端異戊二烯單元保持不飽和,而在動物多異戊二烯類 (多萜醇) 中,末端異戊二烯被還原[28]。
糖脂類
Kdo2-脂質 A 的結構。葡萄糖胺殘基為藍色,Kdo 殘基為紅色,醯基鏈為黑色,磷酸基團為綠色。糖脂類描述了脂肪酸直接連線到糖骨架的化合物,形成與膜雙層相容的結構。在糖脂類中,單糖取代了甘油脂和甘油磷脂中存在的甘油骨架。最熟悉的糖脂類是革蘭氏陰性細菌中脂質 A 成分的脂多糖的醯化葡萄糖胺前體。典型的脂質 A 分子是葡萄糖胺的二糖,它們被多達七個脂肪醯基鏈衍生化。大腸桿菌生長所需的最小脂多糖是 Kdo2-脂質 A,它是葡萄糖胺的六醯化二糖,被兩個 3-脫氧-D-甘露糖-辛酮酸 (Kdo) 殘基糖基化[29]。
聚酮類 聚酮類是由經典酶以及具有與脂肪酸合酶類似的機制特徵的迭代和多模組酶,聚合乙醯基和丙醯基亞基合成。它們包含大量來自動物、植物、細菌、真菌和海洋來源的次生代謝產物和天然產物,並且具有很大的結構多樣性。許多聚酮類是環狀分子,其主鏈通常透過糖基化、甲基化、羥基化、氧化和/或其他過程進一步修飾。許多常用的抗微生物、抗寄生蟲和抗癌藥物是聚酮類或聚酮類衍生物,例如紅黴素、四環素、阿維菌素和抗腫瘤依託泊苷[30]。
半乳糖脂類和硫脂類
[edit | edit source]半乳糖脂 是一種糖脂,其糖基為半乳糖。它們與鞘糖脂的不同之處在於它們的組成中不含氮。它們是植物膜脂的主要組成部分,在植物膜中取代磷脂,以節省磷酸鹽用於其他必需的過程。這些葉綠體膜含有大量的單半乳糖基二醯基甘油(MGDG)和二半乳糖基二醯基甘油(DGDG)。它們可能也直接參與光合作用,因為它們在光合複合物的 X 射線結構中被發現。半乳糖脂腦苷脂(GalC)及其硫酸化衍生物硫脂也大量存在於髓鞘中,髓鞘是脊椎動物神經系統軸突周圍的膜(以及一小部分蛋白質)。
硫脂 是一類脂類,其含有含硫官能團。硫脂中最常見的成分之一是硫代奎寧糖,它被醯化形成硫代奎寧糖基二醯基甘油。在植物中,硫脂是硫迴圈中的重要中間體。
什麼是硫代奎寧糖?
硫代奎寧糖,也稱為 6-硫代奎寧糖和 6-脫氧-6-硫代-D-吡喃葡萄糖,是一種單糖,作為硫脂硫代奎寧糖基二醯基甘油 (SQDG) 的結構單元存在。硫代奎寧糖是葡萄糖的磺酸衍生物,磺酸基團由酶 UDP-硫代奎寧糖合酶 (SQD1) 引入糖中。
脂蛋白是一種生化組合,包含蛋白質和脂類,脂類與蛋白質結合。許多酶、轉運蛋白、結構蛋白、抗原、粘附素和毒素都是脂蛋白。例如,高密度 (HDL) 和低密度 (LDL) 脂蛋白可以使脂肪在血液中運輸,線粒體和葉綠體的跨膜蛋白以及細菌脂蛋白。
脂蛋白可以按照以下方式分類,從較大、密度較低到較小、密度較高。脂蛋白較大且密度較低,如果它們的脂肪含量高於蛋白質含量。它們的分類基於電泳和超速離心。
乳糜微粒將甘油三酯(脂肪)從腸道運送到肝臟、骨骼肌和脂肪組織。
極低密度脂蛋白 (VLDL) 將(新合成的)三醯甘油從肝臟運送到脂肪組織。
中密度脂蛋白 (IDL) 介於 VLDL 和 LDL 之間。它們通常在血液中檢測不到。
低密度脂蛋白 (LDL) 將膽固醇從肝臟運送到身體細胞。LDL 有時被稱為“壞膽固醇”脂蛋白。
高密度脂蛋白 (HDL) 從身體組織中收集膽固醇,並將其帶回肝臟。HDL 有時被稱為“好膽固醇”脂蛋白。
也可以根據血清蛋白電泳中的蛋白質分類,將脂蛋白分類為“α”和“β”。這種術語有時用於描述脂類疾病,例如無β脂蛋白血癥。
脂蛋白 (a)
脂蛋白 (a) – Lp(a),心臟病學診斷測試 < 14 mg/dL : 正常 14-19 mg/dL : ? > 19 mg/dL : 高風險
如何降低:有氧運動、煙酸、阿司匹林、古格爾脂。
蠟是有機化合物,其特徵在於包含長的烷基鏈。天然蠟通常是脂肪酸和長鏈醇的酯。合成蠟是缺乏官能團的長鏈烴。
蠟的型別
植物和動物蠟 許多植物或動物會生物合成蠟。它們通常包含幾種成分,包括蠟酯、蠟酸、蠟醇和烴。蠟酯通常源自各種羧酸和各種脂肪醇。組成不僅取決於物種,還取決於生物體的地理位置。由於它們是混合物,因此天然產生的蠟比純成分更軟,熔點更低。動物蠟 最著名的動物蠟是蜂蠟,但其他昆蟲也會分泌蠟。蜂蠟的主要成分是棕櫚酸蜂蠟酯,這種物質用於建造蜂巢。它的熔點為 62-65 °C。鯨蠟在抹香鯨的頭部油中大量存在。它的主要成分之一是棕櫚酸鯨蠟醇,是脂肪酸和脂肪醇的另一種酯。羊毛脂是一種從羊毛中獲得的蠟,由甾醇的酯組成[31]。例如,蜂蠟 - 由蜜蜂產生
中國蠟 - 由蠟蟲 Ceroplastes ceriferus 產生[檢查拼寫]
耳垢 - 存在於人耳中。
羊毛脂(羊毛蠟) - 來自羊的皮脂腺
蟲蠟 - 來自漆蟲 Kerria lacca
鯨蠟 - 來自抹香鯨的頭部空腔和鯨脂
植物蠟 尤其是在溫暖的氣候中,植物會分泌蠟來控制蒸發和水分。[2] 從商業角度來看,最重要的蠟是巴西棕櫚蠟,這是一種從巴西棕櫚樹中獲得的硬蠟。它含有棕櫚酸蜂蠟酯,有許多應用。其他更專業的植物蠟包括小燭樹蠟、烏拉圭蠟、甘蔗蠟、金雀花蠟、荷荷巴油。植物表皮蠟是長鏈脂肪族烴的混合物,含有烷烴、脂肪酸、伯醇和仲醇、二醇、酮、醛。
石油衍生蠟
雖然大多數天然蠟都是酯,但石蠟是烴,是烷烴的混合物,通常是同系物系列的鏈長。這些材料佔石油的很大一部分。它們透過真空蒸餾精製。石蠟是正構烷烴和異構烷烴、環烷烴以及烷基和環烷烴取代的芳香族化合物的飽和混合物。支化程度對性質有重要影響。每年生產數百萬噸石蠟。它們被用於粘合劑、食品(如口香糖和乳酪包裝)、化妝品以及塗層。
蒙坦蠟 蒙坦蠟是一種從煤和褐煤中提取的化石蠟。它非常硬,反映了飽和脂肪酸和醇的高濃度,而不是特徵更軟蠟的酯。雖然它們是深棕色且有氣味,但可以被提純和漂白,從而產生商業上可用的產品。
聚乙烯及其相關衍生物 某些蠟是透過在 400 °C 下裂解聚乙烯獲得的。產物的化學式為 (CH2)nH2,其中 n 的範圍大約為 50 到 100。截至 1995 年,約有 2 億公斤/年被消耗[32]。
脂滴如何與脂蛋白類似
脂滴和血漿脂蛋白都有一些共同的結構特徵。脂滴和血漿脂蛋白中都存在被極性脂單層包裹的中性脂核心。這兩種脂類還有另一個共同點,即它們都裝飾著特定的表面蛋白,這些蛋白通常由兩親性 α-螺旋組成。然而,脂滴(直徑從 100 奈米到 100 微米不等)通常比脂蛋白(直徑從不到 20 奈米到約 500 奈米不等)更大。雖然脂滴和脂蛋白都是透過與內質網中的中性脂合成相連而形成的,但它們在生理功能上不同:脂類主要儲存在脂滴中,而脂蛋白則將脂類分佈到全身。此外,一些細胞型別(如腸上皮細胞、肝細胞和卵黃囊內胚層細胞)表達了脂蛋白組裝所需的蛋白質(如微粒體 TG 轉移蛋白和載脂蛋白 B),而大多數細胞會產生脂滴。因此,脂蛋白可能是透過適應脂滴進行分泌而進化來的。細胞如何調節脂滴中的儲存與脂蛋白上的分泌仍然未知。只有當分泌細胞超過組裝和分泌脂蛋白的能力時,脂滴中的脂類才能儲存在這些分泌細胞中。或者,當達到儲存閾值時,分泌可能會被啟用。也可能脂滴庫中的 TG 可透過某些特定的脂滴蛋白導向脂蛋白的形成。人們認為,透過脂蛋白分泌 TG 包括它們的分解,不僅在脂滴中,而且在內質網中的重新合成中。
去除脂滴蛋白 由於它們的類似性,去除脂滴蛋白的機制與去除膜蛋白的機制非常相似。在脂質體中,內吞的膜蛋白或自噬泡會降解。蛋白酶體還可以降解內質網膜蛋白(稱為內質網相關降解)。脂滴蛋白可能透過這兩種機制被降解。在一些脂滴蛋白被泛素修飾以進行蛋白酶體降解之前,脂滴會被帶到自噬體。此外,透過非偏倚篩選,蛋白酶體成分被確定為正常脂滴形態所需的成分。最近,人們發現脂滴和蛋白酶體降解是如何在分子水平上聯絡起來的。在脂滴蛋白中,泛素 E2 連線酶 (Ube2g2) 與古老的泛素蛋白 1 (Aup1) 結合,Aup1 位於脂滴上或內質網中。泛素 E3 連線酶 (spartin/SPG20) 定位於脂滴,其耗竭或過表達會導致脂滴積累。然後,從這些發現可以推斷出脂滴相關蛋白被特定的機制降解,但其細節尚不清楚。一些內質網相關降解底物可能定位於脂滴,但至少內質網相關降解不需要脂滴。
- ↑ a b c Rigaudy, J. (1979). 有機化學命名法. Pergamon. ISBN 0080223699. OCLC 5008199.
{{cite book}}: 未知引數|coauthors=被忽略 (|author=建議) (幫助) - ↑ "脂類命名法。推薦,1976". 歐洲生物化學雜誌. 79 (1): 11–21. 1977. doi:10.1111/j.1432-1033.1977.tb11778.x.
{{cite journal}}: 多個|work=和|journal=指定 (幫助) - ↑ Medscape:免費 CME、醫療新聞、全文期刊文章等
- ↑ Christopher Beermann1, J Jelinek1, T Reinecker2, A Hauenschild2, G Boehm1 和 H-U Klör2, "膳食中鏈脂肪酸和 n-3 長鏈多不飽和脂肪酸對健康志願者脂肪代謝的短期影響"
- ↑ http://en.wikipedia.org/w/index.php?title=Essential_fatty_acid&oldid=422687249
- ↑ http://en.wikipedia.org/w/index.php?title=Essential_fatty_acid&oldid=422687249
- ↑ http://en.wikipedia.org/w/index.php?title=Fatty_acid_synthase&oldid=416140503
- ↑ Chirala SS, Jayakumar A, Gu ZW, Wakil SJ (2001). "人脂肪酸合酶:域間在催化活性合酶二聚體形成中的作用". 美國國家科學院院刊. 98 (6): 3104–8. doi:10.1073/pnas.051635998. PMC 30614. PMID 11248039.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護:多重名稱:作者列表 (連結) - ↑ Smith S (1994). "動物脂肪酸合酶:一個基因,一個多肽,七種酶". FASEB J. 8 (15): 1248–59. PMID 8001737.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Stoops JK, Wakil SJ (1981). "動物脂肪酸合酶。兩個亞基域組成β-酮醯合成酶位點的全新排列". 生物化學雜誌. 256 (10): 5128–33. PMID 6112225.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Stoops JK, Wakil SJ (1982). "動物脂肪酸合酶。鑑定構成β-酮醯合成酶位點全新排列的殘基及其在冷失活中的作用". 生物化學雜誌. 257 (6): 3230–5. PMID 7061475.
{{cite journal}}: 未知引數|month=被忽略 (幫助) - ↑ Joshi AK, Rangan VS, Smith S (1998). "動物脂肪酸合酶同二聚體兩個亞基的差異親和標記允許分離由獨立修飾的亞基組成的異二聚體". J. Biol. Chem. 273 (9): 4937–43. doi:10.1074/jbc.273.9.4937. PMID 9478938.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Rangan VS, Joshi AK, Smith S (2001). "透過體外突變互補繪製動物脂肪酸合酶的功能拓撲". Biochemistry. 40 (36): 10792–9. doi:10.1021/bi015535z. PMID 11535054.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Witkowski A, Joshi AK, Rangan VS, Falick AM, Witkowska HE, Smith S (1999). "動物脂肪酸合酶的磷酸泛醯巰基乙醇和活性位點半胱氨酸硫醇的二溴丙酮交聯可以在亞基間和亞基內發生。對側邊平行、反平行亞基模型的重新評估". J. Biol. Chem. 274 (17): 11557–63. doi:10.1074/jbc.274.17.11557. PMID 10206962.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Joshi AK, Rangan VS, Witkowski A, Smith S (2003). "構建具有一個具有活性的亞基的活性動物脂肪酸合酶二聚體". Chem. Biol. 10 (2): 169–73. doi:10.1016/S1074-5521(03)00023-1. PMID 12618189.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Asturias FJ, Chadick JZ, Cheung IK, Stark H, Witkowski A, Joshi AK, Smith S (2005). "哺乳動物脂肪酸合酶的結構和分子組織". Nat. Struct. Mol. Biol. 12 (3): 225–32. doi:10.1038/nsmb899. PMID 15711565.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Maier T, Leibundgut M, Ban N (2008). "哺乳動物脂肪酸合酶的晶體結構". Science. 321 (5894): 1315–22. doi:10.1126/science.1161269. PMID 18772430.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ Lomakin IB, Xiong Y, Steitz TA (2007). "酵母脂肪酸合酶的晶體結構,一臺具有八個協同工作的活性位點的細胞機器". Cell. 129 (2): 319–32. doi:10.1016/j.cell.2007.03.013. PMID 17448991.
{{cite journal}}: 未知引數|month=被忽略 (幫助)CS1 維護: 多個名稱:作者列表 (連結) - ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Sphingolipid&oldid=422417411
- ↑ http://en.wikipedia.org/w/index.php?title=Sphingolipid&oldid=422417411
- ↑ 如果沒有特別說明,參考資料為:Marks, Dawn B.; Swanson, Todd; Sandra I Kim; Marc Glucksman (2007). 生物化學與分子生物學. 費城: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 0-7817-8624-X.
{{cite book}}: CS1 維護: 多個名稱:作者列表 (連結) - ↑ Banikazemi M, Desnick RJ, Astrin KH (2009-07-08). "法布里病". eMedicine 兒科學:遺傳與代謝疾病. Medscape. Retrieved 2010-12-31.
{{cite web}}: Cite has empty unknown parameter:|coauthors=(help)CS1 maint: multiple names: authors list (link) - ↑ Gieselmann V, Zlotogora J, Harris A, Wenger DA, Morris CP (1994). "亞急性硬化性腦白質營養不良的分子遺傳學". Hum. Mutat. 4 (4): 233–42. doi:10.1002/humu.1380040402. PMID 7866401.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Lipid&oldid=424764580
- ↑ http://en.wikipedia.org/w/index.php?title=Wax&oldid=423902940
- ↑ http://en.wikipedia.org/w/index.php?title=Wax&oldid=423902940



