生物化學原理/核酸 III:核苷酸合成
嘌呤在生物體內以核苷酸(鹼基連線到核糖 5-磷酸)的形式合成。一個關鍵的調節步驟是透過 PRPP 合成酶產生核糖-5-磷酸-α-D-核糖 1-焦磷酸 (PRPP),PRPP 合成酶被無機磷酸啟用並被嘌呤核苷酸抑制。它不是嘌呤合成的決定性步驟,因為 PRPP 也用於嘧啶合成和補救途徑。第一個決定性步驟是 PRPP、谷氨醯胺和水與 5'-磷酸核糖胺、谷氨醯胺和焦磷酸的反應 - 由焦磷酸醯胺轉移酶催化,該酶被 PRPP 啟用,並被 AMP、GMP 和 IMP 抑制。
腺嘌呤和鳥嘌呤都衍生自肌苷酸 (IMP),肌苷酸是在一個預先存在的核糖-磷酸上透過一個複雜的途徑合成的,使用來自甘氨酸、谷氨醯胺和天冬氨酸的氨基酸的原子,以及從輔酶四氫葉酸轉移的甲酸離子[1]。
- IMP 脫氫酶將 IMP 轉化為 XMP
- GMP 合成酶將 XMP 轉化為 GMP
在酶學中,GMP 合成酶(谷氨醯胺水解)(EC 6.3.5.2)是一種催化化學反應的酶
- ATP + 黃嘌呤 5'-磷酸 + L-谷氨醯胺 + H2O AMP + 焦磷酸 + GMP + L-穀氨酸
該酶的 4 種底物分別是 ATP、黃嘌呤 5'-磷酸、L-谷氨醯胺和 H2O,而其 4 種產物分別是 AMP、焦磷酸、GMP 和 L-穀氨酸。該酶屬於連線酶家族,特別是那些形成碳-氮鍵的碳-氮連線酶,谷氨醯胺作為醯胺-N-供體。該酶類的系統名稱是黃嘌呤-5'-磷酸:L-谷氨醯胺醯胺連線酶(AMP 形成)。其他常用的名稱包括 GMP 合成酶(谷氨醯胺水解)、鳥苷酸合成酶(谷氨醯胺水解)、鳥苷單磷酸合成酶(谷氨醯胺水解)、黃嘌呤 5'-磷酸醯胺轉移酶和鳥苷 5'-單磷酸合成酶。該酶參與嘌呤代謝和穀氨酸代謝。已知至少一種化合物,即 Psicofuranin 可以抑制這種酶[2][3]。
- GMP 還原酶將 GMP 轉化回 IMP
- 腺苷琥珀酸合成酶將 IMP 轉化為腺苷琥珀酸
- 腺苷琥珀酸裂解酶將腺苷琥珀酸轉化為 AMP
- AMP 脫氨酶將 AMP 轉化回 IMP
磷酸核糖焦磷酸(PRPP)是一種戊糖磷酸。
它是由核糖-5-磷酸二磷酸激酶從核糖 5-磷酸形成的。
它在幾個反應中起著轉移磷酸核糖基團的作用
| 酶 | 反應物 | 產物 |
|---|---|---|
| 腺嘌呤磷酸核糖轉移酶 | 腺嘌呤 | AMP |
| 次黃嘌呤-鳥嘌呤磷酸核糖轉移酶 | 鳥嘌呤 | GMP |
| 次黃嘌呤-鳥嘌呤磷酸核糖轉移酶 | 次黃嘌呤 | IMP |
| 乳清酸磷酸核糖轉移酶 | 乳清酸 | OMP |
| 尿嘧啶磷酸核糖轉移酶 | 尿嘧啶 | UMP |
在從頭生成嘌呤中,醯胺磷酸核糖轉移酶作用於 PRPP 以產生磷酸核糖胺。六種酶參與 IMP 合成。其中三種是多功能的
GART(反應 2、3 和 5)
PAICS(反應 6 和 7)
ATIC(反應 9 和 10)
三功能嘌呤生物合成蛋白腺苷-3 是一種酶,在人類中由基因GART編碼。這種蛋白質是一種三功能多肽。它具有磷酸核糖甘氨醯胺甲醯轉移酶(EC 6.3.4.13)、磷酸核糖甘氨醯胺合成酶(EC 6.3.3.1)、磷酸核糖氨基咪唑合成酶(EC 2.1.2.2)活性,這是從頭合成嘌呤所必需的。
磷酸核糖氨基咪唑羧化酶(或 AIR 羧化酶)是一種參與核苷酸合成的酶。它催化 5'-磷酸核糖-5-氨基咪唑(“AIR”)轉化為 5-磷酸核糖-4-羧基-5-氨基咪唑(“CAIR”)。
雙功能嘌呤生物合成蛋白 PURH 是一種蛋白質,在人類中由 ATIC 基因編碼。ATIC 編碼一種酶,該酶從氨基咪唑甲醯胺核苷酸生成肌苷單磷酸。它有兩個功能:EC 2.1.2.3 - 5-氨基咪唑-4-甲醯胺核苷酸甲醯轉移酶 EC 3.5.4.10 - IMP 環化酶
| 嘌呤環原子的生物合成來源 N1 來自 Asp 的胺基 C2 和 C8 來自甲酸 N3 和 N9 由 Gln 的醯胺基貢獻 C4、C5 和 N7 衍生自 Gly C6 來自 HCO3- (CO2) |

肌苷酸合成很複雜,從 5-磷酸核糖-1-焦磷酸 (PRPP) 開始。在第一步中,谷氨醯胺提供的氨基連線到 PRPP 的碳 1 上。由此產生的分子是 5-磷酸核糖胺,它非常不穩定,在生理 pH 值下半衰期為 30 秒。5-磷酸核糖胺獲得一個氨基酸(甘氨酸),成為甘氨醯胺核苷酸 (GAR)。然後,N10-甲醯四氫葉酸 (THF) 將一個甲醯基轉移到甘氨醯胺核苷酸,形成甲醯甘氨醯胺核苷酸 (FGAR)[4]。
使用一個 ATP 分子,將氨新增到該化合物中,使其成為甲醯甘氨醯亞胺核苷酸。另一個 ATP 分子導致一個分子內反應,產生一個咪唑環(5-氨基咪唑核苷酸)。
該途徑的下一步是透過使用 ATP 新增碳酸氫鹽以形成羧基氨基咪唑核苷酸(它只發生在真菌和細菌中;高等真核生物只是新增 CO2 以形成核苷酸)。然後,咪唑的羧酸鹽基團磷酸化並新增天冬氨酸。
正如我們剛剛看到的,一個六步過程將甘氨酸、甲酸、碳酸氫鹽、谷氨醯胺和天冬氨酸連線起來,形成一箇中間體,該中間體包含合成嘌呤環所需的大部分原子。該中間體去除延胡索酸,並從 THF 新增第二個甲醯基。該化合物經過迴圈,並在經過一種分子內反應後形成肌苷酸。肌苷酸是該合成途徑中第一個具有完整嘌呤環的中間體。
參與 IMP 合成的酶在細胞中構成一個多酶複合物。有證據表明存在多功能酶,其中一些催化該途徑中的非連續步驟[5]。
“嘌呤” (purum uricum) 這個名稱是由德國化學家埃米爾·費歇爾在 1884 年命名的。他於 1899 年首次合成它[6]。反應序列的起始物質是尿酸 (8),它是在 1776 年由謝勒從腎結石中分離出來的[7]。尿酸 (8) 與 PCl5 反應生成 2,6,8-三氯嘌呤 (10),它與 HI 和 PH4I 反應生成 2,6-二碘嘌呤 (11)。然後使用鋅粉將產物還原為嘌呤 (1)。
除了嘌呤代謝中嘌呤的體內合成外,嘌呤也可以人工合成。
當甲醯胺在 170 oC 的開放容器中加熱 28 小時時,可以以良好的產率獲得嘌呤 (1)[8]。
這個非凡的反應以及其他類似的反應在生命的起源背景下已被討論[9]。
步驟:[8] 在 170-190 oC 的油浴中,將甲醯胺(45 克)在帶冷凝器的敞口容器中加熱 28 小時。透過真空蒸餾除去過量的甲醯胺(32.1 克)後,將殘餘物與甲醇迴流。過濾甲醇溶劑,透過真空蒸餾從濾液中除去溶劑,得到幾乎純的嘌呤;產率 4.93 克(以消耗的甲醯胺計,產率為 71%)。從丙酮中重結晶得到無色晶體狀嘌呤;熔點 218 oC。
Oro、Orgel 及其同事已表明,四分子 HCN 四聚形成二氨基馬來腈(12),它可以轉化為幾乎所有天然存在的嘌呤。[10][11][12][13][14]
Traube 嘌呤合成(1900 年)是一種經典反應(以 Wilhelm Traube 命名),它是在胺取代的嘧啶和甲酸之間進行的。[15]
從頭 合成嘧啶
[edit | edit source]與嘌呤不同,嘧啶在連線到 5-磷酸核糖基-1-焦磷酸(PRPP)之前先組裝好。
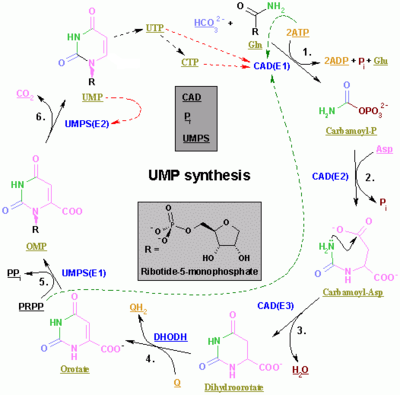
| 酶 | 產物 | 描述 |
| 氨基甲醯磷酸合成酶 II[16] | 氨基甲醯磷酸 | 這是嘧啶生物合成的調控步驟。 |
| 天冬氨酸轉氨基甲醯酶(天冬氨酸氨基甲醯轉移酶)[17] | 氨基甲醯天冬氨酸 | - |
| 二氫乳清酸酶[18] | 二氫乳清酸 | 脫水 |
| 二氫乳清酸脫氫酶[19](唯一的線粒體酶) | 乳清酸 | 二氫乳清酸進入線粒體,在那裡透過去除氫原子而被氧化。這是核苷酸環生物合成中唯一的線粒體步驟。 |
| 乳清酸磷酸核糖基轉移酶[20] | OMP | 使用 PRPP。 |
| OMP 脫羧酶[21] | UMP | 脫羧 |
| 尿苷-胞苷激酶 2[22] | UDP | 磷酸化。使用 ATP。 |
| 核苷二磷酸激酶 | 尿苷 5'-三磷酸(UTP) | 磷酸化。使用 ATP。 |
| CTP 合成酶 | 胞苷 5'三磷酸(CTP) | 使用谷氨醯胺和 ATP。 |
在後生動物中,前三種酶全部由同一個基因編碼(CAD)。在真菌中,存在一種類似的蛋白質,但缺乏二氫乳清酸酶的功能:另一種蛋白質催化第二步。
在其他生物體(細菌、古細菌和其他真核生物]])中,前三步由三種不同的酶完成。
CTP 合成酶(或 CTP 合成酶)是一種參與嘧啶生物合成的酶。它可以相互轉化 UTP 和 CTP。CTP 中胺/氨基的來源是谷氨醯胺。CTP 合成酶被 GTP(一種嘌呤)啟用。這有助於平衡嘌呤和嘧啶核苷酸的相對含量。CTP 合成酶被 CTP 可逆抑制,例如被谷氨醯胺類似物 DON 不可逆抑制。以下人類基因編碼具有 CTP 合成酶活性的蛋白質
CTPS - CTP 合成酶 1
CTPS2 - CTP 合成酶 2 嘧啶合成抑制劑用於治療活動性中度至重度類風溼性關節炎和銀屑病關節炎。例如,來氟米特和特立氟米特。
化學合成
[edit | edit source]嘧啶也可以透過有機合成在實驗室中製備。一種方法是經典的 Biginelli 反應。許多其他方法依賴於羰基與胺的縮合,例如從硫脲和乙醯乙酸乙酯合成 2-硫-6-甲基尿嘧啶 [23] 或從 4,4-二甲氧基-2-丁酮和甲醯胺合成 4-甲基嘧啶。[24][25]
一種新方法是,在用 2-氯吡啶和三氟甲磺酸酐對醯胺進行親電活化的情況下,使某些醯胺與碳腈反應 [26]
補救途徑
[edit | edit source]補救途徑是透過代謝途徑|從核苷酸降解途徑中的中間體合成核苷酸(嘌呤和嘧啶)的途徑。
補救途徑用於回收 RNA 和 DNA 降解過程中形成的鹼基和核苷。這在某些器官中很重要,因為一些組織無法進行從頭合成。
然後,回收的鹼基和核苷可以被轉化回核苷酸[27]。
底物
[edit | edit source]補救途徑需要不同的底物
嘧啶
[edit | edit source]尿嘧啶磷酸化酶將核糖-1-磷酸新增到遊離鹼基尿嘧啶上,形成尿苷單磷酸。然後,尿苷激酶將該核苷磷酸化為其二磷酸和三磷酸形式。脫氧胸腺嘧啶磷酸化酶將脫氧核糖-1-磷酸新增到胸腺嘧啶上,形成脫氧胸腺嘧啶單磷酸。然後,胸腺嘧啶激酶可以將該化合物磷酸化為脫氧胸腺嘧啶二磷酸和三磷酸。
胸腺嘧啶激酶高階生物有兩個化學性質完全不同的同工酶,TK1 和 TK2。前者最初是在胎兒組織中發現的,後者被發現更豐富地存在於成人組織中,最初它們被稱為胎兒和成人胸腺嘧啶激酶。很快,就發現 TK1 僅在細胞分裂(細胞週期依賴性)之前才存在於細胞質中,而 TK2 位於線粒體中,並且與細胞週期無關。這兩種型別的基因是在 1970 年代中期定位的。對 TK1 基因進行了克隆和測序。相應的蛋白質的分子量約為 25 kD。通常,它在組織中以二聚體的形式存在。它可以被 ATP 啟用。啟用後,它已轉化為四聚體。重組 TK1 無法以這種方式啟用並轉化為四聚體,表明細胞中存在的酶在合成後已被修飾。TK1 在細胞分裂的 S 期由細胞合成。細胞分裂完成後,TK1 在細胞內被降解,因此它不會在正常細胞分裂後進入體液。細胞中胸腺嘧啶激酶的作用存在反饋調節:胸腺嘧啶三磷酸(TTP)是胸腺嘧啶進一步磷酸化的產物,它充當胸腺嘧啶激酶的抑制劑。這有助於維持用於核酸合成的平衡的 TTP 磷酸量,不會使系統過飽和。在單純皰疹病毒、水痘帶狀皰疹病毒和EB病毒中已經鑑定出病毒特異性胸腺嘧啶激酶的基因[28][29]。
脫氧胸腺嘧啶與 ATP 反應生成脫氧胸腺嘧啶單磷酸和 ADP。
嘌呤
[edit | edit source]磷酸核糖基轉移酶將活化的核糖-5-磷酸(稱為磷酸核糖基焦磷酸或 PRPP)新增到鹼基上,形成核苷酸單磷酸。磷酸核糖基轉移酶有兩種型別:腺嘌呤磷酸核糖基轉移酶(APRT)和次黃嘌呤-鳥嘌呤磷酸核糖基轉移酶(HGPRT)。萊什-尼漢綜合徵與 HGPRT 缺乏有關。
| 核苷 | 酶 | 核苷酸 |
| 次黃嘌呤 | 次黃嘌呤/鳥嘌呤磷酸核糖基轉移酶(HGPRT) | IMP |
| 鳥嘌呤 | 次黃嘌呤/鳥嘌呤磷酸核糖基轉移酶(HGPRT) | GMP |
| 腺嘌呤 | 腺嘌呤磷酸核糖基轉移酶(APRT) | AMP |
參考文獻
[edit | edit source]- ↑ http://en.wikipedia.org/w/index.php?title=Purine_metabolism&oldid=423783946
- ↑ http://en.wikipedia.org/w/index.php?title=GMP_synthase&oldid=420670515
- ↑ Tesmer JJ, Klem TJ, Deras ML, Davisson VJ, Smith JL (January 1996). "The crystal structure of GMP synthetase reveals a novel catalytic triad and is a structural paradigm for two enzyme families". Nat. Struct. Biol. 3 (1): 74–86.
- ↑ http://en.wikipedia.org/w/index.php?title=Inosinic_acid&oldid=423592099
- ↑ http://en.wikipedia.org/w/index.php?title=Inosinic_acid&oldid=423592099
- ↑ Fischer, E. Berichte der Deutschen Chemischen Gesellschaft 1899, 32, 2550.
- ↑ Scheele, V. Q. Examen Chemicum Calculi Urinari, Opuscula, 1776, 2, 73.
- ↑ a b Yamada, H.; Okamoto, T. (1972). "從甲醯胺一步合成嘌呤環". 化學與藥物公報. 20: 623.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Saladino; Crestini, Claudia; Ciciriello, Fabiana; Costanzo, Giovanna; Mauro, Ernesto; et al. (2006). "關於甲醯胺為基礎的資訊聚合物起源:核鹼基的合成和早期聚合物的有利熱力學位點". 生命起源與生物圈演化. 36 (5–6): 523–531. doi:10.1007/s11084-006-9053-2. PMID 17136429.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ↑ Sanchez, R. A.; Ferris, J. P.; Orgel, L. E. 分子生物學雜誌, 1967, 30, 223.
- ↑ Ferris, J. P.; Orgel, L. E. 美國化學學會雜誌, 1966, 88, 1074.
- ↑ Ferris, J. P.; Kuder, J. E.; Catalano, O. W. 科學, 1969, 166, 765.
- ↑ Oro, J.; Kamat, J. S. 自然, 1961, 190, 442.
- ↑ Houben-Weyl, Vol . E5, p. 1547
- ↑ 基於名稱反應的有機合成, Alfred Hassner, C. Stumer ISBN 008043259X 2002
- ↑ "Entrez Gene:CAD 氨基甲醯磷酸合成酶 2、天冬氨酸轉氨甲醯酶和二氫乳清酸酶".
- ↑ "Entrez Gene:CAD 氨基甲醯磷酸合成酶 2、天冬氨酸轉氨甲醯酶和二氫乳清酸酶".
- ↑ "Entrez Gene:CAD 氨基甲醯磷酸合成酶 2、天冬氨酸轉氨甲醯酶和二氫乳清酸酶".
- ↑ "Entrez Gene:DHODH 二氫乳清酸脫氫酶".
- ↑ "Entrez Gene:UMPS 尿苷單磷酸合成酶".
- ↑ "Entrez Gene:UMPS 尿苷單磷酸合成酶".
- ↑ "Entrez Gene:UCK2 尿苷-胞嘧啶激酶 2".
- ↑ 有機合成,Coll. Vol. 4, p.638 (1963); Vol. 35, p.80 (1955) 連結
- ↑ 有機合成,Coll. Vol. 5, p.794 (1973); Vol. 43, p.77 (1963) 連結
- ↑ http://en.wikipedia.org/w/index.php?title=Pyrimidine_metabolism&oldid=391209862
- ↑ 嘧啶衍生物的一步合成 Mohammad Movassaghi 和 Matthew D. Hill J. Am. Chem. Soc.; 2006; 128(44) pp 14254 - 14255; (通訊)
- ↑ http://en.wikipedia.org/w/index.php?title=Nucleotide_salvage&oldid=414293528
- ↑ http://en.wikipedia.org/w/index.php?title=Thymidine_kinase&oldid=422438046
- ↑ Wintersberger E (1997 年 2 月). "胸腺嘧啶激酶的調節和生物學功能". 生化學會學報. 25 (1): 303–8.








