生物化學原理/水:細胞的溶劑
水是一種化學物質,化學式為H2O。它的分子包含一個氧原子和兩個氫原子,透過共價鍵連線。
水在地球上廣泛分佈,以淡水和鹹水的形式存在。地球經常被稱為“藍色星球”,因為從太空中看,它呈現藍色。這種藍色是由海洋的反射造成的,海洋覆蓋了地球面積的約70%。大洋地殼很年輕、薄而緻密,其中沒有任何岩石可以追溯到比泛大陸解體更早的時期。因為水比任何氣體都要緻密得多,這意味著水將流入由於大洋地殼的高密度而形成的“凹陷”。在一個像金星這樣的星球上,沒有水,這些凹陷看起來形成了一片廣闊的平原,平原之上是高原。

由於大陸地殼的低密度岩石含有大量易於侵蝕的鹼金屬和鹼土金屬的鹽,因此在數十億年的時間裡,鹽透過蒸發將淡水迴流到陸地作為雨雪,從而積聚在海洋中。因此,地球上大部分水被認為是鹽水或鹹水,平均鹽度為35%(或3.5%,大致相當於1公斤海水中含有35克鹽),儘管這會根據從周圍陸地接收到的徑流量略有變化。總而言之,海水、邊緣海的鹽水和鹹水封閉湖泊的水佔地球上水的98%以上,儘管沒有封閉湖泊儲存全球意義上的大量水。據信,全球可再生鹹水地下水總量至少為100立方公里,但在評估乾旱地區的用水質量時很少被考慮。


地球上剩餘的水構成了該星球的淡水資源。通常,淡水被定義為鹽度低於海洋鹽度1%的水——即低於約0.35%。鹽度介於此水平和1%之間的水通常被稱為邊緣水,因為對於人類和動物的許多用途來說,它是邊緣性的。地球上的淡水分佈也非常不均勻。雖然在中生代和古近紀等溫暖時期,地球上沒有任何地方有冰川,所有的淡水都存在於河流和溪流中,但今天,分佈大約如下
- 冰蓋和冰川:68.7%
- 南極冰蓋:90%,9700年更新週期
- 格陵蘭冰蓋:9%
- 其他冰川:<1%,1600年更新週期
- 地下水:30.1%,1400年更新週期
- 地表水:0.3%
- 淡水湖泊:87%,17年更新週期
- 沼澤:11%
- 河流:2%,16天更新週期
- 地下冰和永久凍土:0.86%
- 大氣層:0.04%
在這些淡水來源中,只有河水通常是有價值的。大多數湖泊中的水都位於加拿大等極端惡劣的地區,例如冰川湖。貝加爾湖和霍夫斯格爾湖都因乾旱而免受第四紀冰川的影響,它們擁有等量的水,而後者在蒙古被用作飲用水來源。雖然地下水的總量已知遠大於河流徑流,但其中很大一部分地下水是鹽水,因此應歸類於上述鹽水。
在乾旱地區也存在大量數千年來從未更新過的化石地下水;這不能被視為可再生水。但是,淡水地下水非常寶貴,尤其是在印度等乾旱國家。它的分佈與地表河水的分佈大致相似,但在炎熱乾燥的氣候中更容易儲存,因為地下水庫比大壩更能免受蒸發的影響。在葉門等國家,雨季間歇性降雨產生的地下水是灌溉用水的主要來源。由於地下水補給比地表徑流更難準確測量,因此在即使地表水資源有限的地區,地下水通常也不被使用。即使在今天,根據所用來源的不同,同一地區的地下水總補給量的估計也差異很大,而化石地下水開採超過補給量的情況(包括奧加拉拉蓄水層)非常普遍,而且在最初開發時幾乎從未被認真考慮過。[1]


水在自然界中以三種常見的物質狀態出現,並且在地球上可能呈現許多不同的形式:天空中的水蒸氣和雲層;極地海洋中的海水和冰山;山區中的冰川和河流;以及地下含水層中的液體。在高溫高壓下,例如在巨型行星內部,據認為水以離子水的形式存在,其中分子分解成氫離子和氧離子,在更高的壓力下以超離子水的形式存在,其中氧原子結晶,但氫離子在氧晶格中自由漂浮。
水在標準溫度和壓力下是液體。它無味無臭。水和冰的固有顏色是極其輕微的藍色,儘管在少量時它們看起來都是無色的。水蒸氣作為氣體基本上是看不見的。水在可見電磁光譜中是透明的。因此,水生植物可以在水中生存,因為陽光可以到達它們。紫外線和紅外線被強烈吸收。[2]
由於水分子不是線性的,並且氧原子具有比氫原子更高的電負性,因此氧原子帶有輕微的負電荷,而氫原子帶有輕微的正電荷。因此,水是具有電偶極矩的極性分子。
水的最大密度出現在3.98 °C(39.16 °F)。它具有反常的性質,即當冷卻到固態(冰)時,它會變得不那麼緻密,而不是更緻密。它膨脹到佔據固態的9%更大的體積,這解釋了冰漂浮在液態水上的原因。它的密度是1,000 kg/m3液體(4 °C),重量為62.4 lb/ft.3(917 kg/m3,固態)。它的重量為8.3454 lb/gal(美國,液體)。
水的沸點(以及所有其他液體)取決於氣壓。例如,在珠穆朗瑪峰頂,水的沸點為68 °C(154 °F),而海平面為100 °C(212 °F)。相反,深海附近熱液噴口的溫度可達數百攝氏度,但仍保持液態。

水具有除氨以外任何已知物質中第二高的摩爾比熱容,以及較高的汽化熱(40.65 kJ·mol−1),這兩者都是其分子之間廣泛的氫鍵作用的結果。這兩種非同尋常的性質使水能夠透過緩衝溫度的大幅波動來調節地球的氣候。
水是一種良好的溶劑,通常被稱為通用溶劑。可溶於水的物質,如鹽、糖、酸、鹼和一些氣體(尤其是氧氣、二氧化碳)被稱為親水性(親水性)物質,而那些與水混合不好的物質(如脂肪和油)被稱為疏水性(疏水性)物質。
水與許多液體(如乙醇)以任何比例混溶,形成單一的均相液體。另一方面,水和大多數油是不混溶的,通常會根據密度從上到下形成分層。作為氣體,水蒸氣與空氣完全混溶。
水與許多其他溶劑形成共沸物。
純水具有較低的電導率,但當溶解少量離子物質(如氯化鈉)時,電導率會顯著增加。
水可以透過電解分解成氫和氧。作為氫的氧化物,當氫或含氫化合物燃燒或與氧或含氧化合物反應時,會形成水。水不是燃料,而是氫燃燒的最終產物。電解或其他任何方式將水分解成氫和氧所需的能量大於氫和氧重新結合時可以收集的能量。比氫更具電正性的元素,如鋰、鈉、鈣、鉀和銫,會從水中置換出氫,形成氫氧化物。由於氫氣是易燃氣體,因此釋放出的氫氣是危險的,水與這些元素中更具電正性的元素的反應可能劇烈爆炸。
細胞中所有主要的成分(蛋白質、DNA 和多糖)也溶解在水中。水是光合作用和呼吸作用的基礎。光合作用細胞利用太陽能將水的氫從氧中分離出來。氫與 CO2(從空氣或水中吸收)結合形成葡萄糖並釋放氧氣。所有活細胞都利用這種燃料並氧化氫和碳來捕獲太陽能並在過程中重新形成水和 CO2(細胞呼吸作用)。
水可以形成異常大量的分子間氫鍵(四個)對於其大小的分子。這些因素導致水分子之間具有很強的吸引力,從而產生水的表面張力和毛細管力的升高。毛細管作用是指水在重力的作用下向上移動狹窄管道的趨勢。所有維管植物(如樹木)都依賴於這種特性。[3]
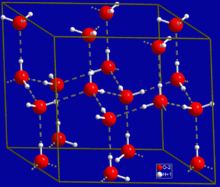

最普遍且可能是最簡單的氫鍵例子存在於水分子之間。在一個離散的水分子中,有兩個氫原子和一個氧原子。兩個水分子可以在它們之間形成氫鍵;最簡單的情況是,當只有兩個分子存在時,稱為水二聚體,通常用作模型系統。當存在更多分子時,就像液態水的情況一樣,更多鍵是可能的,因為一個水分子中的氧有兩個孤對電子,它們中的每一個都可以與另一個水分子中的氫形成氫鍵。這可以重複,使得每個水分子最多與四個其他分子形成 H 鍵,如圖所示(兩個透過其兩個孤對,兩個透過其兩個氫原子)。氫鍵強烈影響冰的晶體結構,有助於形成開放的六角形晶格。冰的密度比相同溫度下的水低;因此,水的固態在液態上漂浮,不像大多數其他物質。液態水的沸點高是由於每個分子可以形成的氫鍵數量多,而其分子量卻很低。由於難以破壞這些鍵,與其他沒有透過氫鍵連線的類似液體相比,水具有非常高的沸點、熔點和粘度。水是獨一無二的,因為它的氧原子有兩個孤對和兩個氫原子,這意味著一個水分子最多可以形成四個鍵。例如,氟化氫——其 F 原子上有三個孤對,但只有一個 H 原子——只能形成兩個鍵;(氨有相反的問題:三個氫原子,但只有一個孤對)。H-F...H-F...H-F 液態水分子形成的氫鍵的精確數量隨時間而波動,並取決於溫度。在 25°C 下的 TIP4P 液態水模擬中,估計每個水分子平均參與 3.59 個氫鍵。在 100°C 下,由於分子運動增加和密度降低,這個數字降至 3.24,而在 0°C 下,氫鍵的平均數量增加到 3.69。最近的一項研究發現氫鍵的數量要少得多:25°C 下為 2.357。這些差異可能是由於用於定義和計數氫鍵的方法不同。在鍵強度更相等的情況下,人們可能會發現兩個相互作用的水分子的原子被劃分為兩個帶相反電荷的多原子離子,特別是氫氧根 (OH−) 和水合氫離子 (H3O+)。(水合氫離子也被稱為“羥鎓”離子)。H-O− H3O+ 事實上,在標準溫度和壓力條件下的純水中,這種後一種公式很少適用;平均大約每 5.5 × 108 個分子會將一個質子釋放給另一個水分子,這與水在這些條件下的解離常數值相一致。這是水獨特性質的一個重要組成部分。[4]
水也是酸鹼中性和酶功能的核心。酸,一種氫離子(H+,即質子)供體,可以被鹼(一種質子受體,如氫氧根離子 (OH−))中和以形成水。水被認為是中性的,其 pH 值(氫離子濃度的負對數)為 7。酸的 pH 值小於 7,而鹼的 pH 值大於 7。[5]
強酸和強鹼是指在實際應用中完全解離(電離)在水中的酸和鹼。鹽酸 (HCl) 是強酸的一個很好的例子。
一個常見的遇到的問題是計算給定濃度強酸溶液的 pH 值。通常,酸的濃度將比純水中 H+ 離子的基線濃度(10−7 摩爾)高得多。在這種情況下,H+ 離子濃度幾乎等於酸濃度,並且 pH 值透過取該值的負對數來簡單計算[6]
例如,對於 0.01M 的 HCl 溶液,H+ 濃度可以取為 0.01M,pH 值為 −log(0.01)。也就是說,pH = 2。
對於非常低的濃度,即大約 10−6M 或更低的濃度,純水中 H+ 離子的基線濃度變得很重要,必須考慮在內。[7] 解決方法如下。在平衡狀態下,任何水溶液都必須滿足水的解離平衡方程[8],
另一個約束是,酸的名義濃度必須保持不變。名義濃度用 Ca 表示,相當於最初新增到反應中的酸量。這被稱為質量平衡方程,可以寫成,
其中“HA”指的是酸的質子化形式,“A–”指的是共軛鹼陰離子。
注意,對於給定的反應,Ca 是常數。這個方程只是說酸分子可以是質子化的,也可以是電離的,但總數將保持不變。
對於完全解離的強酸,[A–] >> [HA],[HA] 項可以忽略。
另一個必須滿足的關係被稱為電中性原理或電荷平衡方程式,其表述為溶液的總電荷必須為零。因此所有負離子電荷的總和必須等於所有正離子電荷的總和。這可以寫成:
對於強酸,可以使用 Ca 代替 [A–],並透過代入從水的平衡方程式中推匯出的值 [OH–] = Kw / [H+] 來消除此方程式中的 [OH–]。 因此,
將其寫成二次方程的形式,
可以很容易地解出 [H+]。
例如,要找到 5×10−8M HCl 溶液的 pH 值,首先要注意,與水中 [H+] 的基線濃度 (10−7) 相比,該濃度很小。因此,應該使用上面推匯出的二次方程。
弱酸和弱鹼
[edit | edit source]在這種情況下,問題是確定給定酸的 pKa 或 Ka(酸解離常數)時,特定濃度的酸溶液的 pH 值。
在這種情況下,酸不是完全解離的,但解離程度由該酸的平衡方程式給出
質量平衡和電荷平衡方程式也可以應用於此,但在弱酸的情況下,酸沒有完全解離,因此假設 [A–] >> [HA] 不成立。 因此,質量平衡方程式為
除非酸非常弱,或者濃度非常稀,否則可以合理地假設 [H+] 的濃度遠大於 [OH–] 的濃度。此假設簡化了計算,並且可以在找到結果後進行驗證。注意,這等效於假設 pH 值低於約 6。在該假設下,電荷平衡方程式為
有三個方程式和三個未知數([H+]、[A–] 和 [HA]),需要求解 [H+]。質量平衡方程式允許用 [H+] 求解 [HA]
然後將它們代入酸的平衡方程式中
重新排列此方程以將其寫成二次方程的形式,
ICE 表格可以用來評估反應前後濃度的變化——本質上,它是一個用於根據酸分子和電荷的移動,對給定反應的質量平衡和電荷平衡方程式進行實施的助記符。使用 ICE 表格推匯出的方程式與上面給出的二次方程式相同。
例如,考慮一個求解 0.01M 苯甲酸溶液的 pH 值的問題,已知該酸的 Ka = 6.5×10−5(pKa = 4.19)。
該反應的平衡方程式為
我們可以忽略 [OH–] 濃度,希望最終答案的 pH 值小於 6。那麼 [H+] = [A–],平衡方程式變為
質量平衡方程式為
求解 [HA] 得
並將該值代入平衡方程式,得到二次方程式
這給出了答案
因此,pH 值小於 6 的假設是有效的,可以忽略 [OH–] 濃度。

酸解離常數和pKa
[edit | edit source]酸解離常數,Ka,(也稱為酸度常數或酸電離常數)是定量衡量酸在溶液中的強度的指標。它是被稱為酸鹼反應中的解離的化學反應的平衡常數。平衡可以用符號表示為
- HA = A− + H+,
其中 HA 是一種通用的酸,透過分裂成 A−(稱為該酸的共軛鹼)和氫離子或質子 H+ 來解離,在水溶液的情況下,它以水合氫離子形式存在。在圖中所示的示例中,HA 代表醋酸,A− 代表乙酸根離子。當化學物質 HA、A− 和 H+ 的濃度不隨時間的推移而改變時,它們就被認為處於平衡狀態。解離常數通常寫成平衡濃度(以 mol/L 為單位)的商,用 [HA]、[A−] 和 [H+] 表示
由於Ka 值跨越了許多數量級,因此在實踐中更常使用酸解離常數的對數度量。pKa 等於 −log10 Ka,也可能(不正確地)被稱為酸解離常數
在存在多個 pK 值的情況下,它們由索引指定:pK1、pK2、pK3 等。對於氨基酸,pK1 常數指的是其羧基 (-COOH) 基團,pK2 指的是其氨基 (-NH3) 基團,pK3 是其側鏈的 pK 值。
根據 **阿倫尼烏斯** 的原始定義,酸是在水溶液中解離釋放氫離子 H+(質子)的物質:[9]
- HA = A− + H+。
這種解離反應的平衡常數稱為解離常數。釋放的質子與水分子結合生成水合氫離子(或鎓離子)H3O+,因此阿倫尼烏斯後來提出解離應該寫成酸鹼反應
- HA + H2O = A− + H3O+。
布朗斯臺德和勞裡進一步將此推廣到質子交換反應:[10][11][12]
- 酸 + 鹼 = 共軛鹼 + 共軛酸。
酸失去一個質子,留下一個共軛鹼;質子被轉移到鹼,形成一個共軛酸。對於酸 HA 的水溶液,鹼是水;共軛鹼是 A−,共軛酸是水合氫離子。布朗斯臺德-勞裡定義適用於其他溶劑,例如二甲基亞碸:溶劑 S 充當鹼,接受一個質子並形成共軛酸 SH+。
在溶液化學中,通常使用 H+ 作為溶劑化氫離子的縮寫,無論溶劑是什麼。在水溶液中,H+ 表示 溶劑化水合氫離子,而不是質子。[13][14]
酸或鹼的“共軛”指定取決於上下文。鹼 B 的共軛酸 BH+ 按照以下方式解離
- BH+ + OH− = B + H2O
這是平衡的逆反應
- H2O(酸)+ B(鹼)= OH−(共軛鹼)+ BH+(共軛酸)。
氫氧根離子 OH− 是一種眾所周知的鹼,在這裡充當酸水的共軛鹼。因此,酸和鹼被簡單地視為質子的供體和受體。
酸解離的更廣泛定義包括水解,其中質子由水分子的分裂產生。例如,硼酸 (B(OH)3) 充當弱酸,儘管它不是質子供體,但由於水解平衡
- B(OH)3 + 2 H2O = B(OH)4− + H3O+。
類似地,金屬離子水解 導致像 [Al(H2O)6]3+ 這樣的離子表現為弱酸:[15]
- [Al(H2O)6]3+ +H2O =} [Al(H2O)5(OH)]2+ + H3O+。
表中給出了不同氨基酸的 pKa 值。
| 氨基酸 | 簡寫 | 縮寫 | 平均質量 (Da) | pI | pK1 (α-COOH) |
pK2 (α-+NH3) |
|---|---|---|---|---|---|---|
| 丙氨酸 | A | Ala | 89.09404 | 6.01 | 2.35 | 9.87 |
| 半胱氨酸 | C | Cys | 121.15404 | 5.05 | 1.92 | 10.70 |
| 天冬氨酸 | D | Asp | 133.10384 | 2.85 | 1.99 | 9.90 |
| 穀氨酸 | E | Glu | 147.13074 | 3.15 | 2.10 | 9.47 |
| 苯丙氨酸 | F | Phe | 165.19184 | 5.49 | 2.20 | 9.31 |
| 甘氨酸 | G | Gly | 75.06714 | 6.06 | 2.35 | 9.78 |
| 組氨酸 | H | His | 155.15634 | 7.60 | 1.80 | 9.33 |
| 異亮氨酸 | I | Ile | 131.17464 | 6.05 | 2.32 | 9.76 |
| 賴氨酸 | K | Lys | 146.18934 | 9.60 | 2.16 | 9.06 |
| 亮氨酸 | L | Leu | 131.17464 | 6.01 | 2.33 | 9.74 |
| 蛋氨酸 | M | Met | 149.20784 | 5.74 | 2.13 | 9.28 |
| 天冬醯胺 | N | Asn | 132.11904 | 5.41 | 2.14 | 8.72 |
| 吡咯賴氨酸 | O | Pyl | ||||
| 脯氨酸 | P | Pro | 115.13194 | 6.30 | 1.95 | 10.64 |
| 谷氨醯胺 | Q | Gln | 146.14594 | 5.65 | 2.17 | 9.13 |
| 精氨酸 | R | Arg | 174.20274 | 10.76 | 1.82 | 8.99 |
| 絲氨酸 | S | Ser | 105.09344 | 5.68 | 2.19 | 9.21 |
| 蘇氨酸 | T | Thr | 119.12034 | 5.60 | 2.09 | 9.10 |
| 硒代半胱氨酸 | U | Sec | 168.053 | |||
| 纈氨酸 | V | Val | 117.14784 | 6.00 | 2.39 | 9.74 |
| 色氨酸 | W | Trp | 204.22844 | 5.89 | 2.46 | 9.41 |
| 酪氨酸 | Y | Tyr | 181.19124 | 5.64 | 2.20 | 9.21 |
亨德森-哈塞爾巴爾赫方程
[edit | edit source]勞倫斯·約瑟夫·亨德森在 1908 年寫了一個方程,描述了碳酸作為緩衝溶液的使用。卡爾·阿爾伯特·哈塞爾巴爾赫後來用對數形式重新表達了該公式,得出了亨德森-哈塞爾巴爾赫方程。哈塞爾巴爾赫使用該公式研究代謝性酸中毒。
亨德森-哈塞爾巴赫方程是透過以下步驟從酸解離常數方程推匯出來的[16][17]
或者
比率 是無量綱的,因此可以使用其他單位的比率。例如,組分的摩爾比 或分數濃度,其中 將會得到相同的答案。有時這些其他單位使用起來更方便。
pKa 和吉布斯自由能
[edit | edit source]平衡常數與反應的標準吉布斯自由能變化有關,因此對於酸解離常數
R 是氣體常數,T 是絕對溫度。注意 pKa= −log Ka 且 2.303 ≈ ln 10。在 25 °C 時,ΔG![]() 以 kJ·mol−1 為單位 = 5.708 pKa(1 kJ·mol−1 = 1000 焦耳 每 摩爾)。自由能由焓 項和熵 項組成。[18]
以 kJ·mol−1 為單位 = 5.708 pKa(1 kJ·mol−1 = 1000 焦耳 每 摩爾)。自由能由焓 項和熵 項組成。[18]
標準焓變可以透過量熱法 或使用範特霍夫方程 來確定,雖然量熱法更可取。當標準焓變和酸解離常數都已確定時,標準熵變很容易從上面的方程式中計算出來。在下表中,熵項是根據 pKa 和 ΔH![]() 的實驗值計算出來的。資料經過嚴格篩選,指的是 25 °C 和零離子強度,在水中。[18]
的實驗值計算出來的。資料經過嚴格篩選,指的是 25 °C 和零離子強度,在水中。[18]
| 化合物 | 平衡 | pKa | ΔG |
ΔH |
—TΔS |
|---|---|---|---|---|---|
| HA = 乙酸 | HA = H+ + A− | 4.756 | 22.147† | −0.41 | 22.56‡ |
| H2A+ = 甘氨酸H+ | H2A+ = HA + H+ | 2.351 | 13.420 | 4.00 | 9.419 |
| HA = H+ + A− | 9.78 | 55.825 | 44.20 | 11.6 | |
| H2A = 馬來酸 | H2A = HA− + H+ | 1.92 | 10.76 | 1.10 | 9.85 |
| HA− = H+ + A2− | 6.27 | 35.79 | −3.60 | 39.4 | |
| H3A = 檸檬酸 | H3A = H2A− + H+ | 3.128 | 17.855 | 4.07 | 13.78 |
| H2A− = HA2− + H+ | 4.76 | 27.176 | 2.23 | 24.9 | |
| HA2− = A3− + H+ | 6.40 | 36.509 | −3.38 | 39.9 | |
| 硼酸 | B(OH)3 + H2O ↔ [B(OH)4]- + H+ | 9.237 | 52.725 | 13.80 | 38.92 |
| H3A = 磷酸 | H3A ↔ H2A− + H+ | 2.148 | 12.261 | −8.00 | 20.26 |
| H2A− = HA2− + H+ | 7.20 | 41.087 | 3.60 | 37.5 | |
| HA2− = A3− + H+ | 12.35 | 80.49 | 16.00 | 54.49 | |
| 硫酸氫鹽 | HA− ↔ A2− + H+ | 1.99 | 11.36 | −22.40 | 33.74 |
| H2A = 草酸 | H2A ↔ HA− + H+ | 1.27 | 7.27 | −3.90 | 11.15 |
| HA− = A2− + H+ | 4.266 | 24.351 | 7.00 | 31.35 |
緩衝液
[edit | edit source]緩衝溶液之所以能夠抵抗 pH 變化,是因為酸 HA 和其共軛鹼 A- 之間存在平衡。HA = H+ + A- 當一些強酸加入到弱酸及其共軛鹼的平衡混合物中時,平衡將根據勒沙特列原理向左移動。因此,氫離子濃度增加的量小於加入的強酸量的預期值。類似地,如果將強鹼加入混合物中,氫離子濃度降低的量小於加入的鹼量的預期值。這種效應由弱酸的模擬滴定曲線 (pKa = 4.7) 所示。未解離酸的相對濃度用藍色表示,其共軛鹼用紅色表示。在緩衝區 pH = pKa ± 1 中,pH 變化相對緩慢,集中在 pH = 4.7 處,其中 [HA] = [A-],但一旦酸被去質子化超過 95%,pH 就會上升得快得多。[19]
緩衝溶液對於維持許多生物體中酶工作的正確 pH 是必要的。許多酶只能在非常精確的條件下工作;如果 pH 超出狹窄的範圍,酶就會減慢或停止工作,並可能變性,從而永久地使它們的催化活性失效。碳酸 (H2CO3) 和碳酸氫鹽 (HCO3−) 的緩衝液存在於血漿中,以維持 pH 在 7.35 到 7.45 之間。在工業上,緩衝溶液用於發酵過程和設定用於染色織物的染料的正確條件。它們還用於化學分析和 pH 計的校準。大多數用於研究的生物樣本都是用緩衝液製備的,尤其是 pH 7.4 的磷酸鹽緩衝鹽水 (PBS)。[20]
生物學中常用的緩衝化合物[21]
[edit | edit source]| 通用名稱 | pKa 在 25°C 處 |
緩衝範圍 | 溫度影響 dpH/dT 以 (1/K) ** 為單位 |
分子量 重量 |
完整化合物名稱 |
|---|---|---|---|---|---|
| TAPS | 8.43 | 7.7–9.1 | −0.018 | 243.3 | 3-{[三羥甲基]甲基}氨基丙烷磺酸 |
| Bicine | 8.35 | 7.6–9.0 | −0.018 | 163.2 | N,N-雙(2-羥乙基)甘氨酸 |
| Tris | 8.06 | 7.5–9.0 | −0.028 | 121.14 | 三羥甲基氨基甲烷 |
| Tricine | 8.05 | 7.4–8.8 | −0.021 | 179.2 | N-三羥甲基甲基甘氨酸 |
| TAPSO | 7.635 | 7.0-8.2 | 259.3 | 3-[N-三羥甲基甲基氨基]-2-羥基丙磺酸 | |
| HEPES | 7.55 | 6.8–8.2 | −0.014 | 238.3 | 4-(2-羥乙基)-1-哌嗪乙磺酸 |
| TES | 7.40 | 6.8–8.2 | −0.020 | 229.20 | 2-{[三羥甲基甲基]氨基}乙磺酸 |
| MOPS | 7.20 | 6.5–7.9 | −0.015 | 209.3 | 3-(N-嗎啉代)丙磺酸 |
| PIPES | 6.76 | 6.1–7.5 | −0.008 | 302.4 | 哌嗪-N,N'-雙(2-乙磺酸) |
| Cacodylate | 6.27 | 5.0–7.4 | 138.0 | 二甲基胂酸 | |
| SSC | 7.0 | 6.5-7.5 | 189.1 | 生理鹽水檸檬酸鈉 | |
| MES | 6.15 | 5.5–6.7 | −0.011 | 195.2 | 2-(N-嗎啉代)乙磺酸 |
** 以上數值為近似值。**
什麼是pH值?
[edit | edit source]p[H]的概念最早由丹麥化學家索倫·彼得·勞里茲·索倫森於1909年在嘉士伯實驗室提出,並在1924年修正為現代的pH值,因為人們發現細胞中的電動勢取決於氫離子的活性而不是濃度。在第一篇論文中,符號中的H是下標,寫成pH。目前還不清楚pH中'p'的確切定義。學校常用的定義是“百分比”。然而,一些參考文獻表明p代表“功率”,另一些則指的是德語單詞“Potenz”(意思是德語中的功率),還有的則指的是“電位”。Jens Norby於2000年發表了一篇論文,論證了p是一個常數,代表“負對數”;H則代表氫。根據嘉士伯基金會的說法,pH代表“氫的強度”。其他近年來提出的建議包括p代表法語的puissance(也意味著功率,但當時的嘉士伯實驗室是法語區)或pH代表拉丁語術語pondus Hydrogenii或potentia hydrogenii。有人還認為,索倫森使用字母p和q(在數學中通常成對出現)只是為了標記測試溶液(p)和參考溶液(q)[22].

純淨(中性)水在25 °C(77 °F)時的pH值約為7;該值會隨著溫度而變化。當酸溶解在水中時,pH值將小於7(如果在25 °C(77 °F)時)。當鹼或鹼溶解在水中時,pH值將大於7(如果在25 °C(77 °F)時)。濃度為1 mol dm−3的強酸溶液,例如鹽酸,的pH值為0。濃度為1 mol dm−3的強鹼溶液,例如氫氧化鈉,的pH值為14。因此,測量的pH值大多位於0到14之間。由於pH值是對數刻度,一個pH單位的差異相當於氫離子濃度十倍的差異[23].
由於玻璃電極(以及其他離子選擇性電極)對活性做出響應,因此應在與所研究的介質相似的介質中校準電極。例如,如果要測量海水樣品的pH值,則應在化學成分類似於海水的溶液中校準電極,如下所述。
可以使用pH指示劑獲得pH值的近似測量值。pH指示劑是一種在特定pH值附近會改變顏色的物質。它是一種弱酸或弱鹼,顏色變化發生在其酸解離常數,即pKa值的兩側約1個pH單位內。例如,天然指示劑石蕊在酸性溶液中呈紅色(pH<7,在25 °C(77 °F)時),在鹼性溶液中呈藍色(pH>7,在25 °C(77 °F)時)。通用指示劑由多種指示劑混合而成,因此從約pH 2到pH 10之間存在連續的顏色變化。通用指示劑紙是浸漬了通用指示劑的普通紙張[24].
| 指示劑 | 低pH顏色 | 過渡pH範圍 | 高pH顏色 |
|---|---|---|---|
| 百里酚藍(第一次轉變) | 紅色 | 1.2 – 2.8 | 黃色 |
| 甲基紅 | 紅色 | 4.4 – 6.2 | 黃色 |
| 溴百里酚藍 | 黃色 | 6.0 – 7.6 | 藍色 |
| 百里酚藍(第二次轉變) | 黃色 | 8.0 – 9.6 | 藍色 |
| 酚酞 | 無色 | 8.3 – 10.0 | 紫紅色 |
pH值為7(在25 °C(77 °F)時)的溶液被稱為中性,即它既不是酸性也不是鹼性。水會發生自電離過程。
- H2O = H+ + OH−
解離常數KW的值約為10−14,因此在鹽的中性溶液中,氫離子濃度和氫氧根離子濃度約為10−7 mol dm−3。純水的pH值會隨著溫度升高而降低。例如,純水在50 °C時的pH值為6.55。但是,需要注意的是,暴露在空氣中的水是微酸性的。這是因為水會吸收空氣中的二氧化碳,然後緩慢地轉化為碳酸,碳酸會解離釋放氫離子
- CO2 + H2O = H2CO3 = HCO3− + H+
數學定義
[edit | edit source]其中aH是活性的氫離子,單位為Mol/L(摩爾濃度)。活性具有濃度的意義,但活性總是小於濃度,定義為離子的濃度(Mol/L)乘以活性係數。稀溶液的活性係數是一個介於0和1之間的實數(對於濃溶液,活性係數可能大於1),它取決於溶液的許多引數,例如離子的性質、離子強度、溫度等。對於強電解質,在稀溶液中,離子的活性接近其濃度。可以使用響應能斯特方程的氫離子活性敏感的離子選擇性電極透過實驗測量活性。pH通常使用與高輸入阻抗毫伏表相連的玻璃電極測量,該毫伏表測量對氫離子活性敏感的電極與參比電極之間的電位差或電動勢E,例如甘汞電極或銀氯化銀電極。通常,玻璃電極與參比電極和溫度感測器組合在一個機體內。玻璃電極可以用能斯特方程來描述(準確率為95–99.9%)[26]
其中E是測得的電勢,E0是標準電極電勢,即活性為一的標準狀態下的電極電勢。R是氣體常數,T是開爾文溫度,F是法拉第常數,n是轉移的電子數(離子電荷),在本例中為1。電極電勢E與氫離子活度的對數成正比。
這個定義本身是完全不實用的,因為氫離子活性是濃度和活度係數的乘積。為了獲得正確的結果,電極必須使用已知活度的標準溶液進行校準。
pH的操作定義由國際標準ISO 31-8正式定義如下:[27] 對於溶液X,首先測量原電池的電動勢EX
- 參比電極|濃縮KCl溶液||溶液X|H2|Pt
然後也測量與上述原電池僅在將未知pH的溶液X,pH(X),替換為已知標準pH的溶液S,pH(S)不同的原電池的電動勢ES。則X的pH為
溶液X的pH與標準溶液的pH之差僅取決於兩個測得的電勢之差。因此,pH是從用一個或多個pH標準校準的電極測量的電勢獲得的;pH計的設定應調整,使儀表讀數對於標準溶液等於pH(S)值。一系列標準溶液S的pH(S)值,以及更多細節,在IUPAC建議中給出。[28] 標準溶液通常被稱為標準緩衝溶液。在實踐中,最好使用兩個或多個標準緩衝液,以容許實際電極中與能斯特定律理想性的小偏差。需要注意的是,由於溫度出現在定義方程中,因此溶液的pH是與溫度相關的。
測量極低的pH值,例如一些強酸性礦井水,[29]需要特殊的程式。在這些情況下,電極的校準可以用濃硫酸的標準溶液進行,其pH值可以使用皮策引數計算活度係數。[30]
pH是酸度函式的一個例子。氫離子濃度可以在非水溶劑中測量,但這實際上會導致不同的酸度函式,因為非水溶劑的標準狀態不同於水的標準狀態。 超強酸是一類非水酸,針對它們開發了漢密特酸度函式,H0。[31]
p[H]
[edit | edit source]這是索倫森的最初定義,在1924年被pH取代。然而,如果電極按氫離子濃度進行校準,則可以直接測量氫離子濃度。一種已被廣泛使用的方法是,在存在相對較高濃度的背景電解質的情況下,用已知濃度的強鹼溶液滴定已知濃度的強酸溶液。由於酸和鹼的濃度是已知的,因此很容易計算出氫離子濃度,以便將測得的電勢與濃度相關聯。校準通常使用格蘭圖進行。[32] 校準會產生標準電極電勢E0的值和斜率因子f的值,因此能斯特方程可寫成以下形式
可用於從E的實驗測量結果推匯出氫離子濃度。斜率因子通常略小於1。斜率因子小於0.95表明電極功能不正常。背景電解質的存在確保在滴定過程中氫離子活度係數保持有效地恆定。由於它是恆定的,因此可以透過將標準狀態定義為包含背景電解質的溶液來將其值設定為1。因此,使用此程式的效果是使活性等於濃度的數值。[33]
p[H]和pH之間的差異很小。第13.23節“pH的測定”</ref>中指出,pH = p[H] + 0.04。在實踐中,通常用“pH”表示兩種型別的測量結果。
| 區室 | pH |
|---|---|
| 胃酸 | 1 |
| 溶酶體 | 4.5 |
| 嗜鉻細胞的顆粒 | 5.5 |
| 人體皮膚 | 5.5 |
| 尿液 | 6.0 |
| 37 °C時中性H2O | 6.81 |
| 胞質溶膠 | 7.2 |
| 腦脊液(CSF) | 7.3 |
| 血液 | 7.34–7.45 |
| 線粒體基質 | 7.5 |
| 胰腺分泌物 | 8.1 |
pOH
[edit | edit source]pOH有時被用作衡量氫氧根離子OH−濃度或鹼度的指標。pOH不是獨立測量的,而是從pH推匯出來的。水中氫氧根離子的濃度與氫離子濃度有關
- [OH−] = KW /[H+]
- pOH = pKW − pH。
因此,在室溫下pOH ≈ 14 − pH。然而,這種關係在其他情況下並不嚴格有效,例如在鹼性土壤的測量中。

不同細胞區室、體液和器官的pH通常受到嚴格調控,這一過程稱為酸鹼平衡。
血液的pH通常略微鹼性,pH值為7.365。該值在生物學和醫學中通常被稱為生理pH。
酶和其他蛋白質具有最佳的pH範圍,在這個範圍之外可能會失活或變性。
酸鹼平衡中最常見的疾病是酸中毒,這意味著體內酸超負荷,通常定義為pH值低於7.35。
在血液中,可以使用已知的鹼剩餘(be)和碳酸氫鹽濃度(HCO3)透過以下公式估算pH值:[35]
- ↑ http://en.wikipedia.org/w/index.php?title=Water_distribution_on_Earth&oldid=422307996
- ↑ http://en.wikipedia.org/w/index.php?title=Water&oldid=424911919M
- ↑ http://en.wikipedia.org/w/index.php?title=Water&oldid=424911919M
- ↑ http://en.wikipedia.org/w/index.php?title=Hydrogen_bond&oldid=424341258
- ↑ http://en.wikipedia.org/w/index.php?title=Water&oldid=424911919M
- ↑ Lower, Stephen K. Chem1虛擬教科書,酸鹼平衡和計算 (PDF). pp. 12ff.
- ↑ Maloney, Chris. "非常低濃度強酸的pH值計算". Retrieved 13 March 2011.
- ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ Miessler, G. (1991). 無機化學 (第2版). Prentice Hall. ISBN 0134656598. 第6章:酸鹼和供體-受體化學
- ↑ Bell, R.P. (1973). 化學中的質子 (第2版). 倫敦:查普曼和霍爾. ISBN 0801408032. 包括對許多有機布朗斯特酸的討論。
- ↑ Shriver, D.F (1999). 無機化學 (第3版). 牛津:牛津大學出版社. ISBN 0198503318.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) 第5章:酸和鹼 - ↑ 模板:Housecroft3rd 第6章:酸、鹼和水溶液中的離子
- ↑ Headrick, J.M. (2005). "水團簇中水合質子振動的光譜特徵". 科學. 308 (5729): 1765–69. doi:10.1126/science.1113094. PMID 15961665.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Smiechowski, M. (2006). "水溶液中的質子水合:HDO 光譜的傅立葉變換紅外光譜研究". J. Chem. Phys. 125 (20): 204508–204522. doi:10.1063/1.2374891. PMID 17144716.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ Burgess, J. (1978). 溶液中的金屬離子. Ellis Horwood. ISBN 0853120277. 第9.1節“溶劑化陽離子的酸度”列出了許多pKa值。
- ↑ http://en.wikipedia.org/w/index.php?title=Henderson%E2%80%93Hasselbalch_equation&oldid=420194921
- ↑ Lawrence J. Henderson (1 May 1908). "關於酸的強度及其維持中性的能力之間的關係" (摘要). Am. J. Physiol. 21 (4): 173–179.
- ↑ a b Goldberg, R. (2002). "緩衝劑電離反應的熱力學量" (PDF). J. Phys. Chem. Ref. Data. 31 (2): 231–370. doi:10.1063/1.1416902.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ http://en.wikipedia.org/w/index.php?title=Buffer_solution&oldid=422587570
- ↑ http://en.wikipedia.org/w/index.php?title=Buffer_solution&oldid=422587570
- ↑ http://en.wikipedia.org/w/index.php?title=Buffer_solution&oldid=422587570
- ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ "pH". IUPAC Goldbook.
- ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ Quantities and units – Part 8: Physical chemistry and molecular physics, Annex C (normative): pH. 國際標準化組織, 1992.
- ↑ Covington, A. K.; Bates, R. G.; Durst, R. A. (1985). "pH 規模的定義、標準參考值、pH 的測量和相關術語" (PDF). 純淨與應用化學. 57: 531–542. doi:10.1351/pac198557030531.
- ↑ Nordstrom, Darrell Kirk; Alpers, Charles N.; Ptacek, Carol J.; Blowes, David W. (2000). "負 pH 和來自加州鐵山的極酸性礦井水". 環境科學與技術. 34: 254. doi:10.1021/es990646v.
- ↑ Zemaitis, J.F. (1986). "4". 水性電解質熱力學手冊:理論與應用. Wiley. ISBN 0816903506.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ Rossotti, F.J.C. (1965). "使用 Gran 圖的電位滴定:教科書遺漏". 化學教育雜誌. 42: 375–378. doi:10.1021/ed042p375.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ http://en.wikipedia.org/w/index.php?title=PH&oldid=424276341
- ↑ Boron, Walter, F. (2004). 醫學生理學:細胞與分子方法. Elsevier/Saunders. ISBN 1-4160-2328-3.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ↑ 醫學計算器 > 計算的碳酸氫鹽和鹼基過剩 teven Pon,MD,康奈爾大學威爾醫學院

![{\displaystyle [H^{+}][OH^{-}]=K_{w}=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/591675fad122ab16d26dd6b88d7c6994a04237bd)
![{\displaystyle C_{a}=[HA]+[A^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5cf22c86382302ed93a96c2b55b352f714360508)
![{\displaystyle C_{a}=[A^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f232752d4671c47d677dc300783381b93551443)
![{\displaystyle [H^{+}]=[A^{-}]+[OH^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ee82574eadc6b95dacf43cb5bae3edcca1c6f8b)
![{\displaystyle [H^{+}]=C_{a}+{\frac {K_{w}}{[H^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18bf1efcb4482af2a3e2b61da86dfaede2845ed4)
![{\displaystyle [H^{+}]^{2}-C_{a}[H^{+}]-K_{w}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/571a7b8174233ca8546858752e9969d53d2d4f63)
![{\displaystyle [H^{+}]^{2}-5\times 10^{-8}[H^{+}]-10^{-14}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9405647acf8e5ea2fa038f7850436f795e518482)
![{\displaystyle [H^{+}]=1.28\times 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91f54eb49b3d0f07cf6ed66091747e8c36ffc7c5)

![{\displaystyle K_{a}={\frac {[H^{+}][A^{-}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83ee86c6746a584bd7b209324db405b0563af917)
![{\displaystyle [H^{+}]=[A^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f360f5c6c8007d11a45de41f09ad08f35554258c)
![{\displaystyle [HA]=C_{a}-[A^{-}]=C_{a}-[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e729b228e4436a4b567d6801e27f5e970960950)
![{\displaystyle K_{a}={\frac {[H^{+}]^{2}}{C_{a}-[H^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/69a8c032997b3befd7914924fdfc75d4364e6de5)
![{\displaystyle [H^{+}]^{2}+K_{a}[H^{+}]-K_{a}C_{a}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d1ddb6d9e3cab181155c80e00b960a755cb76bb)
![{\displaystyle 6.5\times 10^{-5}={\frac {[H^{+}][A^{-}]}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59b8871ba3ae3910b48a0e7a1826304440257f69)
![{\displaystyle 6.5\times 10^{-5}={\frac {[H^{+}]^{2}}{[HA]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dbb8142a19922fc5fa963b9fbfa4cdd38865ed76)
![{\displaystyle 0.01M=[HA]+[A^{-}]=[HA]+[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8519375fb3ae54eb514c547c984221afda70a5f1)
![{\displaystyle [HA]=0.01M-[H^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f76201d08c5d7ba802f025079b664b1be5c47cbb)
![{\displaystyle 6.5\times 10^{-5}={\frac {[H^{+}]^{2}}{0.01-[H^{+}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c7f66625f1e965c8408fab90f539dcf043073649)
![{\displaystyle [H^{+}]^{2}+6.5\times 10^{-5}[H^{+}]-6.5\times 10^{-5}\times 0.01=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6b8f82ea9b6a1fd8cf89225a251294720affd0d1)
![{\displaystyle [H^{+}]=7.74\times 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32c6e017410258fc5ad4aae16d0f6ffbf619f186)
![{\displaystyle pH=-\log[H^{+}]=3.11}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45fcb274815a6b62ab4e50218aa831146f32ac3c)
![{\displaystyle K_{\mathrm {a} }=\mathrm {\frac {[A^{-}][H^{+}]}{[HA]}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/4df1424aa532585fc7ad6dd660a596705ee31a2b)

![{\displaystyle H_{3}B\rightleftharpoons \ H^{+}+H_{2}B^{-}\qquad K_{1}={[H^{+}]\cdot [H_{2}B^{-}] \over [H_{3}B]}\qquad pK_{1}=-logK_{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d5914a92ed297a5fdd3dd744cf66b0a3df51f04)
![{\displaystyle H_{2}B^{-}\rightleftharpoons \ H^{+}+HB^{-2}\qquad K_{2}={[H^{+}]\cdot [HB^{-2}] \over [H_{2}B^{-}]}\qquad pK_{2}=-logK_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cb9d92a69377536e3f6065352b3e178b0e2c283)
![{\displaystyle HB^{-2}\rightleftharpoons \ H^{+}+B^{-3}\qquad K_{3}={[H^{+}]\cdot [B^{-3}] \over [HB^{-2}]}\qquad pK_{3}=-logK_{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1813f1ef33e035d1e9d6d2909348a02a1c559da2)
![{\displaystyle K_{\textrm {a}}={\frac {[{\textrm {H}}^{+}][{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bfc85b5afa480f97938bbd4baa964ed4e75e0a48)
![{\displaystyle \log _{10}K_{\textrm {a}}=\log _{10}\left({\frac {[{\textrm {H}}^{+}][{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7004c33c2aa171790d891240571d988583dad93d)
![{\displaystyle \log _{10}K_{\textrm {a}}=\log _{10}[{\textrm {H}}^{+}]+\log _{10}\left({\frac {[{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3488b75b522c8ebb842b6916da9285b1d2ef4eb3)
![{\displaystyle -{\textrm {p}}K_{\textrm {a}}=-{\textrm {pH}}+\log _{10}\left({\frac {[{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/19ed8899f25ad0511d5835b0b3c23c4af7bfa3b1)
![{\displaystyle {\textrm {pH}}={\textrm {p}}K_{\textrm {a}}+\log _{10}\left({\frac {[{\textrm {A}}^{-}]}{[{\textrm {HA}}]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd4eee91b3503f645a82e359503f32a5b3e8a0b9)
![{\displaystyle {\textrm {pH}}={\textrm {pK}}_{a}-\log \left({\frac {[{\textrm {HA}}]}{[{\textrm {A}}^{-}]}}\right).}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f94cf8c05d9ec524ff8abfd47bb00cb906842ac)
![{\displaystyle [A^{-}]/[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cbdd71bac7c0090886365c329a0c5da749359bc)






![{\displaystyle E=E^{0}+f{\frac {RT}{nF}}\log _{e}[{\mbox{H}}^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85584d1ffca5ec688288b919f844534e2658c011)
