高中化學問題/Inchem/鍵型別
外觀
< 高中化學問題
化學鍵
每個人在世界上都擁有一個讓自己感覺良好的那個人。你在他們身邊會感到舒適和更有信心。換句話說,你與他們建立了聯絡。這在化學中也發生。當原子的價電子(外殼)不完整時,它們不穩定。有一些元素,比如氫,只需要 2 個價電子(二重奏),而另一些元素,比如氯,則需要 8 個價電子(八重奏)。但是當有另一個原子時,它們可以嘗試偷走對方的價電子,以便它們自己也具有穩定的價電子層(共價鍵)或它們共享價電子(離子鍵)。總的來說,我們稱它們為化學鍵。在化學中,有三種類型的鍵:離子鍵、金屬鍵和共價鍵。今天,我們將重點介紹離子鍵和共價鍵。
電子親和力 (EA):原子吸引電子的能力
電離能 (IE):原子保持其電子的能力
非金屬具有高 IE 和 AE,這意味著它們可以輕鬆地吸引電子並保持它們。金屬具有低 IE 和 EA,這意味著它們不能輕鬆地吸引或保持電子。
離子鍵
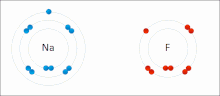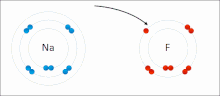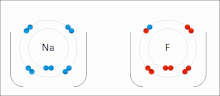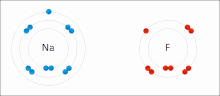
由非金屬和金屬組成。非金屬具有高 IE 和高 EA,這意味著它們足夠強,可以從金屬中獲得電子並保留自己的電子,因此它們不會失去電子。同時,金屬太“弱”無法保留自己的電子,更不用說從非金屬中偷取電子了。
共價鍵

由非金屬組成。非金屬原子具有高 IE 和高 EA。兩者都足夠強大以獲取電子並保護自己的電子,但沒有一個比另一個更強大。兩者都不能從對方那裡偷取電子,因此它們最終共享電子。原子之間電子對的共享使兩個原子保持在一起,形成共價鍵。
