蛋白質組學/翻譯後修飾/糖基化
本節
蛋白質糖基化是指在翻譯後將糖類選擇性地新增到特定蛋白質殘基的過程,該過程利用兩種不同的機制來為天然蛋白質結構賦予更多結構穩定性或功能。具體而言,此過程對於蛋白質的正確修飾是必要的,從而使其能夠正確錨定到磷脂雙層中,或因酶介導的糖類在位點的新增而獲得細胞訊號功能。然而,由於缺乏酶識別或共有序列知識,這些機制在肽序列上發生的特定性很大程度上未知。因此,已經做了大量的研究工作來定義糖基化位點的預測模型,以幫助整體蛋白質建模。一個具體的例子是 pNetOGlyc 3.1 伺服器,由生物序列分析中心開發。此工具使用神經網路從 PDB 中的實驗驗證的糖基化位點和結構同源性來推斷 O-GalNAc 型糖基化位點。[1]

蛋白質被糖基化的原因有很多。一些糖蛋白在連線上多糖後更穩定,另一些則用於細胞識別和交流。還有一些蛋白質在沒有伴隨的側鏈的情況下根本無法正確摺疊。由於糖基化被認為主要是在高爾基體中進行的,因此在體內研究糖基化在蛋白質構象中的作用的實驗設計起來很困難。
糖基化在維持蛋白質三級和四級結構方面起著至關重要的作用,最顯著的是作為免疫球蛋白Fab 片段複雜結構的保持者。具體而言,免疫球蛋白 G 利用多達三十種獨特的糖蛋白相互作用,以在血清糖蛋白的整個生命週期中建立和維持獨特的 Fab 結構[2]。其他功能包括膜結合識別和粘附活性、代謝成分、運輸職責以及蛋白質摺疊/介導功能。總的來說,在需要多樣化蛋白質且必須保持結構穩定性的細胞過程中,通常會涉及糖蛋白。
所有形式的糖基化都是利用活化核苷酸糖的酶促位點特異性反應。除了這三個基本要求之外,還存在幾種特定的糖基化型別。

N-連線糖基化是最常見的糖基化形式。真核生物和古細菌廣泛採用這種方式,但原核生物很少採用。這透過一系列步驟發生,這些步驟從形成一個由約 14 個糖組成的寡糖鏈開始。然後將該鏈錨定在一個稱為多萜醇的多聚體上。然後,一種稱為寡糖基轉移酶的酶將結合的糖苷鏈轉移到 ER 腔中,在那裡它可以附著到正在產生的新生多肽上。
糖基化是由一個稱為糖基化序列的短氨基酸序列觸發的。該序列的特點是(在 N 情況下)一個天冬醯胺,然後是除脯氨酸以外的任何殘基,然後是半胱氨酸、絲氨酸或蘇氨酸。

大多數 N-連線寡糖屬於兩類,據認為這兩類是由轉錄過程中存在糖修飾蛋白決定的。
複雜寡糖是透過從兩個 N-乙醯葡糖胺分子開始將多種其他型別的糖連線在一起形成的。這通常以在鏈的特徵性分支“觸角”上新增唾液酸而終止。
真核細胞分泌或膜蛋白上的一組寡糖。它們含有 5-9 個甘露糖殘基,但缺乏所謂複雜型別的唾液酸終止天線。
[O-連線糖基化]
[edit | edit source]O-連線糖基化透過將糖新增到蘇氨酸和絲氨酸殘基的羥基氧側鏈來實現,這些側鏈與脯氨酸殘基非常接近。O-連線糖基化通常發生在高爾基體中。與蛋白質糖基化的N-連線變體的主要區別在於側鏈相互作用的多樣性,其中O型利用基於氧的連線機制。
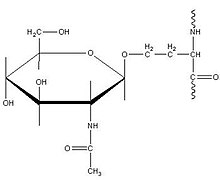
O-N-乙醯半乳糖胺 (O-GalNAc)
[edit | edit source]這種特定型別的O-連線糖基化理論上發生在高爾基體中,簡單地表徵為在後期加工中透過新增N-乙醯半乳糖胺基轉移酶到絲氨酸或蘇氨酸(通常是蘇氨酸)殘基來進一步修飾蛋白質。該機制由 UDP-N-乙醯-D-半乳糖胺:多肽N-乙醯半乳糖胺基轉移酶催化,並由各種碳水化合物穩定以形成完整的O-GalNAc 結構。這種形式的糖基化對於形成蛋白聚糖至關重要,蛋白聚糖與細胞外基質形成和粘膜分泌物成分有關。
O-N-乙醯葡萄糖胺 (O-GlcNAc)
[edit | edit source]O-N-乙醯葡萄糖胺型糖基化發生在O-GlcNAc 新增到絲氨酸或蘇氨酸殘基上的情況下,當且僅當絲氨酸或蘇氨酸激酶先前未在這些殘基上發生磷酸化。透過O-GlcNAc 轉移酶的機制,以這種方式糖基化的蛋白質存在於細胞核和細胞質中。由於它與磷酸化位點相關,這種糖基化事件的識別在當前和正在進行的癌症研究中具有重要意義,迄今為止,癌症研究僅集中於磷酸化活性。此外,O-GlCNAc 糖基化是訊號轉導通路終止處的營養感應六糖胺訊號通路參與者。
O-甘露糖
[edit | edit source]這種形式的糖基化在腦和肌肉細胞中含量豐富,由O-甘露糖 β-1,2-N-乙醯葡萄糖胺基轉移酶催化,該酶對甘露糖具有特異性,在先天性肌營養不良症 (CMD) 中具有重要意義,導致一種特定的疾病,特別是杜氏肌營養不良症。
O-巖藻糖 & O-葡萄糖
[edit | edit source]這些形式的糖基化發生在 Notch 蛋白(一種 EGF 訊號蛋白)中的半胱氨酸殘基之間。特別是人類 Notch-1(Notch 家族中的四種蛋白質之一)包含 12 個O-巖藻糖和 17 個O-葡萄糖位點,不當糖基化會導致異常發育、白血病和腦動脈硬化伴梗塞。對於O-果糖糖基化,這裡的連線機制涉及 GDP-巖藻糖蛋白O-巖藻糖基轉移酶 1。O-巖藻糖糖基化的另一種機制涉及 GDP-巖藻糖蛋白O-巖藻糖基轉移酶 2 與特定血小板反應蛋白重複序列的融合,然後透過新增葡萄糖選擇性地延長。有趣的是,這兩個催化反應都發生在內質網中,而不是糖基轉移酶在高爾基體中的傳統定位。
C-甘露糖基化
[edit | edit source]C-甘露糖基化是一種獨特的糖基化形式,其特徵是 α-甘露吡喃糖與色氨酸的吲哚第二碳的共價結合。由於其驚人的特異性,這種糖基化形式直到 1990 年代初期才被表徵,因此在細胞過程中的功能方面,它仍然是一種知之甚少的機制。

GPI 錨定
[edit | edit source]
這些膜結合蛋白在大多數真核系統中都很普遍,它們的作用是調節細胞表面分子的釋放和膜分子的交換。具體來說,它們在酶和抗原分子的識別以及受體介導的訊號轉導通路中起著至關重要的作用。註定要錨定在膜表面的蛋白質首先在其羧基末端(C 端區域)附著到磷酸二酯連線系統。這包括磷酸乙醇胺吸附到三甘露糖基-非乙醯化葡萄糖胺的核心上。然後將這種葡萄糖胺結構連線到磷脂醯肌醇,磷脂醯肌醇最終透過另一個磷酸二酯連線體附著到脂質雙層。膜結合蛋白質的溶解是透過磷脂酶 C 裂解磷脂醯肌醇鍵來實現的。
另見
[edit | edit source]參考文獻
[edit | edit source]蛋白質 C-甘露糖基化:事實和問題 A. Furmanek & J Hofsteenge,波蘭生物化學學報 200 47(3): 781-789
哺乳動物粘蛋白型 O-糖基化位點的預測、保守性分析和結構表徵 K. Julenius 等人,糖生物學 2005 15(2):153-164 [1]
蛋白質酶促轉化為糖蛋白,D.D. Pless,W.J. Lennarz,美國國家科學院院刊 74, 134-138 [2]
蛋白質糖基化:泰坦的衝突,B. Imperiali,化學研究帳目 30, 452-459
插入去垢劑膠束中的保守蛋白質 GPI 錨定核心的結構和動力學。F. Chevalier,糖生物學 16; 10, 969-980 [3]
糖基-磷脂醯肌醇錨定的膜蛋白,D. Brown,美國腎臟病學會雜誌 3, 895-906 [4]
使用四極杆飛行時間質譜法鑑定血清反應因子 O-N-乙醯葡萄糖胺修飾的新位點,Chalkley,R.J,分子與細胞蛋白質組學,2, 182-190 [5]
克氏錐蟲中 O-N-乙醯葡萄糖胺連線的聚糖的生物合成,Previato,J.O,生物化學雜誌,273;24,14982-14988 [6]
Crit Rev Biochem Mol Biol.1998 ; 33 (3):151-208 9673446 (P,S,E,B)
O-連線糖基化的概念和原理。 P Van den Steen 等人。 比利時魯汶大學雷加研究所。
作者
[edit | edit source]Jared Carter
Aubrey Bailey
- ↑ 哺乳動物粘蛋白型O-糖基化位點的預測、保守性分析和結構表徵 K. Julenius等,糖生物學2005 15(2):153-164
- ↑ 可用地址 : <http://www.cryst.bbk.ac.uk/pps97/assignments/projects/emilia/Other_functions.HTM>
審稿人:Corey W.
翻譯後修飾 (PTM) 影響許多蛋白質序列的發現導致蛋白質組學關注點從序列轉向蛋白質的結構和功能特性。當蛋白質發生糖基化時,意味著糖被新增到氨基酸鏈中,這會影響蛋白質的結構、溶解度和穩定性。這些修飾在“胚胎髮育、免疫反應以及涉及糖-糖或糖-蛋白質特異性識別的細胞間相互作用”中也發揮作用。糖基化是一種越來越受關注的PTM,因為它可以被用作生物標誌物,這在檢測前列腺癌和乳腺癌以及一些神經退行性疾病方面變得十分有用。本文重點關注比較糖蛋白質組學及其應用。
- 生物標誌物
- 生物標誌物,或生物標記,一般是指用作生物狀態指示物的物質。(來源:http://en.wikipedia.org/wiki/Biomarker)
- 凝集素
- 凝集素是糖結合蛋白,對糖基團具有高度特異性。(來源:http://en.wikipedia.org/wiki/Lectin)
- MALDI MS
- 基質輔助雷射解吸電離 (MALDI) 是一種用於質譜的軟電離技術,允許分析生物分子(如蛋白質、肽和糖)以及大型有機分子(如聚合物、樹狀大分子和其他大分子),這些分子在用更傳統的電離方法電離時往往很脆弱且會發生斷裂。(來源:http://en.wikipedia.org/wiki/Matrix-assisted_laser_desorption/ionization)
- TOF MS
- 飛行時間質譜是一種質譜方法,其中離子被已知強度的電場加速。這種加速會導致離子具有與任何其他具有相同電荷的離子相同的動能。離子的速度取決於質荷比。隨後粒子到達已知距離處的檢測器所需的時間被測量。這個時間將取決於粒子的質荷比(較重的粒子達到較低的速度)。根據這個時間和已知的實驗引數,可以找到離子的質荷比。(來源:http://en.wikipedia.org/wiki/Time-of-flight_mass_spectrometry)
- 在處理蛋白質時,在分離過程中存在動態範圍問題。最有趣的蛋白質往往是那些濃度低的蛋白質。糖蛋白是總細胞蛋白的一個子集,可以透過使用凝集素選擇性地富集。這些蛋白存在於植物、真菌、細菌和動物中,對碳水化合物具有獨特的親和力。凝集素親和層析 (LAC) 基於每種凝集素對不同寡糖的可逆、特異性相互作用。這種方法可以富集糖蛋白和糖肽,還可以區分聚糖結構以及同一蛋白質的糖型。使用固定在瓊脂糖固體塊上的凝集素,可以在柱中分離糖蛋白。然後使用肽-N-糖苷酶 (PNGase) 用18O標記 N-糖基化位點。這種方法被稱為同位素編碼糖基化位點特異性標記 (IGOT)。質譜儀可以清楚地區分標記的肽和未標記的肽。這種方案的主要缺點是,可能發生對非糖基化蛋白質的一些非特異性結合。
- 這些蛋白上發現的功能基團可能會揭示更多關於訊號通路的資訊,並可能告訴我們更多關於某些疾病的機制和發病機理。分離技術的應用也將擴充套件動態範圍,使我們能夠靶向蛋白質的小子集,這將簡化系統,並允許發現更多異常糖基化的位點。
- 已知糖基化譜在腫瘤發生的發生時會發生變化。作者提供了一個例子,其中 N-乙醯氨基葡萄糖基轉移酶 V(負責 N-連線聚糖的分支)活性的上調與幾種癌症的腫瘤侵襲和轉移有關。從這種關於癌細胞中差異糖基化的知識,我們可以將一些糖蛋白作為生物標誌物發現和診斷的靶點。在更著名的生物標誌物(如前列腺特異性抗原 (PSA))的情況下,我們最終可能能夠改變異常位點以用於免疫治療。
- 已經表明,異常糖基化可能是阿爾茨海默病病因的一部分。特定蛋白質摺疊的變化使位點更容易發生磷酸化,但更難發生去磷酸化。還發現,Reelin(一種用於細胞結構組織的蛋白質)中的糖模式會發生變化,導致上調!
獲得前面提到的結果曾經很困難,但隨著結構糖生物學與質譜技術的進步,實驗變得更容易進行。這些新技術允許更詳細地觀察糖基化修飾。隨著更多生物標誌物的發現,人們希望這些型別的分析將成為正常診斷程式的一部分。將這些新型蛋白質組學付諸實踐將闡明基本的生物過程。這些技術還有可能透過幫助我們發現這些罕見的蛋白質子集來解釋某些疾病。
比較糖蛋白質組學方法和應用,X. Wei,L. Li,功能基因組學和蛋白質組學簡報第 8 卷第 2 期,104-113 [7]


