科學:小學教師指南/物質的構成要素
物質是任何具有質量並佔據空間的物質。我們能觸碰和看到的日常物體最終都是由原子組成的,原子本身又是由相互作用的亞原子粒子組成的,例如質子、中子和電子(這些粒子本身又是由更小的粒子組成的!)。物質通常包括原子以及由各種原子以分子形式相互連線而成的任何物質。單個原子太小,我們無法看到或操作,但如果我們有數萬億個相同型別的原子(例如純金或純氦的樣本),我們可以研究這種元素的性質。我們已經瞭解了不同元素的性質,並將它們整理成“元素週期表”(見下文)。
兩個或多個相互連線的原子被稱為分子,我們將在後面討論它們如何相互連線。一個分子的性質可能與它所組成的原子完全不同(氫氣是一種氣體,氧氣也是一種氣體,但如果你將兩個氫原子與一個氧原子結合起來,你將得到 H2O(水),它的性質與它所組成的元素大不相同)。
化合物是許多相同型別的分子。因此,一杯水是水分子的一種化合物,一勺糖是糖分子的一種化合物。蛋殼主要是碳酸鈣化合物(許多碳酸鈣分子相互連線)。
混合物僅僅是不同事物的混合物!因此,如果你將糖和水混合在一起,那麼你將得到一種混合物,而不是兩種化合物。對於液體混合物,我們可以使用溶液這個詞,它由溶劑(液體部分,例如水)和溶質(溶解在溶劑中的固體部分——例如糖)組成。
你周圍的空氣是不同氣體分子(氮氣、氧氣、二氧化碳、水蒸氣和其他氣體)的混合物。將化合物混合在一起很容易得到混合物;從混合物中分離出化合物比較棘手,但可以做到:例如,你可以取你的糖水混合物,將其煮沸,收集水蒸氣,你將再次得到純水的化合物,因為糖會留下來(如果你讓它完全乾燥,你應該會得到純糖化合物)。
每個原子都由一個原子核和一個或多個以極快的速度繞著原子核運動的電子組成。原子核由一個或多個質子和通常數量相似的中子組成(例外是氫,它只有一個質子,沒有中子)。質子帶正電荷,每個質子的質量為 1 個原子質量單位 (AMU);電子帶負電荷,幾乎沒有質量(5/10,000 個 AMU),中子不帶電,質量與質子相似。如果質子和電子的數量相等,則該原子是電中性的。如果一個原子擁有比質子多或少的電子,則它分別帶負電荷或正電荷,被稱為離子。質子的數量決定了原子的型別:一個氫原子總是擁有 1 個質子,一個碳原子總是擁有 6 個質子。質子的數量只能在核反應中改變,如果質子數量發生改變,則該原子將變成另一種元素。相反,電子的數量可以很容易地改變,具體取決於原子以及它所接觸的其他型別的原子。由於電子位於原子的外部,所以它們與其他原子發生相互作用,並且正是電子負責元素的大部分化學性質。中子的數量不太可能改變,即使改變了,該原子的化學性質也不會改變(具有相同元素但中子數量不同的原子被稱為同位素,它們可能是放射性的,並且可能有多種用途)。一個原子的質量有 99.95%集中在原子核中——與質子和中子相比,電子非常小,幾乎沒有質量。在元素週期表中,原子質量顯示在每個方格的左下方,是所有質子、中子和電子的總和。
原子中粒子的排列很有趣:質子和中子緊密地堆積在一起,形成一個叫做原子核的小區域(不要將其與細胞核混淆——它們是同一個詞,但不是同一個東西)。由於正電荷相互排斥,因此質子能夠如此緊密地聚集在原子核中(以及中子)很奇怪。關於將原子核結合在一起的“強核力”還有很多東西需要學習,但對於我們的課程,我們只說它是宇宙中最強的已知力!它也是在核反應中必須打破的力!電子透過“電磁力”被吸引到原子中,電磁力更容易理解(並且負責磁力和電)並且弱得多。電子與原子核之間的距離實際上相當大:如果一個原子的原子核像高爾夫球一樣大,如果你將這個高爾夫球放在足球場的中央,電子就像微小的沙粒,以極快的速度繞著足球場的邊緣轉圈!換句話說,每個原子都大部分是空的空間!如果你把身體中所有原子中的所有空的空間都去掉,你就可以把你整個身體塞進這封信頂部的“i”上的墨水中!(令人驚奇的是,那個小點仍然會和你一樣重,因為它仍然包含你所有質子和中子的質量!)。
我們實際上永遠無法準確地知道電子的位置,因為它們太小,而且運動速度太快,但它們往往停留在“電子軌道”中,這些軌道就像原子核周圍的不同雲層。不同的原子,擁有不同數量的電子,擁有不同形狀的雲層。最外層的雲層(或“殼層”)被稱為“價電子層”,該殼層中的電子被稱為“價電子”。這些電子與其他原子的價電子相互作用,電子可能會從一個原子轉移到另一個原子,或者在兩個原子之間共享(化學鍵將在其他地方討論),或者只是相互排斥。當你用拳頭敲打桌子時,你的拳頭和桌子似乎都非常堅固,但實際上,你只是感受到了數萬億個電子在你的手原子周圍嗡嗡作響,這些電子排斥著數萬億個電子,這些電子在你的桌子原子周圍嗡嗡作響。
原子非常小;典型的尺寸約為 100 皮米(十億分之一米)。這不僅是我們無法看到的尺寸,也是我們無法用顯微鏡看到的尺寸!為了幫助你直觀地理解這一點,請探索這個“宇宙尺度”動畫(需要 Flash 才能執行;如果你無法訪問它,請觀看此影片)。注意圓圈,因為每次你放大或縮小經過一個圓圈時,它都代表著 1000 倍的小或 1000 倍的大!放大,直到你找到原子,然後繼續放大,直到你找到質子、中子,最終找到電子。如果你繼續放大,你會發現各種奇怪的粒子,因為即使質子和中子也是由其他東西組成的。如果你向另一個方向移動,你會看到越來越大的物體、行星、星系等等。我們將把非常大的東西留到下一章!
公制系統非常有用,以至於它發明後被世界上幾乎所有國家採用(美國是例外!)。即使在美國,所有科學家都使用公制系統。為什麼?好吧,舊的英制系統很不一致:1 英尺有 12 英寸,1 碼有 3 英尺,但 1 磅有 16 盎司,1 杯有 8 盎司……這可能會讓人非常困惑。在過去,它是實用的——1 英寸大約是你拇指尖的大小。1 英尺大約是(不出所料)你腳的大小。公制系統完全基於十、百和千的乘除,因此,計算出 453 釐米等於 4.53 米比計算出 453 英寸等於 37 英尺 9 英寸容易得多。公制系統的另一個好處是,它使用標準的字首,無論你討論的是長度、重量、體積,還是其他任何東西。
要更好地理解公制系統,只需知道對於任何你想要測量的量,都存在一個標準單位。對於質量,它是克;對於體積,它是升;對於計算機資料,它是位元組;對於長度,它是米。一旦你瞭解了標準單位,你就可以使用字首作為一種簡單的方法來討論比標準單位大得多或小得多的東西。例如,我可以以米為單位測量我的鉛筆,但稱它為 0.12 米有點尷尬,而我可以稱它為 12 釐米。
對於人們來說,理解這些字首可能會很困難的一件事是,他們可能不習慣使用科學記數法,科學記數法涉及指數。100 = 10 X 10 = 102。100,000 = 10 X 10 X 10 X 10 X 10,或 105。你可能注意到 105 後面跟著一個 1 和 5 個零。這很簡單,但有時很難去想比 10 小的東西。例如,1/1000 = 10-3。如果你用計算器將 1 除以 1000,你會得到答案 0.001。你可能意識到,對於 10-3,你需要將小數點向右移動 3 位才能得到“1”,或者你可能更喜歡這樣想:“我寫下 1,然後將小數點向左移動 3 位。”在公制系統中,最重要的字首是我們乘以或除以 1000 的情況。例如,1 米除以 1000 = 1 毫米(“毫”表示“千分之一”),簡寫為 1 mm。如果我們乘以 1000,我們得到 1 公里(“千”表示“一千”),簡寫為 1 km。我們可以對體積做同樣的操作,得到 1 mL(毫升)或 1 kL(1 千升)。我們可以將 1 毫米分成 1000 個更小的部分。每一個部分都是 1 毫米的千分之一,或者 1 米的百萬分之一。為此,我們使用字首“微”,所以我們會說 1 微米(它在簡寫中用希臘字母小寫 µ 表示,它看起來像 μ(所以 1 微米寫成 1 µm)。如果我們將 1 微米分成 1000 個部分,我們得到 1 奈米!
固體、液體、氣體
[edit | edit source]    | |
| 物質通常被分類為三種經典狀態(固體、液體和氣體),有時會新增等離子體作為第四種狀態。從上到下:石英(一種礦物固體)、水(液態)、二氧化氮(一種棕色氣體)和等離子球(等離子體)。 |
外太空大部分是空的,在“非空”的星系(數量高達數千億個!)之間存在著巨大的距離。但無論哪裡有星系,也都會有由恆星製造的物質組成的行星。就我們而言,**物質**是指由原子組成的物質(因此不包括光子、聲波、熱量或其他形式的能量,即使物質和能量透過愛因斯坦方程聯絡在一起)。

物質存在於三種主要狀態:固體、液體和氣體。一些物質,包括水,可以存在於這三種狀態。它處於哪種狀態是溫度和壓力等變數的函式。許多元素在室溫下是固體,需要極高的熱量才能熔化成液體(例如鐵)。其他元素在室溫下是氣體(例如氮氣或氧氣),需要極低的溫度才能凝結成液體(液氮在 -196 攝氏度(-321 華氏度)的極低溫度下沸騰成氣體)。
在固體中,例如岩石、桌子或玻璃窗,固體內的原子仍在振動和抖動,但它們不能自由移動,因為它們與周圍的其他原子緊密結合在一起。不同的固體具有不同的特性,這取決於哪些型別的原子結合在一起。因此,光滑的河石渾濁而光滑的金屬閃亮,這是分子本身的函式。
在液體中,分子自由移動,以隨機模式相互碰撞。即使在一杯放在桌子上一個小時,靜止不動的水中,其中的水分子也處於不斷運動中。你可以透過滴入一滴食用色素來證明這一點——食用色素不會停留在一個地方,而是會迅速擴散,這要歸功於水分子不斷的運動。熱量實際上是衡量分子運動或振動速度的指標。因此,如果你把一杯水放進冰箱,用微波爐加熱另一杯水,然後在兩杯水中都滴入一滴食用色素,你就能看到不同分子運動速度的影響。
在氣體中,分子比液體中分佈得更稀疏。事實上,無論容器的大小或形狀,氣體分子都會均勻地擴散並以均勻的壓力充滿容器。與液體或固體不同,氣體很容易壓縮。當你壓縮氣體時,分子會被迫更靠近在一起。氣體壓縮得越多,反作用於容器的壓力就越大(通常以每平方英寸磅數或 PSI 衡量)。這種壓力對於輪胎很有用(一輛普通汽車輪胎的充氣壓力約為 35 PSI),或者用壓縮空氣罐噴射電子產品,或者能夠揹著大量空氣進行水肺潛水。當氣體減壓時,壓力下降,溫度也下降。你可能感覺到壓縮空氣罐在噴射了幾秒鐘後變得很冷。這種基於壓力的溫度變化用於家庭和汽車冷卻系統。空調有一個壓縮機來加熱氣體,這種熱量會釋放到環境中,然後讓氣體膨脹和冷卻一些管道,然後將空氣吹過這些管道,將一股冷空氣帶入家中或車內。
元素的誕生
[edit | edit source]每顆恆星發出的光和熱都是核聚變反應的產物。我們的太陽透過氫原子核的核聚變生成氦來產生能量。在太陽的核心,每秒會聚變 6.2 億公噸的氫。在四個氫原子核聚變成一個氦原子核的過程中,0.7% 的質量以 α 粒子的動能或其他形式的能量的形式帶走,例如電磁輻射,遵循愛因斯坦著名的方程 E = mc2(能量等於質量乘以光速的平方)。核反應中釋放的能量比化學反應中釋放的能量**大得多**,因為將原子核結合在一起的結合能比將電子與原子核結合在一起的能量大得多(記住,強核力是我們知道的力中最強的力)。為了說明這一點,如果你能聚變一杯簡單水中的氫原子,你將有足夠的能量讓你的汽車行駛 10,000 英里!因此,我們周圍的所有物質中都蘊藏著巨大的能量,但大多數能量都不可用,因為分解原子核(裂變)或將它們撞擊在一起(聚變)非常困難。恆星能夠進行聚變,因為它們的質量非常大(參見宇宙的尺度),因此引力在恆星的核心產生了巨大的壓力和熱量。氫是最小的原子(只有 1 個質子),也是宇宙中最常見的元素。氫是恆星的基本燃料,至少在它們年輕的時候(對於恆星來說,“年輕”可以是數十億年)。氦有 2 個質子,2 箇中子(記住氫沒有中子)。一個氦原子的質量大約比四個氫原子核的質量少 0.7%(因為一小部分質量在聚變反應過程中轉化為了能量)。如果另外兩個氫原子與氦原子發生聚變,它們可以形成一個有 3 個質子和 3 箇中子的原子,這就是鋰。換句話說,元素是由其擁有的質子數來定義的,所有比氫重的元素都是在恆星中產生的。令人驚歎的是,我們星球上所有固體物體(包括你)都是由在遙遠恆星中誕生的原子組成的!最重的元素是由一顆更重的恆星在其生命末期發生劇烈超新星爆炸時發生的聚變合成的(隨著一顆恆星的衰老,它會消耗掉輕元素,並繼續進行更重元素的聚變——一次燃燒的灰燼成為下一次燃燒的燃料)。然後超新星爆炸,更重的元素像宇宙塵埃一樣散佈到各個方向。一些塵埃和晶體開始在巨大的宇宙雲中聚整合團。在雲的中心,可能形成一顆新的恆星,行星也可能隨著碎片越來越密集地聚整合團而形成。據信,我們的地球與我們太陽系中的其他行星一起,在大約 45.4 億年前的 1000-2000 萬年的時間裡形成的。
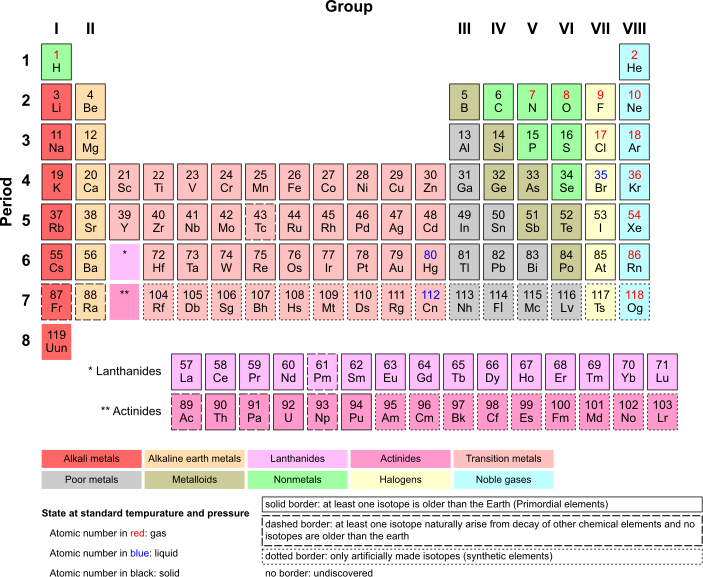
如何整理元素:元素週期表
[edit | edit source]我們生活在一個由鐵、鎳、碳、矽和許多其他元素組成的星球上。一些元素很常見(比如氧氣),而另一些元素則很稀有(比如黃金)。化學家們在研究元素的過程中,用各種方法整理了他們的知識。其中最實用的方法之一叫做元素週期表。在這個表格中,原子是按照質子數依次排列的:氫的原子序數為 1,因為它有 1 個質子,氦的原子序數為 2,因為它有 2 個質子,銀的原子序數為 47,因為它有 47 個質子。你明白了吧。當你從左到右,從上到下移動時,元素會越來越重。原子序數只告訴我們質子的數量。原子質量略有不同——它包括質子和中子的總重量(技術上它包括電子,但它們的重量可以忽略不計)。碳有 6 個質子和 6 箇中子,原子質量為 12.011。它不等於 12.000 的原因是,有時碳原子會多出一箇中子(所以叫做碳13),或者多出兩個中子(叫做碳14)。碳13 或碳14 同位素很少,但它們的數量足夠多,以至於任何純碳塊的重量都會比只由碳12 原子組成的碳塊略重一點。[旁註:碳14 是由 CO2 在地球大氣層高處被離子轟擊而產生的。它以已知的速率緩慢衰變為碳12。生物以恆定的速率吸收碳14,當它們死亡時,它們就不再吸收碳14 了。考古學家和古生物學家可以測量殘留的碳14 的數量,並估計某個東西的年代——這被稱為碳年代測定法。]
關於元素週期表,很重要的一點是,各列由具有相似化學性質的原子組成,因為它們具有相似的價電子。最左側的列(第一族,包括 H、Li、Na、K 等)在外層都有 1 個電子。下一列(第二族)在外層都有 2 個電子。這條規則在中間部分的金屬中有些失效,原因我們不再討論——它們在外層大多有 2 個電子。然後,在第 13 列(硼族)中,外層有 3 個電子。接下來是碳族,外層有 4 個電子。然後是 5 個、6 個、7 個外層電子,最後是右邊的最後一列——外層有 8 個電子(氦除外,將在其他地方解釋)。為什麼這很重要?這很重要,因為元素的化學行為很大程度上取決於外層有多少個電子。這將在關於化學反應和鍵的章節中更詳細地討論,但現在我們說“每個原子的夢想都是擁有一個充滿電子的外層”。(沒錯,原子不做夢,但那比說“如果原子的價層充滿電子,它們就會達到最大穩定性”更有趣)。最右側(第 18 族)的外層都完整、充滿電子。它們被稱為“惰性氣體”,以單個原子的形式漂浮在周圍,不被任何其他原子吸引,也不與任何其他原子發生化學反應。正如我們將看到的,所有其他列都準備以各種方式起作用。
在下方的簡化元素週期表中,您將看到每個元素的單字母或雙字母符號,原子序數(指該元素每個原子中的質子數),以及元素的排列方式:分成族(列)和週期(行)。完整的元素週期表可以在此連結中檢視,該連結提供了關於每個元素的更多資訊。如果您想以一種有趣的方式瞭解更多關於任何特定元素的資訊,請觀看來自英國諾丁漢大學的週期影片中的一些有趣內容(該網站上有真正的瘋狂科學家!)

下一章:化學反應