感覺系統/疼痛生理學
疼痛被國際疼痛研究學會 (IASP) 定義為“與實際或潛在的組織損傷相關的令人不快的感覺和情緒體驗,或用這種損傷來描述”。此外,疼痛也是一種複雜的感覺通路,對生存至關重要。神經系統中檢測可能導致組織損傷的刺激的機制對於觸發保護組織免受當前或進一步損傷的行為過程是必不可少的。這些刺激包括強烈的機械力、極端的溫度和暴露於化學物質或缺氧。
一般來說,疼痛可以分為兩類:急性疼痛或慢性疼痛。
急性疼痛的典型特徵是突然發作,持續時間少於六個月。它的潛在病理學通常很容易確定,因為急性疼痛是區域性的,並透過與其相關的組織損傷來定義。此外,急性疼痛通常隨著組織癒合而消退。
相反,慢性疼痛超過了正常的恢復時間,並在正常的癒合過程發生後持續存在。它可能表明或可能不表明持續的組織損傷,並且通常與神經或心理反應功能障礙的啟用相關。許多患有慢性疼痛的患者有長期的治療失敗史(即藥物嘗試無效)並表現出常見的副作用,如抑鬱、憤怒、沮喪、活動水平下降或睡眠減少。
但是疼痛也可以根據引起疼痛的損傷型別進行分類。然後,兩大類是:由組織損傷引起的傷害性疼痛和神經性疼痛,神經性疼痛是由於神經損傷引起的。表 1 列出了典型子類別以及特徵和機制。一個廣為討論的第三類是精神性疼痛,它通常源於組織或神經損傷,但由該損傷引起的疼痛由於心理因素(如恐懼、抑鬱、壓力或焦慮)而加重或延長。疼痛僅源於心理狀況的情況很少見。
| 疼痛型別 | 特點 | 機制 |
|---|---|---|
| 傷害性疼痛 - 體性疼痛(組織損傷) - 內臟性疼痛 - 炎症性疼痛(肌肉骨骼) |
持續性或痙攣性疼痛,定位不良 |
內臟擴張 與區域性炎症相關 |
| 神經性疼痛 - 功能性疼痛(FM,丘腦綜合徵,...) |
CNS 中興奮性或抑制性機制的失調 |

(基於 ScoreUSMLE (2015)[2])
要理解疼痛的生理學,最簡單的方法是遵循從感覺受體到大腦的傷害感受訊號通路。需要特別注意中樞神經系統 (CNS) 中不同步驟中傷害感受訊號的整合和調節。疼痛是指感覺的感知,而傷害感受(拉丁語 nocere,“傷害”)是指觸發的感官過程。強烈的機械力或極端溫度等有害刺激由稱為傷害感受器的神經元檢測到,這些神經元將這些刺激轉化為電訊號。然後,這些訊號透過初級傳入神經纖維傳導到脊髓背角。在那裡,初級神經元與次級神經元建立突觸接觸,次級神經元立即在脊髓中交叉,然後形成脊髓丘腦束和脊髓網狀束。透過這些束,投射被髮送到丘腦,傳入神經元隨後在那裡進行第二次突觸。第三級神經元通向體感皮層,體感皮層參與疼痛的感覺質量,包括強度、持續時間和位置。

(基於 Hasudungan (2013) [3])
傷害性刺激會引發一系列事件。首先,一堆促傷害感受的炎症物質,包括鉀、緩激肽、組胺和 P 物質,將在損傷附近的周圍釋放(表 2)。這些物質會導致痛覺過敏,即對疼痛的敏感性增加,可以測量為病變及其周圍的疼痛閾值降低。
| 物質 | 來源 |
|---|---|
| 鉀 (K+) | 受損細胞 |
| 血清素 | 血液(血小板) |
| 緩激肽 | 血液(血漿) |
| 組胺 | 肥大細胞 |
| 前列腺素 | 受損細胞 |
| 白三烯 | 受損細胞 |
| P 物質 | 初級神經傳入纖維 |
接下來,稱為傷害感受器的遊離神經末梢將被有害刺激啟用。它們將刺激轉化為電訊號,然後透過傳入神經纖維傳遞到脊髓背角。

(基於 Marchand (2008)[1])
傳入纖維分為三組:Aβ 纖維、Aδ 纖維和 C 纖維。Aβ 纖維通常傳導非傷害性訊號,但在此列出,因為它們參與疼痛調節,如後文所述。不同傳入纖維的特徵列於下表。
| Aβ 纖維 | Aδ 纖維 | C 纖維 | |
|---|---|---|---|
| 位置 | 皮膚 | 皮膚 | 皮膚、肌肉和 內臟器官 |
| 直徑 | 6 至 12 µm 有髓鞘 |
1 至 5 µm 有髓鞘 |
0.2 至 1.5 µm 無髓鞘 |
| 傳導 | 35 至 75 m/s | 6 至 30 m/s | 0.5 至 3 m/s |
| 作用 | 輕觸, 本體感覺 |
溫度, 傷害感受 |
傷害感受 (機械性,熱性 |
直徑和髓鞘的增加會提高刺激向脊髓的傳導速度。Aδ 纖維相對快速地傳導傷害性訊號,這就是為什麼它們負責傷害性反射(例如,如果你觸控到熱的東西,你會很快把手縮回來)以及疼痛的尖銳定位。相比之下,C 纖維的傳導速度較慢(無髓鞘,直徑小),因此會導致持續時間較長、鈍痛、沒有定位的疼痛。
脊髓中的次級神經元
[edit | edit source]
(基於 Hasudungan (2013)[3])
傳入神經纖維在脊髓背角與次級神經元發生第一個突觸接觸。此外,非傷害性和傷害性傳入纖維在該連線處與重要的興奮性中間神經元網路和疼痛神經遞質(包括 P 物質或穀氨酸)發生突觸相互作用。這些在傷害性訊號投射到中樞神經系統高階中樞之前對其進行調節。次級神經元沿著兩條主要通路向上行進:脊髓丘腦束和脊髓網狀束。這兩條通路在進入水平的幾個節段內交叉到脊髓的對側。在脊髓丘腦束中,次級神經元直接上升到丘腦,而在脊髓網狀束中,神經元在通向丘腦之前再次在網狀結構中突觸。網狀結構位於腦幹,參與廣泛的活動,包括注意力和意識。因此,人們認為它會影響對疼痛的注意水平和情緒反應的變化。
從傷害感受到疼痛
[edit | edit source]只有當傷害性訊號到達皮層時,才能體驗到疼痛。因此,沿著脊髓向上行進的神經元最後一次在丘腦中突觸。從那裡,第三級神經元將傷害性資訊引導到皮層的不同結構:體感皮層(SI 和 SII)主要參與疼痛的感官辨別,而前扣帶皮層 (ACC) 和島葉皮層 (IC) 與疼痛的情感成分相關。
在體感皮層中,傷害性資訊和正常的軀體感覺資訊匯聚在同一個皮層區域。因此,可以處理關於疼痛位置和強度的資訊,形成區域性疼痛感。這種身體的皮層表示在潘菲爾德小人中描述。
疼痛感知的調節
[edit | edit source]疼痛是一個動態現象,每個人都有不同的感知。其原因是,傷害性訊號不僅傳遞到皮層,而且在中樞神經系統內的多個層次上受到調節。這種調節包括來自腦幹、自主神經系統以及負責疼痛情緒成分 (ACC 和 IC) 和認知成分 (SI 和 SII) 的皮層結構的興奮性和抑制性機制。
這裡,將只討論抑制性內源性調節機制。它們對於理解治療疼痛的可能性至關重要。為了更好地理解它們的作用,應注意中樞神經系統中的三個調節水平(類似於 Marchand (2008)[1])
- 產生區域性鎮痛的脊髓機制,即對疼痛的麻木。
- 來自腦幹的下降抑制機制,產生對疼痛的瀰漫性抑制。
- 高階中樞效應,要麼調節下降機制,要麼透過重新解釋傷害性訊號來改變疼痛的感知。
脊髓機制:閘門控制理論
[edit | edit source]
閘門控制理論是由 Melzack 和 Wall 在 1965 年提出的[5]。它表明疼痛可以在第一個突觸處被抑制,即在初級傳入纖維和脊髓水平的次級神經元之間。當 C 纖維發出訊號時,它們不僅將有害訊號傳遞給次級神經元,而且還會阻礙抑制性中間神經元。這被解釋為閘門關閉,只有有害訊號被傳遞。另一方面,如果 Aβ 纖維發出訊號,它們會興奮抑制性神經元。因此,次級神經元的啟用不限於有害訊號,這被解釋為閘門開啟。根據 C 纖維和 Aβ 纖維之間相對的發射率,疼痛訊號被阻斷。
閘門控制理論的一個眾所周知的例子是,當你撞到肘部後,當你摩擦它時,疼痛感會減輕。它的優點是不需要進行有害操作,也不需要藥物,同時可以立即調節疼痛。但是,一旦啟用 Aβ 纖維的高頻刺激消失(即,當你停止摩擦肘部時),疼痛水平也不會再減輕。
下降抑制機制:內源性阿片類物質
[edit | edit source]很早就已經知道鴉片及其衍生物(如嗎啡和海洛因)具有止痛作用。在 20 世紀 60 年代和 70 年代,發現了它們的受體,主要位於腦幹的導水管周圍灰質 (PAG) 和腹側延髓 (RVM) 以及脊髓中。這意味著,神經系統會產生類似的化學物質來內源性地調節疼痛。血清素和去甲腎上腺素是下降抑制神經系統的主要遞質。這些抑制性通路然後募集脊髓中的中間神經元,從而在身體其他部位產生止痛反應,這也稱為反刺激。這種調節型別的例子不僅包括許多止痛藥,還包括按摩、指壓和針灸。在後兩種情況下,內源性系統是由額外的疼痛觸發的,這就是為什麼它們通常只在嘗試其他調節疼痛的選項後才使用。
高階中樞效應
[edit | edit source]
研究表明,認知操作(如分散注意力、催眠或預期)會影響個體的疼痛感知[6]。關於分散注意力,觀察到與疼痛處理相關的皮層區域(如體感皮層或 ACC 的內側扣帶區域)的活動減少。這種減少是由於對疼痛的注意(這是一個高度顯著的刺激)與有意識地將注意力集中到涉及資訊處理的另一項活動(構成分散注意力)之間的競爭造成的[7]。
此外,研究還證實,對疼痛強度的暗示可以改變與疼痛感知相關的腦部活動。[8] 這些結果支援安慰劑效應可以調節內源性疼痛調節功能的觀點。後來的研究表明,前扣帶回前部(rACC)及其向杏仁核和導水管周圍灰質(PAG)的投射的活動增加。這一觀察結果表明,安慰劑效應起源於rACC。然而,它會透過PAG調節有害刺激傳遞神經元活動的能力來影響疼痛感知。杏仁核對該回路的影響來自其在刺激情緒解釋中的作用。它將允許透過無意識的條件作用過程來調節疼痛,而不僅僅是透過源自rACC的意識預期[9]。
幻肢痛
[edit | edit source]歷史
[edit | edit source]被稱為幻肢痛和幻肢感覺的現象在16世紀就已經為人所知。法國軍醫安布魯瓦·帕雷是第一個在1551年對幻肢痛和幻肢感覺進行醫學記錄的人。

“對於那些患者來說,在截肢手術很長時間以後,他們仍然說他們在截肢部位感到疼痛。他們對此強烈抱怨,這對於沒有經歷過這種情況的人來說是值得注意的,甚至令人難以置信”。[10]
1830年,蘇格蘭神經學家查爾斯·貝爾在《人體神經系統》中發表了對這種現象的描述。然而,直到1871年,美國軍醫西拉斯·韋爾·米切爾才引入了“幻肢痛”這個詞。他首次對許多截肢者經歷的術後“幽靈”感覺進行了現代描述。

“成千上萬個幽靈肢體困擾著同樣多的好士兵,不時折磨著他們,這幾乎是一種悲劇,一種可怕的事情……當……肢體存在的強烈感覺使人做出一些努力時,這種努力的失敗會突然提醒他自己的損失”。[10]
幻肢感覺和幻肢痛之間的差異
[edit | edit source]幻肢痛和幻肢感覺是密不可分的。但是,它們並不相同,因此必須將它們區分開來。
幻肢感覺包括本體感覺,如肢體長度、周長或姿勢的感覺;運動感覺,如自發或有意運動;以及外部感覺,如刺痛、瘙癢或壓迫感[11]。這些感覺可能出現在截肢後、先天性肢體缺失或肢體感覺消失後,例如脊髓損傷[10]。研究表明,90%至98%的患者都會經歷幻肢感覺[12][13][14]。大約25%至40%的幻肢感覺患者會經歷一種特殊現象,稱為縮短,即感覺幻肢隨著時間的推移逐漸縮短,直到它連線到殘肢或進入殘肢[14][15]。
幻肢痛是可變的,可以描述為灼痛、刺痛或跳痛等感覺[16]。此外,還會出現非常複雜的疼痛感覺,例如感覺幻肢扭曲或指甲深深地刺入幻肢手掌[11]。大多數人在截肢後會經歷幻肢痛,患病率在55%到85%之間[17][10]。在許多情況下,殘肢和幻肢都會疼痛,難以區分兩者。
研究還表明,幾乎所有經歷幻肢感覺的截肢者都會遭受幻肢痛;反之則很少見[10]。
| 幻肢感覺 | 幻肢痛 | |
|---|---|---|
| 症狀學 | 本體感覺和運動感覺。 | 灼痛、刺痛或跳痛等感覺。 |
| 起源 | 截肢、先天性肢體缺失或肢體敏感性消失。 | 截肢 |
| 共病症 | 主要與幻肢痛一起出現。 | 很少與幻肢感覺一起出現。 |
流行病學
[edit | edit source]在過去的幾十年中,許多關於幻肢痛和幻肢感覺的臨床研究已經開展,概述了患有該綜合徵的患者中的一些共同趨勢。
幻肢痛的患病率已被證明與截肢水平有關:截肢水平越高,中度至重度幻肢痛的發生率就越高[10]。也有一些跡象表明,在計劃對無痛肢體進行手術截肢的情況下,疼痛的發生率可能低於由於創傷性幻肢喪失或之前存在疼痛的幻肢而造成的疼痛[12]。此外,疼痛通常感覺在幻肢的最遠端,如手部手指或腿部腳趾。據推測,這是因為肢體末端在體感皮層中具有更大的代表性[13][14]。有趣的是,下肢截肢者的幻肢痛患病率遠高於上肢截肢者[10]。
在頻率方面,幻肢痛在一些患者中持續存在,而在另一些患者中,它往往以疼痛發作的形式間歇出現[18]。然而,即使在這些情況下,在兩次發作之間也可能存在持續性疼痛。疼痛發作可能持續幾秒鐘到幾個小時不等。在極少數情況下,患者可能經歷持續數天的發作[17]。

幻肢痛通常在截肢後最初幾天到幾周內開始,但它也可能在截肢多年後開始,由殘肢手術引發[17]。這種疼痛可能會在截肢後持續很多年。然而,不同的臨床研究對幻肢疼痛持續的時間存在分歧。例如,對因血管功能不全而失去肢體的老人患者的研究結果與對因受傷後創傷性截肢的年輕截肢者研究結果不同[10]。然而,幾項研究報告了共同趨勢:只有16%經歷過幻肢痛的人不再遭受這種疼痛,而另有37%的人疼痛明顯減輕,44%的人遭受著同樣的疼痛,而3%的人疼痛隨著時間的推移而加劇[19][17]。另一個共同的基準是,如果疼痛在截肢後六個月仍然持續存在,那麼治療起來就會非常困難[20]。
有趣的是,許多患者經常抱怨截肢前肢體存在的疼痛在幻肢中持續存在。這種疼痛的持續可能是感覺記憶的一種形式。[21]與這些發現相關的是,據報道,幻肢感覺在兒童中比成人中不常見。一種可能的解釋是,在幼童中,身體形象還沒有足夠的時間鞏固。事實上,根據一些研究,幻肢感覺的發生率隨著兒童年齡的增長而急劇增加。[12]
根據一項對 139 名患者進行的研究[18],幻肢痛可以由[17]
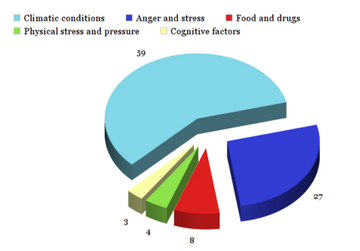
- 氣候條件:59%。其中 55% 歸因於天氣,1% 歸因於季節,3% 歸因於環境溫度。
- 憤怒和壓力:27%
- 食物/藥物:8%
- 身體壓力:4%
- 認知因素:3%。認知因素的例子包括將注意力集中在幻肢上和觀察損傷。
為什麼這些因素會引發幻肢痛將在下一節中闡明。
幻肢痛的來源
[edit | edit source]根據幻肢痛被認為是一種多因素疼痛綜合徵的事實,目前關於幻肢痛病理生理學的理論通常被分為周圍、中樞和心理成分。這三個領域之間有著密切的聯絡。
周圍機制
[edit | edit source]截肢後,細胞分化發生,導致遠端周圍神經退化以及神經瘤的形成 - 神經組織中的生長或腫瘤。[22]

神經瘤由存活的近端神經節段再生形成,可以產生異常放電,導致疼痛持續存在。事實上,在一些研究中,發現與對側肢體相比,殘肢肌肉的活動過度。[23] [13]這種過度活動以細纖維束輕微抽搐甚至整個殘肢痙攣的形式出現。
周圍神經傳導阻滯不能消除疼痛,以及即使透過藥物治療或手術消除周圍神經的異位放電後疼痛仍然可以持續的事實證明,幻肢痛是一種複雜的機制,不僅僅是由於神經瘤的形成。[21]事實上,還有一些額外的周圍機制參與了幻肢痛:血液迴圈影響和交感神經啟用。
a) 血液迴圈影響
[edit | edit source]在低溫下,我們的交感神經系統受到刺激,導致皮膚、手臂和腿部的血管收縮。[24]這反過來會導致殘肢灌注不足,這會增加傷害感受神經纖維的活動,從而增強疼痛的感覺。這是由於缺血和神經元冷卻。[18]這些血管機制是天氣成為幻肢痛主要觸發因素的原因之一。
此外,在一些研究中,已經確定了殘肢中短暫的強烈的肌肉緊張增加與隨後的幻肢痛發作之間的聯絡。[24]機械壓力和強烈的肌肉收縮也可能具有灌注效應,這反過來會導致疼痛加重。此外,灌注效應也可能作為某些食物和藥物(如咖啡)的後果出現,解釋了它們引發疼痛的性質。
b) 交感神經啟用
[edit | edit source]在神經瘤中,交感神經傳出神經末梢可能與傷害感受傳入神經纏繞在一起,直接相互作用並導致交感神經活動增加和幻肢痛加重。[25]
中樞神經因素
[edit | edit source]如前所述,幻肢痛並非僅僅由周圍機制引起。幻肢感覺的複雜性也表明,這些感知涉及更高階的神經結構。[11]
a) 神經矩陣理論
[edit | edit source]解釋中樞神經系統中幻肢痛的主要理論是神經矩陣理論。神經矩陣包括皮層,尤其是初級體感皮層和後頂葉,丘腦和邊緣系統。

該理論假設神經系統中身體的表徵不斷受到感覺輸入的修改,從而創造出神經特徵。在去除身體部位後,神經矩陣的持續存在會在幻肢上產生無痛感,而疼痛則是由於神經矩陣內部的異常重組造成的。更具體地說,神經矩陣在截肢後繼續傳送傳出訊號,而這些訊號的改變可能是導致疼痛的原因。理論上,可以透過消除神經矩陣的傳出訊號,或透過電刺激產生正常的返回訊號來減少疼痛。事實上,一些研究表明,幻肢痛可能與丘腦對截肢肢體的表徵的神經活動和功能有關。這可以透過以下事實證明:腹側尾側丘腦的微刺激在幻肢中產生疼痛感。[21]
雖然神經矩陣假說可以用於描述疼痛的來源,但它不能解釋為什麼緩解幻肢感覺很少減輕幻肢痛,為什麼感覺可以突然消失,以及為什麼並非所有截肢者都會出現幻肢痛。[21]因此,必須考慮其他可能的解釋。
b) 中樞過度反應
[edit | edit source]一些研究表明,在截肢和其他型別的神經損傷後,中樞神經系統可能出現過度興奮狀態。[23] [13]
皮質重組
[edit | edit source]除了過度反應,並且可能是其結果,在截肢後,身體的皮質表徵發生變化。這些變化通常在去神經支配後觀察到,並且在初級體感皮層中尤為明顯。

在靈長類動物和人類中,多項研究發現,截肢後數月,初級體感皮層中與截肢部位相鄰的身體部位的代表區域會擴大幾毫米,幾乎完全佔據了截肢部位的原有區域。 [26] [27] [28] [29] 值得注意的是,這種重組發生的區域在截肢下肢患者中差異更大。這種皮層重組甚至可以在區域性麻醉期間觀察到為短暫的改變。 [30] [31] 以及由於某個身體部位的強化訓練而發生相反的變化。 [32] 這也在運動皮層中發生,可能是由於體感皮層和運動皮層之間強烈的連線。 [33] [34] 直觀地,人們可能會認為這種重排是有益的,因為原本未被利用的皮層區域可以用於身體的實際部位,從而消除身體方案中丟失的肢體,並減少幻肢痛。但這項重組的代價很大,並且觀察到重組程度與幻肢痛強度之間存在正相關關係。 [29] [35] 這些結果讓人們相信,皮層重組實際上是一種適應不良的可塑性,是幻肢痛的原因之一。 [36]
皮層重組是透過三種基本機制介導的
a) 皮層過程
[edit | edit source]對於短期重組,主要機制是揭示相鄰區域之間現有潛在連線。 [31] 假設這種機制是由興奮性和抑制性傳入之間的平衡變化觸發的。 [37] [30] 然而,對於長期重組過程,會形成新的神經連線。因此,在這種情況下,除了功能性變化外,還會發生結構性變化。 [18]
b) 脊髓過程
[edit | edit source]在嚴重或長時間的傷害性刺激的情況下,前面提到的中樞敏化也可能發生在脊髓背角神經元中。這會導致自發活動增加和對非傷害性刺激的反應性增加 [38] [39],從而使疼痛在傷害性刺激消失後很長時間內持續存在。
到目前為止,所有關於截肢引起脊髓變化的研究都來自動物實驗。這些實驗表明,來自殘肢的傳入纖維延伸到脊髓和腦幹的去神經支配區域。 [40] [10]
對燒傷患者的研究也揭示了脊髓神經元在疼痛產生中的作用。這些研究表明,燒傷後,脊髓神經元放電率會增加,導致神經元過度興奮。這種過度興奮不受損傷部位區域性麻醉阻滯的影響。這表明已經產生了敏化或“疼痛記憶”。應用於截肢患者,這表明在手術截肢之前和期間阻滯脊髓可能有助於減少或預防脊髓中的這種敏化過程。 [21]
完全脊髓損傷的人也可能經歷幻肢痛,表明除了周圍神經和脊髓過程外,中樞神經系統的變化也可能參與疼痛的產生。 [10]
c) 丘腦過程
[edit | edit source]除了深部腦刺激(揭示了丘腦對幻肢痛的貢獻)外,關於丘腦在這種情況下所起的作用,人們知之甚少。動物實驗中使用區域性麻醉報告了丘腦中某些身體部位代表的短期可逆重組。 [41]
心理因素
[edit | edit source]正如流行病學部分所述,壓力和憤怒也被認為是幻肢痛的誘發因素。事實上,在一項研究的 74% 受試者中,壓力和幻肢痛之間存在一致且總體緊密的正相關關係。 [18] 這可能是因為心理壓力和生理壓力都具有傷害性作用,包括生理機制,例如交感神經啟用、血管收縮和肌肉緊張,而這些都是誘發機制。許多患者還報告說,幻肢痛可以透過意識來增強甚至觸發,反之,幻肢痛可以透過分散注意力來減輕。 [11] [12]
幻肢痛的治療
[edit | edit source]幻肢痛仍然缺乏有效的治療方法。一些使用的治療方法包括:止痛藥(效果有限)、神經安定劑、抗抑鬱藥、神經阻滯、神經系統刺激(特別是脊髓和殘肢中的神經,但也包括深部腦刺激)、振動療法和殘肢按摩、熱敷、生物反饋和針灸。在某些情況下,會進行手術切除纏繞神經的瘢痕組織。 [42] [43] 另一種流行的療法是使用鏡子,讓患者透過觀察剩餘肢體的反射來“看到”幻肢。與其他療法一樣,這種方法並不完全有效,對許多患者無效。事實上,大約 40% 的人從鏡面療法中沒有獲益。 [44]
疼痛治療
[edit | edit source]非甾體抗炎藥 (NSAID)
[edit | edit source]NSAID 用於治療輕度至中度疼痛,例如頭痛、扭傷或牙痛。NSAID 具有抗炎作用,因此對於治療關節炎和術後疼痛等損傷或疾病也十分有效。NSAID 透過發揮 COX-2 抑制劑的作用。它們直接靶向環氧合酶-2 (COX-2),這是一種產生前列腺素的酶,前列腺素負責炎症和疼痛。它們也被證明對減少癌症和癌前病變的發生以及抑制精神疾病(如抑鬱症和精神分裂症)中的炎症性神經退行性病變途徑具有積極作用。 [45] [46] 然而,它們具有嚴重的副作用。NSAID 會顯著增加心臟病發作和中風的風險。
屬於 NSAID 類別,抑制 COX-2 以及前列腺素的產生,包括一系列藥物
布洛芬
[edit | edit source]
布洛芬屬於 NSAID 類別。它透過抑制環氧合酶 COX-1 和 COX-2 來阻止前列腺素的產生。它用於治療疼痛、發燒和炎症。它的半衰期在 1 到 3 小時之間。 [47]
萘普生
[edit | edit source]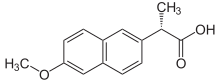
萘普生是一種非甾體抗炎藥,用於治療疼痛、發燒和炎症,其作用時間相對較長,為 8-12 小時。[48]

乙醯水楊酸是一種非甾體抗炎藥,屬於水楊酸鹽類。它可以治療疼痛、發燒和炎症,並抑制血小板的聚集。其作用機制與其他非甾體抗炎藥類似。乙醯水楊酸用於治療不同原因引起的發燒和疼痛。通常,它用於治療急性疼痛,如頭痛、牙痛、關節、肌腱或背部的疼痛,以及感冒引起的發燒和疼痛。它還可以每天小劑量使用,以預防血栓形成。[49]

撲熱息痛也稱為達菲®或必理痛®。它源於乙醯苯胺,乙醯苯胺是 1880 年推出的首批抗發燒藥物之一。撲熱息痛用於緩解疼痛和退燒。與非甾體抗炎藥不同,它不治療炎症,也不抑制血小板的聚集。然而,它也參與阻斷前列腺素的合成。它的半衰期約為 2 到 3 小時,比較短。其作用持續約 4 到 6 小時。可能的應用領域包括:頭痛、牙痛、肌肉和關節疼痛、手術後疼痛或發燒和流感引起的疼痛。[50]

美沙吡林是一種(非酸性)止痛藥,屬於吡唑酮類藥物。它是一種前藥,在體內轉化為不同的活性代謝物。美沙吡林可用於治療疼痛、發燒和痙攣。由於其解痙特性,它常用於治療絞痛。其作用機制尚未完全瞭解。可能的藥物靶標是環氧合酶和內源性大麻素受體。[51]
阿片類藥物在疼痛管理中起著至關重要的作用,尤其是對於中度至重度疼痛。它們用於治療急性疼痛,以及姑息治療和退行性疾病的疼痛治療。嗎啡是典型的阿片類藥物。阿片類藥物與阿片類受體相互作用,阿片類受體是 G 蛋白偶聯受體,主要存在於大腦和脊髓中,但也存在於胃腸系統和其他組織中。阿片類藥物與阿片類受體結合,啟用 G 蛋白,導致 cAMP 產生、Ca2+ 流入和 K+ 流出的抑制效應,從而導致細胞超極化和神經元興奮性的降低。在脊髓中,阿片類藥物抑制來自初級感覺神經元的 P 物質的釋放,減少疼痛感覺傳遞到大腦。在腦幹中,阿片類藥物調節傷害性感覺的傳遞。[52]

抗抑鬱藥用於治療神經性疼痛和纖維肌痛。止痛效果也出現在非抑鬱症患者身上,因此它們的作用不僅僅是改善可能伴隨慢性疼痛的抑鬱狀態。具有止痛效果的抗抑鬱藥的例子包括三環類抗抑鬱藥 (TCA) 和選擇性血清素去甲腎上腺素再攝取抑制劑 (SNRI)。抗抑鬱藥沒有傷害性效應,但會作用於藍斑,並與去甲腎上腺素結合,去甲腎上腺素參與疼痛的內在控制。然而,確切的機制尚不清楚。[53]
抗癲癇藥用於治療神經性疼痛。抗癲癇藥緩解神經性疼痛有幾種不同的方式。例如,苯妥英和卡馬西平等較老的抗癲癇藥,主要用於治療三叉神經痛,透過透過頻率依賴性阻斷鈉通道來降低神經元興奮性。[54]


深部腦刺激 (DBS) 自 1970 年代初就被用於治療慢性疼痛。DBS 在治療慢性疼痛方面顯示出良好的效果,包括失敗的背部手術綜合徵 (FBSS)、幻肢痛和周圍神經性疼痛,與神經性疼痛相比,傷害性疼痛的反應率更高。它在頭痛方面也顯示出有希望的結果,其中叢集性頭痛的成功率最高。[55] 然而,隨著時間的推移,DBS 緩解疼痛的能力隨著對它應用的耐受性增加而降低。這對於治療慢性疼痛來說尤其重要。可能的解決方案是定期停用 DBS 以降低耐受性,或在閉環中使用自適應 DBS 系統。
開發第二種可能性至關重要的一個方面是識別用於調節刺激的有用生物標誌物。有三種主要策略來實現這一目標。首先,監測不同大腦區域在疼痛緩解刺激過程中或之後的神經活動,可以幫助識別哪些區域在有效刺激期間活動更強或更弱。然後,DBS 系統可以嘗試複製相同的活動以誘導疼痛緩解。其次,應用區域神經活動的頻譜分析可以幫助預測訊號的有效性。第三,同時記錄不同大腦區域的神經活動,可以根據該時刻的功能性大腦連線調節刺激。[56]。
DBS 對疼痛產生影響的途徑尚未完全瞭解。然而,一些試驗有助於制定不同的假設。當 DBS 應用於腹側後外側 (VPL)、腹側後內側丘腦 (VPM)、腦室周圍灰質 (PVG) 或導水管周圍灰質 (PGA) 時,低頻訊號 (≤50 Hz) 會導致鎮痛效果,而高頻訊號 (>70 Hz) 會引起痛覺過敏。因此,假設 DBS 的鎮痛效果可能源於聯合低頻神經活動的增強或高頻神經活動的破壞。[57]。
在一些州,大麻可以作為醫療用藥。它通常作為其他藥物無法使用時的慢性疼痛治療手段。大麻的作用是透過大麻素受體 CB1 和 CB2 介導的。然而,由於對人體進行大麻測試的規定非常嚴格,缺乏科學證據。獲得使用 THC 進行研究的許可幾乎是不可能的。允許對大麻進行研究將有助於識別引起不良反應的化合物或化合物組合,並開發一種有效、有效和安全的全新藥物。[58]
為了繞過這些限制,一些科學家正在研究一種替代方案:大腦中天然產生的類似大麻的化合物,稱為內源性大麻素。它們以類似於大麻素的方式作用於神經元,並有助於調節疼痛、食慾和焦慮。當分子與 CB1 受體結合時,會導致疼痛緩解。研究還使用正向變構調節劑 (PAM) 進行,PAM 會增加訊號分子 (在本例中為內源性大麻素) 找到其受體 (此處為 CB1 受體) 的可能性。這樣,PAM 只能在內源性大麻素已經被釋放的條件下增強內源性大麻素的訊號傳導。[59]
- ↑ a b c d Marchand, S. (2008), ‘The physiology of pain mechanisms: From the periphery to the brain’, Rheumatic Disease Clinics of North America 34(2), 285-309.
- ↑ ScoreUSMLE (2015), ‘Spinal pathways made super easy (part 1-2)’, Youtube 影片, (訪問日期 2015 年 7 月 21 日).
- ↑ a b Hasudungan, A. (2013), ‘Nociceptors - an introduction to pain’ (解釋了上行通路,非常容易理解),Youtube 影片,(訪問日期 2015 年 7 月 21 日)。
- ↑ Patel, N. B. (2010), ‘Physiology of pain’, 摘自 Kopf 和 Patel(編)„Guide to Pain Management in Low-Resource Settings“,2010 年,國際疼痛研究協會。
- ↑ Melzack, R. & Wall, P. D. (1965), ‘Pain mechanisms: a new theory’, Science 150, 971--979。
- ↑ Apkarian, A. V., Bushnell, M. C., Treede, R. D. & Zubieta, J. K. (2005), ‘Human brain mechanisms for pain perception and regulation in health and disease’, European Journal of Pain 9(4), 463-484。
- ↑ Malcom H. and Johnson MA (2005). "How Does Distraction Work in the Management of Pain". Current Pain and Headache Reports. 9: 90–95.
- ↑ Goffaux, P., Redmond, W. J., Rainville, P. & Marchand, S. (2007), ‘Descending analgesia – when the spine echoes what the brain expects’, Pain 130(1-2), 137-143。
- ↑ U. Bingel, J. Lorenz, E. Schoell, C. Weiller, C. Büchel (2006). "Mechanisms of placebo analgesia: rACC recruitment of a subcortical antinociceptive network". Pain. 120: 8–15.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c d e f g h i j C. M. Kooijman, P. U. Dijkstra, J. H. B. Geertzen, A. Elzinga, and C. P. Van Der Schans, “Phantom pain and phantom sensations in upper limb amputees: An epidemiological study,” Pain, vol. 87, no. 1, pp. 33–41, 2000.
- ↑ a b c d P. Jensen, T.S. & Rasmussen, Phantom pain and other phenomena, Textbook o. Edinburgh: Churchill Livingstone, 1994.
- ↑ a b c d e V. S. Ramachandran and W. Hirstein, “The perception of phantom limbs. The D. O. Hebb lecture,” Brain, vol. 121, no. 9, pp. 1603–1630, 1998.
- ↑ a b c d B. Cronholm, Phantom limbs in amputees: a study of changes in the integration of centripetal impulses with special reference to referred sensations. Stockholm, 1951.
- ↑ a b c E. Frank, B. & Lorenzoni, “Phantomerleben und Phantomschmerz. Fortschritte der Neurologie und Psychiatrie,” vol. 60, pp. 74–85, 1992.
- ↑ L. Schmalzl, “‘Pulling telescoped phantoms out of the stump’: Manipulating the perceived position of phantom limbs using a full-body illusion,” Front. Hum. Neurosci., vol. 5, no. November, pp. 1–12, 2011
- ↑ K. Sherman, R.A., Katz, J., Marbach, J.J. & Heermann-Do, Locations, characteristics, and descriptions. New York: Plenum Press, 1997.
- ↑ a b c d e M. Döbler, K. & Zenz, “Stumpf- und Phantomschmerz,” in Lehrbuch der Schmerztherapie, Stuttgart: Wissenschaftliche Verlagsgesellschaft, 1993, pp. 377–384.
- ↑ a b c d e C. Winter-Barnstedt, “Phantomschmerz nach Extremitätenamputation : Diagnostik und Biofeedback-Behandlung,” Ruprecht-Karls-Universität Heidelberg, 2001.
- ↑ S. W. Wartan, W. Hamann, J. R. Wedley, and I. McColl, “Phantom pain and sensation among British veteran amputees.,” Br. J. Anaesth., vol. 78, pp. 652–659, 1997.
- ↑ C. Sherman, RA, Sherman, “Prevalence and characteristics of chronic phantom limb pain among American veterans: results of a trial survey,” Am. J. Phys. Med., vol. 62, no. 5, pp. 227–238, 1983.
- ↑ a b c d e R. G. Bittar, S. Otero, H. Carter, and T. Z. Aziz, “Deep brain stimulation for phantom limb pain.,” J. Clin. Neurosci., vol. 12, no. 4, pp. 399–404, 2005.
- ↑ “Neuroma,” 維基百科,2016 年。[線上]。可用: 神經瘤 [訪問日期: 2016 年 6 月 5 日]。
- ↑ a b W. Larbig, P. Montoya, H. Flor, H. Bilow, S. Weller, and N. Birbaumer, “Evidence for a change in neural processing in phantom limb pain patients.,” Pain, vol. 67, no. 2–3, pp. 275–283, 1996.
- ↑ a b R. A. Sherman, V. D. Griffin, C. B. Evans, and A. S. Grana, “Temporal relationships between changes in phantom limb pain intensity and changes in surface electromyogram of the residual limb,” Int. J. Psychophysiol., vol. 13, no. 1, pp. 71–77, 1992.
- ↑ R. A. Sherman, J. G. Arena, C. J. Sherman, and J. L. Ernst, “The mystery of phantom pain: Growing evidence for psychophysiological mechanisms,” Biofeedback Self. Regul., vol. 14, no. 4, pp. 267–280, 1989
- ↑ M. M. Merzenich, R. J. Nelson, M. P. Stryker, M. S. Cynader, A. Schoppmann, and J. M. Zook, “Somatosensory cortical map changes following digit amputation in adult monkeys.,” J. Comp. Neurol., vol. 224, no. 4, pp. 591–605, 1984.
- ↑ T. P. Pons, E. G. Preston, A. K. Ommaya, H. K. Jon, E. Taub, and M. Mishkin, “Massive Cortical Reorganization After Sensory Deafferentation in Adult Macaques,” Science (80-. )., vol. 252, no. 5014, pp. 1857–1860, 1991.
- ↑ T. Elbert, H. Flor, N. Birbaumer, S. Knecht, S. Hampson, W. Larbig, and E. Taub, “Extensive reorganization of the somatosensory cortex in adult humans after nervous system injury.,” Neuroreport, vol. 5, no. 18, pp. 2593–2597, 1994.
- ↑ a b H. Flor, T. Elbert, S. Knecht, C. Wienbruch, C. Pantev, N. Birbaumer, W. Larbig, and E. Taub, “Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation.,” Nature, vol. 375, no. 6531, pp. 482–484, 1995.
- ↑ a b H. Buchner, C. Kauert, and I. Radermacher, “Short-term changes of finger representation at the somatosensory cortex in humans,” Neurosci. Lett., vol. 198, no. 1, pp. 57–59, 1995.
- ↑ a b P. M. Rossini, G. Martino, L. Narici, A. Pasquarelli, M. Peresson, V. Pizzella, F. Tecchio, G. Torrioli, and G. L. Romani, “Short-term brain ‘plasticity’ in humans: transient finger representation changes in sensory cortex somatotopy following ischemic anesthesia,” Brain Res., vol. 642, no. 1–2, pp. 169–177, 1994.
- ↑ W. M. Jenkins, M. M. Merzenich, M. T. Ochs, T. Allard, and E. Guic-Robles, “Functional reorganization of primary somatosensory cortex in adult owl monkeys after behaviorally controlled tactile stimulation,” J. Neurophysiol., vol. 63, no. 1, pp. 82–104, 1990.
- ↑ A. Karl, N. Birbaumer, W. Lutzenberger, L. G. Cohen, and H. Flor, “Reorganization of motor and somatosensory cortex in upper extremity amputees with phantom limb pain.,” J. Neurosci., vol. 21, no. 10, pp. 3609–18, 2001.
- ↑ R. Chen, B. Corwell, Z. Yaseen, M. Hallett, and L. G. Cohen, “Mechanisms of cortical reorganization in lower-limb amputees.,” J. Neurosci., vol. 18, no. 9, pp. 3443–50, 1998.
- ↑ H. Flor, T. Elbert, W. Mühlnickel, C. Pantev, C. Wienbruch, and E. Taub, “Cortical reorganization and phantom phenomena in congenital and traumatic upper-extremity amputees,” Exp. Brain Res., vol. 119, no. 2, pp. 205–212, 1998.
- ↑ E. a Franz 和 V. S. Ramachandran,“截肢者雙側肢體耦合現象,”Nat. Neurosci.,第 1 卷,第 6 期,第 443–444 頁,1998 年。
- ↑ M. Calford 和 R. Tweedale,“成年狐蝠切除手指後體感皮層的即刻和慢性變化,”Nature,第 332 卷,第 6163 期。第 446–448 頁,1988 年。
- ↑ L. Arendt-Nielsen 和 S. Petersen-Felix,“風吹現象和神經可塑性:它們與臨床疼痛之間存在相關性嗎?”,Eur. J. Anaesthesiol. Suppl.,第 10 卷,第 1–7 頁,1995 年。
- ↑ J. Li,D. A. Simone 和 A. A. Larson,“風吹現象導致中樞敏化的特徵,”Pain,第 79 卷,第 1 期,第 75–82 頁,1999 年。
- ↑ S. L. Florence 和 J. H. Kaas,“治療性截肢猴子手部後,體感通路多個層次的重組,”J. Neurosci.,第 15 卷,第 12 期,第 8083–8095 頁,1995 年。
- ↑ M. A. Nicolelis,R. C. Lin,D. J. Woodward 和 J. K. Chapin,“透過阻斷上行皮膚資訊,立即誘導丘腦網路時空變化,”Nature,第 361 卷,第 6412 期,第 533–6 頁,1993 年。
- ↑ “幻肢,”維基百科,2016 年。[線上]。可獲取:w: 幻肢 幻肢 [訪問日期:2016 年 6 月 5 日]。
- ↑ “疼痛管理健康中心,”WebMD,2015 年。[線上]。可獲取:幻肢痛| [訪問日期:2016 年 5 月 5 日]。
- ↑ J. Foell,R. Bekrater-Bodmann,M. Diers 和 H. Flor,“鏡面療法治療幻肢痛:大腦變化以及身體表徵的作用,”Eur. J. Pain,第 1–11 頁,2013 年。
- ↑ COX-2 抑制劑與癌症:問題與解答” 2004 年。美國國立癌症研究所。2004 年。 http://www.cancer.gov/cancertopics/factsheet/APCtrialCOX2QandA。
- ↑ Muller,Norbert。2010 年。“COX-2 抑制劑作為抗抑鬱藥和抗精神病藥:臨床證據”。《研究性藥物現狀》(倫敦,英國:2000 年)第 11 卷(第 1 期)。英國:31–42。
- ↑ “布洛芬”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=ibuprofen。
- ↑ “萘普生”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=metamizol。
- ↑ “乙醯水楊酸”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=Acetylsalicylsäure。
- ↑ “撲熱息痛”。2018 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=paracetamol。
- ↑ “美沙酮”。2017 年。PharmaWiki。 https://www.pharmawiki.ch/wiki/index.php?wiki=metamizol。
- ↑ Hemmings,H. C. 和 Egan,T. D.(2013 年)。阿片類激動劑和拮抗劑。麻醉藥理學與生理學:基礎與臨床應用。費城,賓夕法尼亞州:Elsevier/Saunders。
- ↑ Obata,H.(2017 年)。抗抑鬱藥治療神經性疼痛的鎮痛機制。《國際分子科學雜誌》,第 18 卷(第 11 期),第 2483 頁。doi:10.3390/ijms18112483。
- ↑ Ryder,S. 和 Stannard,C. F.(2005 年)。慢性疼痛的治療:抗抑鬱藥、抗癲癇藥和抗心律失常藥。《麻醉、重症監護和疼痛繼續教育》,第 5 卷(第 1 期),第 18-21 頁。doi:10.1093/bjaceaccp/mki003。
- ↑ Falowski,Steven M. 2015 年。“慢性疼痛的腦深部刺激”。《當前疼痛與頭痛報告》,第 19 卷(第 7 期)。美國:27。doi:10.1007/s11916-015-0504-1。
- ↑ Shirvalkar,P.,Sellers,K. K.,Schmitgen,A.,Prosky,J.,Joseph,I.,Starr,P. A. 和 Chang,E. F.(2020 年)。“治療慢性疼痛的腦深部刺激試驗期”。《臨床醫學雜誌》。9(第 10 期):3155。
{{cite journal}}:CS1 維護:作者列表的多個名稱 (連結) - ↑ Alamri,A. 和 A.C. Pereira,E.(2022 年)。“治療慢性疼痛的腦深部刺激”。《北美神經外科診所》。33(第 3 期):311–321。
{{cite journal}}:CS1 維護:作者列表的多個名稱 (連結) - ↑ Fields,Douglas。2014 年。“‘醫療大麻’的荒謬性”。BrainFacts.org。2014 年。 http://www.brainfacts.org/thinking-sensing-and-behaving/diet-and-lifestyle/2014/the-absurdity-ofmedical-marijuana。
- ↑ Burrell,Teal。2017 年。“揭示大麻素的治療可能性”。BrainFacts.org。2017 年。 http://www.brainfacts.org/thinking-sensing-and-behaving/diet-and-lifestyle/2017/smoking-out-thetherapeutic-possibilities-of-cannabinoids-42017。


