維基少年:元素/結構
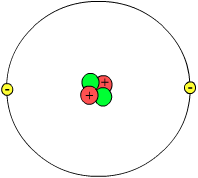
質子、中子和電子構成原子。因此,它們被稱為亞原子粒子。每種型別的原子在質子、中子和電子的數量上可能有所不同。根據目前的原子電子雲理論:原子有兩個部分,原子核和電子雲。原子核由質子和中子組成,而這些核子又由稱為“夸克”的更小的粒子組成。
原子核是原子的中心,包含質子和中子。與電子雲的大小相比,原子核非常小。這意味著原子核周圍有大量的空曠空間。原子的質子和中子位於特定的位置。質子和中子都具有大約 1 amu(原子質量單位)的質量。因此,原子的原子質量是質子和中子數量的總和。(電子比質子輕幾千倍,所以它們不參與計算。)
質子帶正電荷。質子的數量決定了原子是什麼元素。例如,如果一個原子有一個質子,這意味著它是一個氫原子;只有氫可以有一個質子。在元素週期表上,元素的原子序數與其質子數相同。
中子不帶電荷,但它們有助於穩定原子核;如果質子的正電荷單獨存在於原子核中,它們會相互排斥,使原子核變得不穩定。具有相同元素但中子數量不同的原子被稱為彼此的同位素。例如,氫有三種天然同位素,一種沒有中子,一種有一箇中子,一種有兩個中子。它們都只有一個質子,所以它們都是氫,但由於它們的中子數量不同,所以它們是不同的同位素。一些同位素具有放射性,這意味著它們會衰變或釋放能量。古生物學家使用一種叫做碳-14(原子質量為 14 的碳)的特定碳的放射性同位素來發現化石的年齡。他們可以這樣做,因為他們知道碳-14 衰變的速率。
原子的外層部分,電子雲,包圍著原子核。根據稱為量子力學的理論,我們永遠不知道特定電子的確切位置或速度;我們只能說出它出現在任何地方的機率。如果我們確切地知道電子在哪裡,我們就不知道它移動的速度。如果我們知道它的移動速度,同樣,我們也無法確定它在哪裡。電子帶負電荷,其強度與質子的正電荷一樣大。一些科學家過去認為電子像行星圍繞太陽一樣繞原子核執行,但我們現在知道事實並非如此。電子在原子核周圍以某種隨機的方式移動,並被原子核中質子的正電荷吸引。
原子是化學和宇宙中所有事物的基礎。您應該首先記住,物質是由原子組成的。原子和對原子的研究本身就是一個世界。我們將介紹原子結構和原子之間鍵合等基礎知識。隨著您瞭解更多資訊,您可以轉到生物化學教程,並瞭解原子如何形成化合物以幫助生物世界生存。
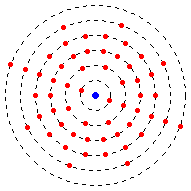
電子被組織成能級。
| 能級 | 電子容量[1] |
|---|---|
| 第一 | 2 |
| 第二 | 8 |
| 第三 | 18 |
| 第四 | 32 |
| 第五 | 50 |
| 第六 | 72 |
能級不必填滿電子才能進入更高能級。例如,鈦的電子構型為 2-8-10-2。這意味著它在第一個能級上有 2 個電子,第二個能級上有 8 個電子,第三個能級上有 10 個電子,第四個能級上有 2 個電子。
如前所述,一些原子只有特定數量的電子,因此一些元素不像其他元素那樣具有那麼多具有電子的能級。
最外層的能級稱為價能級。同樣,最外層能級上的電子稱為價電子。這些電子幫助原子結合成分子。
