A-level 化學/OCR (Salters)/光譜學
光譜學是研究輻射(電磁輻射或粒子輻射)與物質相互作用的學科。在化學理念中,第 6 章:輻射與物質全面闡述了光譜學。它涵蓋了輻射與物質如何以及為什麼相互作用,以及這些相互作用如何被應用。
Salters 高階化學中討論了多種光譜技術。它們是
- 紅外光譜(IR)
- 核磁共振譜(NMR)
- 紫外可見光譜(UV-Vis)
- 質譜(MS)
此外,化學故事線章節按設計著色中簡要提到了雷射顯微光譜分析(LMA)。
科學家們每天使用許多其他光譜學方法,但這裡提到的方法對整個化學領域而言最為重要。
我們將考慮物質顏色產生的主要原因:吸收光。物質還可以透過其他方式呈現顏色——例如,它可以散射或發射光——但這些效應最好在其他地方討論。
物質之所以有顏色,通常是因為它們吸收了可見光中的某些能量,但透射或反射了其餘能量。除了被吸收的能量之外,所有能量都會被我們的眼睛檢測到。然後,我們的大腦將這種不同能量光子的分佈解釋為特定的顏色。
色輪有助於預測我們的大腦如何解釋不同光子能量的分佈。白光(例如陽光)包含所有可能能量的光子,即整個可見光譜。這種光子能量分佈以我們感知為白色的方式刺激眼睛和大腦。
-
色輪 -
藍色溶液吸收橙色光
-
無色溶液透射所有可見光
當我們在科學中談論光時,通常指的是所有形式的電磁輻射。這不僅包括可見光,還包括整個電磁頻譜,涵蓋從 γ 射線到無線電波的一切。
電磁輻射由稱為光子的粒子組成。任何特定光子都具有特定的能量,該能量決定了它的頻率和波長。
所有物質中都存在電子,電子佔據能級。所有物質中也包含能夠容納電子但未被佔據的空能級。
物質中的電子可以從它所佔據的能級移動到能量更高的空能級。這種移動需要電子獲得精確數量的能量。如果光子具有該確切數量的能量,電子可以吸收該光子。透過吸收光子,電子能量恰好增加正確的數量,並移動到空能級。
吸收可見光的物質是那些具有兩個能級的物質,這兩個能級的能量差在可見光範圍內,即 2.8 × 10−19 J − 5.0 × 10−19 J。這種物質可以吸收此能量範圍的光子。
能量在 2.8 × 10−19 J − 5.0 × 10−19 J 之間的光子的波長在 700 奈米和 400 奈米之間,頻率在 4.3 × 1014 赫茲和 7.5 × 1014 赫茲之間。
簡而言之,
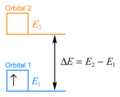
在過渡金屬配合物中,我們可以更仔細地定義能級。能級指的是軌道。過渡金屬配合物中的電子可以從它們正常的軌道移動到更高能量的軌道。
在它的正常軌道中,稱為軌道 1,電子具有特定數量的能量,.
在更高能量的軌道中,稱為軌道 2,電子具有更大的能量,.
兩種情況之間的能量差為 .
-
軌道 1 被電子佔據,而軌道 2 是空的 -
電子吸收具有正確能量的光子,並從軌道 1 躍遷到軌道 2 -
軌道 1 現在為空,軌道 2 被佔據
當光子到達軌道 1 時,電子可能能夠吸收該光子。
如果 ,光子能量不足以將電子從軌道 1 躍遷到軌道 2,因此電子無法吸收光子。
如果 ,光子能量過高,無法將電子從軌道 1 躍遷到軌道 2,因此電子無法吸收光子。
如果 ,光子能量恰好足以將電子從軌道 1 躍遷到軌道 2。電子可以並且確實吸收光子。電子獲得光子的能量,並從軌道 1 躍遷到軌道 2。