核醫學/核醫學中的 X 射線 CT 的基本物理學
多年來,人們一直認識到在 SPECT 成像中需要進行衰減補償,但直到最近才在商業系統中應用了有效的技術。正如我們之前在 先前中所見,伽馬射線會因其穿過的介質而衰減,透過光電吸收和康普頓散射。因此,在 SPECT 成像中測量的投影包含這種衰減的印記,這會降低其用於斷層重建的保真度,如下圖所示

可以使用患者特定的衰減圖來校正測量的投影。可以使用伽馬相機生成患者的透射掃描,使用放射性同位素源——參見下圖以瞭解示例

透射掃描包含患者感興趣區域的衰減資訊,隨後將這種衰減模式的圖應用於每個 SPECT 投影,然後進行濾波反投影。更強大的方法是使用 X 射線 CT 掃描器生成衰減圖——參見下圖。因此,已經生產出許多混合掃描器,將核醫學與 CT 成像結合起來,例如SPECT/CT 和PET/CT——參見下圖以瞭解示例

這些發展帶來的額外好處是,擁有足夠的計算能力,能夠同時將核醫學影像和 CT 影像混合在一起,從而生成與患者解剖影像共定位的生理影像——如下圖所示——從而提高核醫學程式的診斷效用。

混合掃描器通常有一個單一的患者床,伽馬相機旋轉架模製在 CT 機組的前部,這樣患者可以在 SPECT 收集之前或之後被送入 X 射線束中。一些 CT 機組是低解析度設計的,生成粗略的單層 CT 影像,這些影像對於 SPECT 衰減校正足夠精確,但其本身質量不足以用於診斷目的——見下例。還有一些用於混合掃描的高解析度 CT 機組,例如能夠採集 16 層螺旋掃描,可以與專用 CT 掃描器的診斷能力直接競爭。

本章概述了 X 射線 CT 掃描從核醫學角度來看的物理方面。我們從各種掃描器設計開始,並將探索與這種成像形式相關的多種計算技術。目的是為理解 X 射線 CT 在核醫學中的應用奠定基礎。
X 射線束在體內的衰減在傳統放射成像中被用來將陰影投射到影像接收器上(如下圖所示)。這些陰影圖記錄了三維物體的二維表示。因此,由於重疊和潛在的解剖結構,很難識別小的病變,由於不均勻的放大效果,會發生影像失真,由於散射對影像資料貢獻很大,低對比度的腫塊難以辨別。

我們可以認為這種影像中引入了退化,即兩個在解剖學上完全不同的物體可能會產生相同的膠片密度,因為它們各自產生的有效衰減是相同的,如下圖所示

面板 (a) 顯示了入射強度為 Io 的鉛筆束 X 射線,被身體衰減,為簡單起見,這裡用四個體積元素表示,每個體積元素的厚度為 Δx,具有不同的線性衰減係數 μ1 到 μ4。當沒有檢測到散射輻射時,透射強度由 I 給出,它取決於這些線性衰減係數的總和,根據指數衰減方程。面板 (b) 說明了即使兩列相鄰的體積元素包含具有不同線性衰減係數的體積元素,它們也能生成相同的透射強度 I 值。換句話說,檢測到的是線性衰減係數的綜合貢獻,而沒有關於任何單個體積元素的貢獻的資訊。
改進這種情況的一種方法是使用 X 射線計算機斷層掃描 (CT)。請注意,為 X 射線 CT 開發的影像重建演算法也可以應用於伽馬相機影像(如SPECT),以克服平面核成像的侷限性,以及使用正電子發射放射性同位素生成的影像(如PET)。
我們在前一章中在 SPECT 的背景下討論了這種計算機影像重建方法。我們在這裡的目的是在 X 射線 CT 的背景下討論這種重建方法。
下圖顯示了反投影的工作原理。基本前提是假定 X 射線束的任何衰減都是沿整個射線路徑均勻發生的。

因此,對第一個輪廓 P1 進行反投影的結果是分別將值 7 和 9 放入第一行和第二行的兩個元素中。第二個輪廓 P2 在反投影時向右上角元素添加了 4,向左下角元素添加了 1,向其他兩個元素添加了 11。其他輪廓以類似的方式處理。在減去偏移量(在本例中為 16)並對資料集進行重新歸一化(在本例中除以 3)之後,將獲得最終影像。您應該自己確認此最終矩陣是否滿足所有投影。
下圖更詳細地說明了該原理

單個輪廓被反投影到整個影像平面上,形成一條暗條紋 [面板 (a)]。當我們從多個方向掃描幻影並將射線輪廓反投影到影像平面 [面板 (b)] 時,放射密度點的影像,儘管質量很差,但開始變得清晰 [面板 (c)]。隨著投影數量的增加,質量會提高,但影像中始終會保留一些模糊。
這種模糊可以使用稱為濾波反投影的方法消除。
可以使用濾波技術在數學上抑制簡單反投影過程中固有的模糊,整個重建過程被稱為濾波反投影。在這種技術中(參見下圖),首先對衰減輪廓進行濾波,以抵消突然的密度變化的影響,這些變化會導致簡單反投影中的模糊。請注意,圖中的圖形表示非常粗略,因為濾波輪廓可能是距離的相當複雜的函式,如面板 (c) 所示。該濾波器也稱為卷積濾波器或卷積核。完成濾波過程後,在進行反投影過程之前,對每個輪廓的資料應用逆傅立葉變換。請注意,重建的影像 [面板 (d)] 沒有在未濾波的反投影中生成的星形偽影。

大多數CT掃描器提供多種濾波器供操作人員選擇,以增強影像中的軟組織特徵或骨骼細節。實際上,如果需要,可以在掃描完成後使用不同的濾波器對影像進行後處理。可以生成影像以增強骨骼細節,另一方面觀察微妙的低對比度腫塊,而無需重新掃描患者。因此,濾波器選擇將對影像質量產生重大影響。X射線CT中常用的兩種濾波器是Ramachandran & Lakshminarayanan (Ram-Lak)和Shepp & Logan濾波器。在SPECT中,使用Butterworth、Hanning和Metz濾波器,正如您所記得的那樣。單獨的斜坡濾波器可以補償簡單反投影過程引入的偽影,但不能補償資料隨著空間頻率增加而增加的噪聲含量。Ram-Lak是一個斜坡濾波器,它使所有頻率保持不變,除了截止頻率以上的頻率,這些頻率被消除。大多數其他濾波器在不同程度上抑制較高頻率。有時這些濾波器被稱為演算法。術語核心也被使用。下面顯示了用軟組織演算法和骨骼演算法重建的軸向斷層影像作為示例

在EPFL的生物醫學成像組提供了一個非常好的線上CT重建模擬器。作為練習,您可能希望透過改變重建前使用的濾波器型別來探索您對濾波反投影的理解。您可能還想探索用於輪廓獲取的角度數量對重建影像質量的影響。

大多數CT掃描器設計使用某種形式的機械旋轉架,該旋轉架允許X射線管和探測器圍繞患者移動。在早期設計中,X射線束被準直成鉛筆束,在現代系統中則由寬扇形束組成。切片的厚度,通常為1到10 mm,通常由X射線管外部的電機驅動的可調節楔形體進行患者前準直定義。即使使用相對較大的扇形束,照射的組織體積與投影射線照相相比仍然很小,散射問題不那麼嚴重。探測器前面有準直器,以最大程度地減少切片外散射的影響。為了最大程度地減少束硬化的影響,CT掃描器使用重濾波束(例如,西門子Somatom Plus使用2.7 mm Al加0.2 mm Cu),工作在120 – 140 kVp。請注意,即使在最佳射線照相幾何形狀下,例如在第三代掃描器中,物體放大率也很大,典型為1 mm的焦點尺寸很可能限制了可實現的空間解析度。
第一代CT掃描器使用的是所謂的平移-旋轉幾何形狀。例如,最初的EMI Mk 1掃描器(參見右側的圖)使用鉛筆狀X射線束和單個探測器(一個與光電倍增管耦合的NaI:Tl閃爍體)。在旋轉架的平移運動過程中,透射的X射線束被取樣160次以產生單個輪廓。然後在X射線束關閉的情況下旋轉1度,然後再獲得新的輪廓。重複此過程,直到對患者頭部進行180個不同角度的掃描。

整個過程大約需要5分鐘,並取決於患者完全保持靜止。患者頭部通常被夾住以最大程度地減少患者運動。此外,他們的頭部被一個水袋包圍,這有助於克服與NaI(Tl)閃爍體餘輝和探測器中本來存在的非常大的訊號動態範圍相關的問題。後來的掃描器試圖將掃描時間縮短到幾秒鐘,以最大限度地減少運動偽影。
第二代掃描器透過使用帶有多個探測器的小扇形束(參見下一圖)來解決這個問題,在某些設計中,最多可達30個探測器。探測器在平移過程中收集多個數據讀數,因此需要更少的平移和旋轉。每個探測器在每次平移過程中收集自己的有限輪廓。通常,在平移運動之間採用30度的旋轉,因此只需要六次旋轉運動就能獲得一個切片的資料。
這種設計實現了5到90秒的掃描時間。探測器元件是閃爍體,但取消了水袋,並且第一次可以進行人體掃描。使用多個探測器使效能有了質的飛躍。
第三代CT掃描器透過使用旋轉-旋轉幾何形狀(參見右側的圖)進一步縮短了掃描時間。如今大多數掃描器都是第三代型別。典型的機器使用一個大的扇形束,以使患者完全被扇形束包圍。探測器元件的數量通常在數百個,例如
- GE Hispeed Advantage有852個元件,相隔1.0 mm;
- 西門子Somatom Plus 4有768個元件,相隔1.1 mm;以及
- 東芝Xpress/SX有896個元件,相隔1.03 mm。

探測器元件沿以X射線管焦點為中心的圓弧排列。X射線管和探測器陣列作為一個整體旋轉360度,在此期間獲得數百個離散輪廓。固態探測器和加壓氙氣探測器都被用於資料採集。
由於扇形束完全包圍患者,因此不需要平移運動,並且管和探測器陣列作為一個整體圍繞患者旋轉。記錄的輪廓數量取決於所選的掃描引數,但至少有幾百個,甚至可能超過一千個。掃描時間可以低至一秒。雖然探測器的動態範圍非常高,但一些製造商透過使用適合人體或頭部形狀的領結形濾波器來控制訊號強度過大的變化。此類濾波器通常比中心部分在更大程度上衰減扇形束的外圍部分。它還有助於克服束硬化的影響,並最大限度地減少視野外圍部分患者的皮膚劑量。
針對這種幾何形狀,已經開發出許多變體,包括基於偏移旋轉中心和使用飛行焦點X射線管的變體。

第四代CT掃描器使用旋轉-固定環幾何形狀,其中一個固定探測器環完全包圍患者。X射線管在探測器環內旋轉360度,並具有寬扇形束。只有看到光束的探測器才會被啟用,這意味著在任何給定時間,只有幾千個探測器元件(例如,Picker PQ-5000V有4800個探測器元件,相隔1.1 mm)在使用。掃描時間與第三代掃描器相當,但射線照相幾何形狀較差,因為X射線管必須比探測器更靠近患者,即幾何放大率很大。
上述幾何形狀差的缺點透過所謂的擺動幾何形狀得到了很好的解決。X射線管位於探測器環的外部,但略微偏離探測器平面。使用這種型別的機器,可以實現低至0.6秒的掃描時間,掃描間延遲低至100毫秒。透過使用數千個探測器元件,可以獲得優異的解析度(0.35 mm)。
滑環技術方面的創新,從西門子Somatom Plus和東芝TCT 900S開始,使X射線管能夠朝著同一方向連續旋轉,從而克服了掃描間延遲的問題。當X射線管的連續運動與患者床沿掃描器軸線連續移動相結合時,我們得到了螺旋(也稱為螺旋)掃描,如圖所示。典型的床速為1 – 10 mm/s;可以在0.5秒內完成完整的360度旋轉,名義扇形束厚度為1 mm或更大。

在螺旋掃描的背景下,一個稱為螺距的引數被定義為
換句話說,對於10 mm的床移動量和10 mm的名義切片寬度,螺距為1。螺距值通常在1到2之間,具體取決於床運動方向所需的空間解析度。它是覆蓋範圍指標,換句話說。
螺旋掃描可以顯著減少掃描時間,因為可以連續掃描大體積,沒有任何間隙,並且受患者運動的影響很小。例如,Somatom Plus-4A允許在60秒的無間斷掃描中連續掃描多達80個切片。因此,可以進行胸部的單次屏氣掃描,並且可以重建矢狀面和冠狀面,而空間解析度損失很小。
螺旋掃描中的軸向重建如圖所示。可以看出,在掃描過程中實際上沒有照射任何軸向切片,並且任何橫軸影像資料都需要從獲取的螺旋記錄中估算。一種估計技術稱為z插值,因為它沿獲取資料的z維,即患者的頭腳軸,應用資料插值技術。

因此,濾波反投影重建過程被修改為在傅立葉濾波之前包含一個z插值步驟,如圖所示流程圖

在繼續之前,讓我們簡要回顧一下插值和外推的主題,以澄清我們的基本理解並將後續討論置於上下文中。讓我們從一個簡單的單維情況開始,如圖所示。假設我們已經對A和B進行了測量,並將它們繪製在圖上,並希望估計中間點C的值。這種估計過程稱為插值,如果我們假設變數X和Y之間存線上性關係,如圖所示,則估計點C的過程稱為線性插值。對於比我們這裡考慮的更復雜的資料,還可以使用其他函式作為插值函式。

如果我們還需要了解圖上點 D 的資訊,即測量範圍之外的點,我們就稱之為外推法,線性外推法在上面的圖中已經說明。
在數學上,我們可以寫成,給定
那麼點 C 的 Y 值由下式給出
使用線性插值。您不妨試著推匯出一個類似的公式,用於確定點 D 的 Y 值。
由於螺旋掃描是一種三維現象,我們需要在繼續討論之前對這種情況進行一些二維視角的分析,如下圖所示。

在下文中,我們將使用側面檢視。
螺旋 CT 中的插值
[edit | edit source]已經開發出許多用於螺旋掃描的計算方法。360o線性插值演算法以以下圖形為例進行說明。

基於我們之前關於線性插值的目標橫斷資料討論,可以推匯出以下公式
其中
- Pz(i, α) 是在方位 Zref 上,角度為 α 的插值投影;
- Pj(i, α) 是在第 j 次旋轉時,方位 Zj 和投影角度 α 處測量的螺旋投影;
- Pj+1(i, α) 是在第 j+1 次旋轉時,方位 Zj+1 和投影角度 α 處測量的螺旋投影;以及
這個插值過程應用於螺旋中的所有資料點,以生成對軸向資料的估計,然後進行濾波反投影。也可以進行更高階的插值,例如使用來自四條射線的點進行估計。此外,在多層螺旋 CT 中,可以對這些估計應用複雜的 z 軸濾波器。
體積成像
[edit | edit source]當 CT 掃描器的扇形束沿著 z 軸擴充套件並使用二維探測器時,可以產生每旋轉一次多個切片。在此基礎上,扇形束可以形成錐形,並應用體積成像和錐束 CT等概念。在這個背景下,還可以使用多層和多探測器 CT 等術語,儘管您會發現這兩個術語中的第二個可能是更合適的。
二維探測器是固態器件,最簡單的例子是矩陣陣列,如下圖所示。

該陣列可以由(例如)912 列 x 16 行的相同探測器組成,每個探測器為 1.25 毫米見方,彎曲以適合 X 射線管旋轉的弧線。上圖(a)中顯示了其中 8 列被 6 毫米寬的 X 射線束照射,這意味著可以同時採集 4 個 1.25 毫米軸向切片的資料。當 X 射線束擴充套件到覆蓋探測器陣列的寬度時,這種排列可以同時照射更多的行,在這種情況下最多可達十六行。
透過耦合相鄰探測器行的輸出,可以在此設計中實現靈活性,如(b)、(c)和(d)中的面板所示,其中分別將 2 行、3 行和 4 行的輸出相加,從而同時生成 4 個 2.5 毫米厚的切片,或 4 個 3.75 毫米的切片,或(您猜對了!) 4 個 5 毫米的切片。
自適應陣列探測器提供了一種更靈活的設計,如下圖所示。

與方形探測器列不同,該陣列使用寬度可變的探測器列,因此兩個中心列的寬度相對較窄,例如上圖中的 1 毫米,列寬度向外圍增加,例如從 1.5 毫米,透過 2.5 毫米到 5 毫米,如我們的圖所示。這種模式的原因將在下面解釋。
以下圖示顯示了該探測器陣列的四種工作模式。

我們可以在(a)中看到,當 1 毫米厚的扇形束與自適應陣列的中心列對齊時,可以採集兩個 0.5 毫米的切片。在(b)中,我們看到可以使用 4 毫米厚的扇形束來採集四個 1 毫米的切片。探測器耦合在(c)和(d)中得到說明,其中將四個中心列中探測器的輸出耦合,以便模擬兩個 2.5 毫米寬的檢測列,因此可以採集四個 2.5 毫米的切片資料。您認為這種耦合過程是如何在(d)中應用以生成四個 5 毫米的切片?
自適應陣列的第二個優勢是,每行單個探測器元件的數量可以大大減少,在我們剛剛討論的例子中,從 16 個減少到 8 個。這極大地提高了陣列生成資料的速度,並減少了必須對測量資料進行均勻性和其他校正所需的計算量。
多層螺旋 CT 中的插值過程在我們最後的圖中得到說明,其中顯示了使用360o多層濾波插值演算法的 4 層系統的情況。

2010 年,多探測器 CT (MDCT) 中的探測器行數通常為 8 行、16 行或 64 行,甚至更多,甚至已經開發出 320 層的掃描器。
CT 影像顯示
[edit | edit source]在計算機透過濾波反投影計算出每個畫素的線性衰減係數後,這些值會以水為參考進行歸一化,然後進行縮放並以豪斯菲爾德單位或 CT 值的形式呈現,定義如下。
其中 μm 和 μwater 分別代表組織材料和水的線性衰減係數。因此,水的 CT 值為零。下表列出了多種組織的 CT 值:
| 組織 | CT 值 (H) |
|---|---|
| 肺 | -300 |
| 脂肪 | -90 |
| 白質 | 30 |
| 灰質 | 40 |
| 肌肉 | 50 |
| 松質骨 | 300-500 |
| 皮質骨 | 600-3,000 |
影像通常使用灰度級在計算機顯示器上呈現。透過選擇合適的視窗級別和視窗寬度,可以顯示所有或部分 CT 值範圍。視窗寬度是指用於顯示的 CT 值範圍,視窗級別通常(但並非總是)是指選擇視窗的中心 CT 值。通常,最高數值被分配為白色,最低數值被分配為黑色,所有中間數值都被分配為線性尺度上的強度。因此,空氣將顯示為黑色,而皮質骨將顯示為相對明亮。
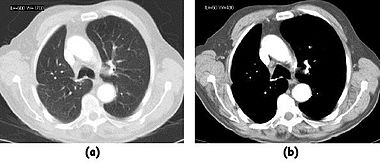
以下兩幅圖展示了影像顯示操作的示例。在第一幅圖中,同一患者肝臟切片的影像使用相對較窄的視窗(高對比度)和較寬的視窗進行顯示。使用較窄視窗的影像看起來更嘈雜,但這僅僅反映了灰度級在較窄的 CT 值範圍內擴充套件這一事實。

在第二幅圖中,使用相對較窄的視窗來突出病變。
掃描投影放射成像
[edit | edit source]大多數 CT 系統使用掃描投影放射成像 (SPR),也稱為掃描檢視和掃描圖,來建立所有後續程式的一致解剖標記集。在 SPR 中,扇形束不圍繞患者旋轉,而是固定,患者床緩慢地穿過束。當解剖結構在焦點和探測器之間變化時,每個探測器元件測量不同的輻射強度。這些離散探測器訊號被數字化,但沒有經過任何重大處理。計算機將來自所有探測器的訊號儲存為一系列線影像。每條線的寬度很小,通常為 1.5-2 毫米,對應於扇形束的有限寬度。隨後,透過將這些線掃描影像進行合成,並選擇合適的灰度級來以足夠的對比度顯示解剖結構,從而合成投影放射影像 - 請參閱以下示例影像。

一旦 SPR 影像生成,就可以定義要在 CT 模式下檢查的組織體積。然後,一旦選擇合適的掃描引數,CT 程式就可以由計算機自動控制。





