生物化學/催化
<< 生物化學 | << 熱力學 | 催化 | 代謝和能量 >>
催化是指由一種稱為催化劑的物質加速化學反應速率的過程,催化劑本身在整個反應中保持不變。催化對於任何已知的生命形式都至關重要,因為它使化學反應比“自身”發生的速度快得多,有時快幾百萬倍。
一個常見的誤解是催化“使反應發生”,即如果沒有催化劑的存在,反應就不會進行。然而,催化劑不能使熱力學上不利的反應進行。相反,它只能加速一個已經熱力學上有利的反應。在沒有催化劑的情況下,這種反應會進行,即使沒有催化劑,儘管可能太慢而無法觀察到或在給定的情況下有用。
催化劑透過提供反應物和產物之間能量較低的途徑來加速化學反應。這通常涉及形成中間體,如果沒有催化劑,該中間體就無法形成。這種中間體的形成和隨後的反應通常具有比反應物直接反應生成產物所需的活化能壘低得多的活化能壘。
從工業的角度來看,催化是一個非常重要的過程,因為大多數工業上重要的化學品的生產都涉及催化。催化研究是應用科學中的一個主要領域,涉及化學和物理學的許多領域。
通常區分兩種型別的催化。在均相催化中,反應物和催化劑處於同一相。例如,酸(H+離子供體)是許多水溶液反應中常見的催化劑。在這種情況下,反應物和催化劑都處於水相中。在多相催化中,催化劑與反應物和產物處於不同的相。通常,催化劑是固體,而反應物和產物是氣體或液體。為了使反應發生,一種或多種反應物必須擴散到催化劑表面並吸附在催化劑表面。反應結束後,產物必須從表面解吸並擴散離開固體表面。通常,這種反應物和產物的從一相到另一相的傳輸在限制反應速率方面起著主導作用。瞭解這些傳輸現象是多相催化研究中的一個重要領域。
酶(來自希臘語,in ferment)是特殊的蛋白質分子,其功能是促進或加速細胞中的大多數化學反應。它們只是生物催化劑。大多數酶是蛋白質,儘管也有一些是稱為核酶的催化 RNA 分子。許多化學反應發生在生物細胞內,但如果沒有催化劑,它們中的大多數在試管中發生得太慢,無法在生物學上相關。
酶還可以用來將兩個或多個反應耦合在一起,這樣熱力學上有利的反應就可以用來“驅動”熱力學上不利的反應。最常見的例子之一是利用 ATP 去磷酸化來驅動一些本來無關的化學反應的酶。
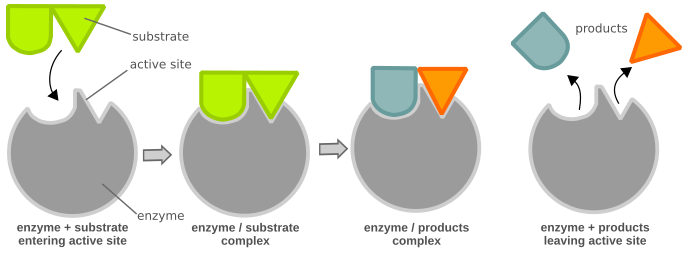
化學反應需要一定量的活化能才能發生。酶可以透過有利於或實現不同的反應路徑來提高反應速度,這些路徑具有較低的活化能(圖 1),從而使反應更容易發生。酶是大型球狀蛋白質,催化(加速)化學反應。它們對於細胞的功能至關重要。酶對它們催化的反應和參與反應的化學物質(底物)具有高度特異性。底物與其酶的配合就像鑰匙與其鎖的配合一樣(圖 2)。許多酶由幾種一起作為一個單元起作用的蛋白質組成。酶的許多部分具有調節或結構目的。催化反應僅發生在酶的一個小部分稱為活性位點,該位點由大約 2 到 20 個氨基酸組成。

底物(A 和 B)需要大量的能量(E1)才能達到中間狀態A...B,然後反應形成最終產物(AB)。酶(E)建立一個微環境,使 A 和 B 更容易達到中間狀態(A...E...B),從而降低所需的能量(E2)。因此,反應更有可能發生,從而提高反應速度。
酶每秒可以執行高達幾百萬次催化反應。為了確定酶促反應的最大速度,增加底物濃度,直到產物形成速率達到恆定(圖 3)。這是酶的最大速度(Vmax)。在這種狀態下,所有酶的活性位點都被底物飽和。這由 Leonor Michaelis 和 Maud Menten 在 1913 年提出。由於無法準確測量Vmax時的底物濃度,因此透過反應速率達到其最大值一半時的底物濃度來表徵酶。這種底物濃度稱為米氏常數(KM)。許多酶服從米氏動力學。
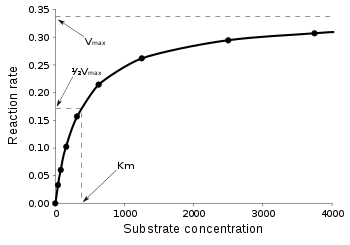
速度V表示每秒被酶催化的反應次數。隨著底物濃度[S]的增加,酶漸近地接近其最大速度Vmax,但實際上永遠不會達到它。因此,不能給出Vmax的[S]。相反,酶的特徵值由底物濃度在其半最大速度(Vmax/2)時的底物濃度定義。這個 KM值也稱為米氏常數。
幾個因素可以影響酶的反應速度、催化活性以及特異性。除了從頭合成(生產更多酶分子以提高催化速率)外,pH 或溫度等性質可以使酶變性(改變其形狀),使其不再發揮作用。透過酶的翻譯後修飾(例如,磷酸化)或新增輔助因子(例如金屬離子或有機分子(例如 NAD+、FAD、CoA 或維生素))可以實現更具體的調節,這些輔助因子與酶相互作用。別構酶由幾個相互作用的亞基(蛋白質)組成,因此相互影響彼此的催化活性。酶也可以受到競爭性抑制劑(圖 4)和非競爭性抑制劑和啟用劑(圖 5)的調節。抑制劑和啟用劑通常用作藥物,但它們也可能是毒藥。

競爭性抑制劑與酶的配合與其實際底物一樣好,有時甚至更好。抑制劑取代活性中心中的底物,但不能進行催化反應,從而抑制酶與底物分子的結合。一些抑制劑與酶形成共價鍵,使其永久失活(自殺性抑制劑)。就競爭性抑制劑的動力學而言,它會增加 Km,但不會改變 Vmax。

非競爭性抑制劑/啟用劑(I)不與活性中心結合,而是與酶(E)的其他部分結合,這些部分可能距離底物(S)結合位點很遠。透過改變酶(E)的構象(三維結構),它們會使酶(E)結合其底物(S)和催化所需反應的能力失效或啟用。非競爭性抑制劑會降低 Vmax,但不會改變 Km。
非競爭性抑制劑只會與酶-底物複合物結合,形成酶-底物-抑制劑(ESI)複合物,並且無法透過額外的底物克服。由於 ESI 不反應,因此 Vmax 會有效降低。非競爭性抑制劑反過來會降低 Km,因為達到 ES 最大濃度一半所需的底物濃度較低。
幾個酶可以按特定順序協同工作,建立代謝途徑(例如,檸檬酸迴圈,有氧生物細胞中的一系列酶促反應,在細胞呼吸中很重要)。在代謝途徑中,一種酶將另一種酶的產物作為底物。在催化反應之後,產物然後被傳遞給另一種酶。這種途徑的最終產物(s)通常是非競爭性抑制劑(圖 5),用於該途徑中的第一個酶之一(通常是第一個不可逆步驟,稱為承諾步驟),從而調節該途徑產生的最終產物量(圖 6)。

- 基本的反饋抑制機制,其中產物(P)抑制承諾步驟(A⇀B)。
- 順序反饋抑制。最終產物 P1 和 P2 抑制它們各自途徑的第一個承諾步驟(C⇀D 或 C⇀F)。如果兩種產物都大量存在,則來自 C 的所有途徑都將被阻斷。這會導致 C 的積累,進而抑制第一個共同的承諾步驟 A⇀B。
- 酶的多樣性。每個最終產物都抑制第一個單獨的承諾步驟和執行第一個共同的承諾步驟的酶之一。
- 協同反饋抑制。每個最終產物都抑制第一個單獨的承諾步驟。它們一起抑制第一個共同的承諾步驟。
- 累積反饋抑制。每個最終產物都抑制第一個單獨的承諾步驟。此外,每個最終產物部分地抑制第一個共同的承諾步驟。
酶對於生物體至關重要,即使我們體內大約 2,000 種酶中一種酶發生故障,也會導致嚴重或致命的疾病。人類中由酶功能障礙引起的疾病的一個例子是苯丙酮尿症 (PKU)。通常將必需氨基酸苯丙氨酸轉化為酪氨酸的酶苯丙氨酸羥化酶不起作用,導致苯丙氨酸積聚,從而導致智力障礙。人體中的酶也會受到抑制劑的良好或不良影響。例如,阿司匹林抑制產生前列腺素(炎症信使)的酶,從而抑制疼痛。但並非所有酶都存在於生物體內。酶也被用於日常生活用品中,例如生物洗衣粉,在那裡它們會加速化學反應(使您的衣服變乾淨)。
在上一節中,我們討論了消化酶,包括人體產生的酶,如唾液澱粉酶,以及食物酶。它們的 primary role 是消化食物。另一類酶稱為代謝酶。它們的作用是催化體內所有過程的化學反應,包括氧氣的吸收。如果沒有細胞色素氧化酶的作用,即使有充足的氧氣,我們的細胞也會因缺氧而餓死。酶也是肌肉收縮和舒張所必需的。事實上,如果沒有這兩類酶(消化酶和代謝酶),生命將無法存在。消化酶作為生物催化劑,幫助分解碳水化合物、蛋白質和脂肪。另一方面,代謝酶作為細胞的重塑者。食物消化具有很高的優先順序和對酶的需求;消化酶優先於代謝酶。代謝酶的任何缺乏都會導致過度工作,這會導致器官腫大以執行增加的工作量。結果是不健康的,可能會導致心臟或胰腺腫大。代謝酶的缺乏會對健康產生巨大的影響。隨著年齡的增長,酶水平下降,人體效率下降。
按照慣例,酶的名稱由其功能描述組成,以“-ase”結尾。例如,酒精脫氫酶和 DNA 聚合酶。激酶是轉移磷酸基團的酶。國際生物化學與分子生物學聯合會制定了酶的命名法,即 EC 編號;每種酶都由一個四位數字序列描述,前面加 “EC”。第一個數字根據酶的機制對酶進行廣泛分類。
- EC 1 氧化還原酶:催化氧化/還原反應
- EC 2 轉移酶:轉移官能團(例如,甲基或磷酸基團)
- EC 3 水解酶:催化各種鍵的水解
- EC 4 裂解酶:透過除水解和氧化以外的其他方式裂解各種鍵
- EC 5 異構酶:催化單個分子內的異構化變化
- EC 6 連線酶:透過共價鍵連線兩個分子
一些其他重要的酶包括:蛋白酶:在胃、胰液和腸液等高酸性環境中將蛋白質分解為氨基酸。作用於細菌、病毒和一些癌細胞。澱粉酶:將澱粉等複雜碳水化合物分解為更簡單的糖(糊精和麥芽糖)。它存在於腸道、胰腺以及唾液腺中。脂肪酶:分解脂肪和一些脂溶性維生素(A、E、K 和 D)。有助於治療心血管疾病。纖維素酶:分解存在於水果、穀物和蔬菜中的纖維素。它可以提高蔬菜和水果的營養價值。果膠酶:分解存在於柑橘類水果、胡蘿蔔、甜菜、番茄和蘋果中的果膠。抗氧化劑:保護細胞免受自由基負面影響的損害。組織蛋白酶:分解動物蛋白。乳糖酶:分解存在於乳製品中的乳糖。乳糖酶的產生會隨著年齡的增長而下降。轉化酶:吸收蔗糖,如果沒有正確消化,會導致消化壓力。木瓜蛋白酶:分解蛋白質並幫助身體消化。菠蘿蛋白酶:分解存在於植物和動物中的蛋白質。它可以幫助身體對抗癌症和治療炎症。葡萄糖澱粉酶:將存在於所有穀物中的麥芽糖分解為兩個葡萄糖分子。
