生物化學/代謝與能量
代謝(圖 1)從廣義上講,是將食物轉化為能量、細胞成分和廢物的過程。
上圖顯示了代謝的不同部分
- 能量來源,這畢竟是太陽,其能量透過光合作用被收集
- 分解代謝,將食物分解成化學能量,這是在
- 合成代謝中所需要的,合成代謝利用化學能量,從小的環境分子構建複雜的細胞分子
分解代謝反應釋放能量,因此是放能反應,而合成代謝反應消耗能量,因此是吸能反應.
由於食物化合物種類繁多,合成代謝中需要能量的生化反應也很多,因此將特定的合成代謝反應與分解代謝中的特定能量來源耦合效率會很低。相反,細胞使用一種中間化合物,一種通用的能量貨幣。這種中間體被稱為高能磷酸鹽。
但是,什麼時候磷酸基團被稱為“高能”,它與“低能”磷酸基團有何區別?一個關鍵因素是水解的 ΔG0'。水解透過新增水將磷酸基團從化合物中分離出來
O O R-OP-OH + H2O ⇌ R-OH + HO-P-OH O O
低能(或“無機”)磷酸基團(稱為 Pi)的 ΔG0' 為 9-20 kJ mol-1,而高能磷酸基團(表示為 Ⓟ)的 ΔG0' 約為 30 kJ mol-1。
那麼是什麼讓這個 Ⓟ 如此特殊呢?為了解釋這一點,我們必須稍微介紹一下 pH 和 pKa 值。磷酸基團有 0 到 3 個OH基團。這使得 Ⓟ 可以存在於最多四種不同的形式(0、1、2 和 3 個OH基團,圖 2),具體取決於周圍溶液的 pH 值。pKa 值告訴我們 50% 的分子處於一種形式(例如,1 個OH基團)和另一種形式(例如,2 個OH基團)時的 pH 值。這由亨德森-哈塞爾巴爾赫方程表示

圖 2:磷酸基團的四種可能形式。pKa2 代表細胞中的條件。
現在我們來說說 Ⓟ 和 PPi 之間的區別。ROⓅ 的酯鍵斷裂比 PPi 鍵斷裂釋放的能量更多(圖 3),因為
- 靜電排斥 PPi 中的兩個磷酸基團
- 共振穩定 兩個 Pi 基團,與 PPi 相比(圖 4)
共振穩定意味著兩者OH和=O可以在磷酸鹽周圍“移動”。當然,這只是一個粗略的類比;它們實際上並沒有移動,只是電子在磷酸原子周圍“擴散”。這也用 ↔ 箭頭而不是 ⇌ 來表示;這三種形式不存在,它們只是用來表示化學現實的一種方式。
如您在圖 3 中看到的,PPi⇌2Pi 的 ΔG0' 值 ≪0,使反應強烈地有利於 2Pi。
在下圖中,最終產物不應該有碳-碳雙鍵,而應該有一個單鍵,頂部有 CH3。這是一個錯誤。水解 : ΔG0' = -61.9 kJ mol-1
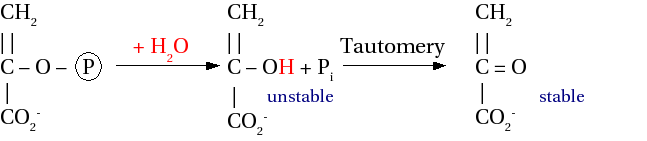
三磷酸腺苷含有一個低能磷酸鍵和兩個高能磷酸鍵

低能 : ΔG0' = -14,2 kJ mol-1
高能 : ΔG0' = -30.5 kJ mol-1
- ATP 由 ADP(二磷酸腺苷)、Pi 和能量(來自食物)再生;在此過程中會釋放 H2O。
- ATP 是細胞的短期能量“貨幣”。
- 細胞中的 ATP 濃度很低(ATP:2-8mM;ADP:0,2-0,8mM)。ATP 的生成量很高。
- ATP 透過偶聯反應發揮其化學作用。
- 偶聯反應始終是 Ⓟ 轉移,而不是直接水解
基本上,任何由 ATP 驅動的反應都是可逆的,在此過程中,從 ADP 和 Pi 生成 ATP。然而,某些由 ATP 驅動的反應不應該被逆轉;這些包括核苷酸和蛋白質合成。如果這些反應被逆轉,生物體就會將其自身的 DNA 和蛋白質分解成能量,這是一種相當不幸的策略。對於不應該被逆轉的反應,ATP 可以分解成 AMP(單磷酸腺苷)和 PPi,而 PPi 則轉化為 2×Pi。該反應的 ΔG0' 為 -65,7 kJ mol-1,在體內條件下是完全不可逆的。
需要注意的是,AMP 不能直接轉化回 ATP。相反,AMP 激酶酶從一個 ATP 和一個 AMP 分子生成兩個 ADP 分子。然後對生成的 ADP 進行上述處理。
共價鍵的斷裂需要大量的能量。一個 O2 分子分解成兩個氧原子需要約 460 kJ mol-1 的能量。因此,在“活體”生物化學中,共價鍵實際上不會被破壞;如果一個鍵被破壞,另一個鍵就會被形成。這就是非共價鍵的作用,它們足夠弱,可以很容易被破壞,並再次形成“鍵”。因此,許多生化功能都利用了所謂的弱/次級/非共價鍵。
弱鍵比共價鍵更容易形成和破壞。破壞這種弱鍵所需的典型能量範圍為 4-30 kJ mol-1。因此,弱鍵的形成在能量上是有利的,但這些鍵也容易被動能(熱能)(分子的正常運動)破壞。生化相互作用通常是暫時的(例如,底物在被處理後必須迅速離開酶),弱鍵的弱性對於這一點至關重要。此外,生化特異性(例如,酶-底物識別)是透過弱鍵實現的,利用了它們的兩個主要性質。
- 由於單個弱鍵,嗯,很弱,因此它們中的幾個必須在相同時間、大致相同的位置以特定的模式出現。
- 弱鍵的短程。
下面的連結演示了非共價力的型別:[1] 存在三種基本型別的弱鍵,以及第四種“偽鍵”。
離子鍵
[edit | edit source]離子鍵是永久帶電基團之間的靜電吸引力。離子鍵是無方向的。例如
- X-CO2- ..... H3+N-Y
- ~ 20 kJ mol-1
氫鍵
[edit | edit source]氫鍵也是由靜電吸引力形成的。這些吸引力不是發生在永久帶電基團之間,而是發生在由偶極矩暫時帶電的原子之間,偶極矩是由基團內原子的不同電負性引起的。氫鍵比離子鍵更弱,它們具有很強的方向性,通常沿著一條直線。除了比離子鍵更弱之外,氫鍵也比類似的共價鍵更弱、更長。氫鍵是獨一無二的,因為它們只存在於氫與氧 (O)、氮 (N) 或氟 (F) 鍵合時,但在生物化學中,最常見的氫鍵是
- X-OH ..... O-Y
- X-OH ..... N-Y
- X-NH ..... O-Y
- X-NH ..... N-Y
氫鍵的能量約為 12-29 kJ mol,而共價鍵的能量要高得多。例如,氧和氫之間的共價鍵約為 492 KJ mol-1。
氫鍵和水
[edit | edit source]水具有獨特的性質;畢竟,它被選為通用溶劑。水的獨特性質是由於所有含量的氧和氫原子之間的氫鍵作用。水中發生的氫鍵彼此之間相距約 2 埃。儘管氫鍵只有共價鍵強度的約 5%,但它們仍然使水具有較高的沸點和較高的表面張力。以下連結將帶您瞭解水的結構及其氫鍵作用。
範德華力
[edit | edit source]範德華力是在電子密度誘導的偶極之間建立的。當兩個原子的外層電子殼幾乎(但不是完全)接觸時,它們就會形成。原子之間的距離對於這些弱相互作用非常重要。如果原子相距太遠,相互作用太弱而無法建立;如果原子彼此過於接近,它們的電子殼會相互排斥。範德華力是高度非特異性的;它們幾乎可以在任何兩個原子之間發生。它們的能量在 4-8 kJ mol-1 之間。
疏水相互作用
[edit | edit source]疏水力實際上不是鍵,因此此列表中有四項,但仍然只有三種鍵型別。在某種程度上,疏水力是對極性溶質(通常是水)包裹非極性分子的氫鍵的否定。對於像水這樣的極性溶質來說,“浪費”一個可能的氫鍵將其暴露在非極性分子中在能量上是不利的。因此,水會以一種不向該分子指向任何氫鍵的方式排列在任何非極性分子周圍。這導致與“自由”移動的水相比,更高的秩序,這導致熵水平降低,因此在能量上是不利的。如果溶質中存在多個非極性分子,則非極性分子聚集在一個地方是有利的,從而將它們周圍的有序“殼”水減少到最小的表面積。此外,在蛋白質等大型分子中,分子的疏水(非極性)部分將傾向於轉向內部,而極性部分將傾向於轉向分子的表面。
參考文獻
[edit | edit source]Cooke, Rosa-lee. 水的性質。第 10 講。山區帝國社群學院。n.d. 網路。 http://water.me.vccs.edu/courses/env211/lesson10_print.htm
Kimball, John W.. 氫鍵。Kimball 生物學頁面。2011 年 2 月 12 日。網路。 http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/H/Hbonds_water.gif
Lower, Stephen. 物質狀態:水和氫鍵。普通化學虛擬教科書。2009 年。2010 年 8 月 26 日。網路。 http://www.chem1.com/acad/webtext/states/water.html
n.p. 共價鍵與非共價鍵。n.d. http://www.pearsonhighered.com/mathews/ch02/c02cv.htm
W. W. Norton & Company. 水中的氫鍵。網路。2012 年。 http://www.wwnorton.com/college/chemistry/gilbert2/tutorials/chapter_10/water_h_bond/
WyzAnt 家教。WyzAnt 家教。債券。2012 年。網路。 http://www.wyzant.com/Help/Science/Chemistry/Bonds/


![{\displaystyle {pH}={pK}_{a}+log{[base] \over [acid]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c76e01f52dd2a8970a93ded61f409e95ebe9726a)



