生物醫學工程理論與實踐/生物電現象
'另請參見 維基百科,電生理學.
電生理學是生物醫學工程的一個分支,它涉及研究體內的電活動。電生理學包括研究電活動的產生及其對身體的影響。它涉及在不同系統中使用電極測量電壓變化或電流流動,從單個離子通道蛋白到單個神經元(特別是動作電位)以及整個組織,如心臟。

我們的身體是電中性的,但我們的體細胞被一層由磷脂雙層組成的膜包圍,蛋白質嵌入其中。膜起著絕緣體和對離子運動的擴散屏障的作用。離子轉運蛋白/泵蛋白將離子推過膜,以在膜兩側獲得濃度梯度,而離子通道允許離子沿著這些濃度梯度穿過膜。離子泵和離子通道在電學上與膜中的一組電池和電阻相同。在膜內和膜外,一種電荷可能占主導地位。相反的電荷試圖吸引,並且必須使用能量來將它們分開。相反,當相反的電荷聚集在一起時,會釋放能量。因此,分離的電荷具有勢能。
在電活性組織中,可以透過將電極插入兩個點來測量電壓,例如一個在細胞內部,另一個在細胞外部,它被稱為電位差或電勢差。電壓是指驅動電流跨電阻的能力。從一個點到另一個點的電荷流動稱為電流。在兩點之間移動的電荷量取決於電壓和電阻(阻礙電荷流動)。因此,電壓的最簡單定義由**歐姆定律**給出
其中 I 是流經導體的電流,單位為安培,V 是跨導體測量的電位差,單位為伏特,R 是導體的電阻,單位為**歐姆**。電流與電壓成正比(電壓越高,電流越大),與電阻成反比(電阻越大,電流越小)。
在體內,電流對應於離子穿過細胞膜的流動,任何電阻都由膜本身提供。各種離子通道出現在質膜中,並分為被動通道和主動通道
- 被動(洩漏)通道始終處於開啟狀態
- 主動(門控)通道由一個或多個蛋白質組成,這些蛋白質能夠發生變化以開啟或關閉
- 化學門控通道
- 電壓依賴性通道
- 其他門控通道
離子沿著化學梯度(由於擴散)和沿著電梯度(向相反的電荷移動)移動;因此離子沿著電化學梯度流動。
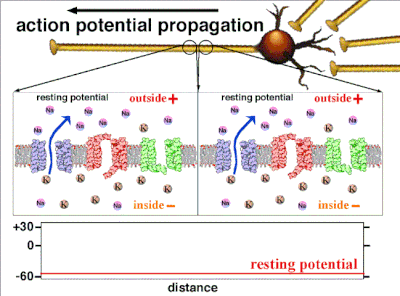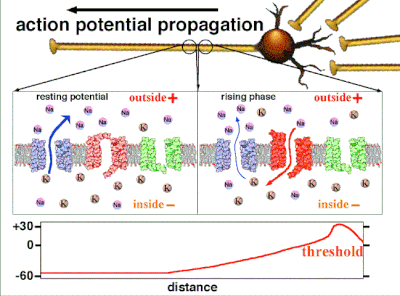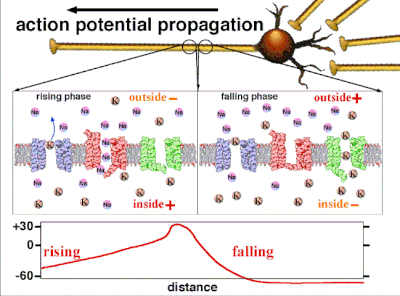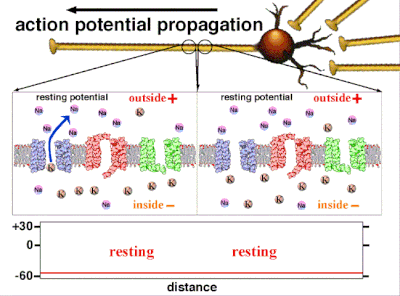
在非興奮性細胞中,以及在興奮性細胞的基線狀態下,膜電位具有相對穩定的值,稱為靜息電位。離子通道的開啟和關閉會導致偏離靜息電位。如果內部電壓移動到更正的膜電位,這被稱為**去極化**,如果內部電壓變得更負,這被稱為**超極化**。在興奮性細胞中,足夠大的去極化會導致動作電位,其中膜電位在短時間內(約 1 到 100 毫秒)迅速且明顯地發生變化,通常使其極性反轉。
膜電位變化(特別是如果由配體門控通道的啟用引起)也被定義為以下兩種情況之一
- **興奮性**:膜去極化
- **抑制性**:膜超極化

膜轉運是指顆粒(溶質)穿過或透過膜屏障的運動[1] 在細胞中,這些膜屏障由磷脂雙層組成。磷脂會自動排列,使親水(極性)頭部最靠近細胞外和細胞內介質,而疏水(非極性)尾部像水中的肥皂原理一樣排列在兩個親水頭部基團之間。
膜轉運取決於膜的滲透性、跨膜溶質濃度以及溶質的大小和電荷。 [1]溶質顆粒可以透過三種機制穿過膜:被動轉運、協助轉運和主動轉運。其中一些轉運機制需要能量輸入和跨膜蛋白的使用,而其他機制則不接受次級分子。 [2]
被動運輸依賴於濃度梯度、疏水性、溶質的大小和電荷。在被動運輸中,小的非帶電溶質顆粒透過膜擴散,直到膜的兩側達到濃度相似的平衡狀態。 [3]
菲克第一定律可以用來描述分子跨膜的被動運輸。
其中
- 是“擴散通量” [(物質量)每單位面積每單位時間],例如 .
- 是擴散係數或擴散率,其維度為 [長度2 時間−1],例如
- (對於理想混合物)是濃度,其維度為 [物質量每單位體積],例如
- 是位置 [長度],例如
協助擴散是一種由嵌入細胞膜中的轉運蛋白介導的被動運輸。 [4]
主動運輸是指粒子透過轉運蛋白從低濃度到高濃度移動,以消耗代謝能量。 [4]
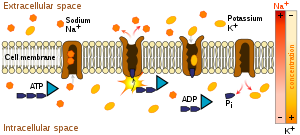
初級主動運輸直接利用代謝能量將分子跨膜運輸。大多數執行此類運輸的酶是跨膜ATP酶。根據轉運機制以及遺傳和結構同源性,這些ATP依賴性離子泵可以分為四種類型:[5]
- P型ATP酶:鈉鉀泵、鈣泵、質子泵
- F型ATP酶:線粒體ATP合酶、葉綠體ATP合酶
- V型ATP酶:液泡ATP酶
- ABC(ATP結合盒)轉運蛋白:MDR、CFTR等。
P型、F型和V型只轉運離子,而ABC超家族也轉運小分子。
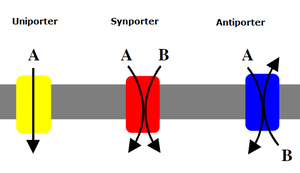
次級主動運輸被稱為耦合轉運或協同轉運,因為能量被用來將分子跨膜運輸;然而,與初級主動運輸相比,沒有直接的ATP耦合;相反,透過將離子泵出細胞形成的電化學勢能差被利用。 [6]
1960年8月,羅伯特·K·克萊恩在布拉格首次提出了他關於腸道葡萄糖吸收的協同轉運機制。 [7] 協同轉運體可以分為同向轉運體和反向轉運體,這取決於物質是朝著相同方向還是相反方向移動。
- 協同轉運蛋白:兩種分子透過膜向同一方向轉運。
- 反向轉運蛋白:兩種離子或其他溶質透過膜向相反方向轉運。

離子通道是形成孔隙的膜蛋白,其功能是建立靜息膜電位,透過控制離子跨細胞膜的流動來塑造動作電位和其他電訊號,控制分泌和上皮細胞中離子的流動,並調節細胞體積。[8] [9] 常見的離子通道實驗室技術包括電壓鉗位技術和膜片鉗技術。
離子通道不同於其他離子轉運蛋白:[10]
- 離子透過通道的轉運速率非常高(通常每秒 106 個離子或以上)。
- 離子透過通道沿其電化學梯度移動,該梯度是離子濃度和膜電位的函式,“下坡”移動,無需代謝能(例如三磷酸腺苷、主動轉運機制、協同轉運機制)。
離子通道位於超過 300 種細胞的質膜和許多細胞器中。它們通常被描述為狹窄、充滿水的通道,只接受特定型別的離子。這種特性稱為選擇性通透性。離子通道是跨膜蛋白,由多個蛋白組裝而成。這種“多亞基”組裝通常會形成一個圓形排列,由相同或同源蛋白緊密排列在脂質雙層膜平面上的一個充滿水的孔周圍。[11][12] 。
離子通道在內質網的膜中合成和插入。它們在高爾基體中被糖基化,並透過膜融合被轉運並插入靶膜。它們受磷酸化、轉運、泛素化、與其他訊號蛋白和第二信使的可逆相互作用、蛋白水解切割和其他修飾的控制。離子通道與導致細胞快速變化的各種生物過程有關,例如肌肉收縮、上皮細胞的營養物質和離子轉運、T 細胞活化和胰腺 β 細胞胰島素釋放。離子通道是尋找新藥的常見目標。[13][14][15]
電壓門控離子通道是蛋白質通道,它們可以響應細胞膜跨膜電位的變化而開啟或關閉。它們在可興奮的神經和肌肉組織中發揮重要作用,導致響應觸發電壓變化的快速協調去極化。它們通常由幾個亞基蛋白組成,這些亞基蛋白根據其電化學梯度形成一個孔。

示例包括
- 神經和肌肉的鈉和鉀電壓門控通道。
- 在突觸前神經末梢中起神經遞質釋放作用的電壓門控鈣通道。
- 吞噬細胞在“呼吸爆發”期間的電壓門控質子通道。
鈉和鉀電壓門控通道中的過程如下
- 細胞內部的去極化會導致蛋白質通道移動,誘導構象變化,從而使離子能夠透過通道流動(開啟狀態)。
- Na+ 離子大量湧入細胞(沿其濃度梯度)。
- 延遲整流器開啟,Na+ V 門控通道失活。
- K+ 離子大量湧出細胞(沿其濃度梯度)。
- Na+/K+ 泵利用 ATP 恢復濃度梯度。

配體門控離子通道是蛋白質通道,它們會開啟以接受離子(如 Na+、K+、Ca2+ 或 Cl-)透過膜,以響應配體[17]、神經遞質等化學信使的結合。[18] 這些蛋白質通常至少包含兩個結構域:一個跨膜結構域,包括離子孔,以及一個細胞外結構域,包括配體結合位點。[19]。LGIC 被分為三個超家族:半胱氨酸環通道、離子型穀氨酸通道和嘌呤受體通道。它們通常是五聚體,每個亞基包括構成跨膜結構域的 4 個跨膜螺旋,以及 β 摺疊三明治型細胞外 N 末端配體結合結構域。[20] 半胱氨酸環通道與化學信使結合,例如乙醯膽鹼(ACh)、甘氨酸(gly)、γ-氨基丁酸(GABA)或血清素(5-HT)。離子型穀氨酸受體(gluR)是同源亞基的四聚體,形成一個與電壓門控超家族非常相似的中心孔,但在膜中的拓撲方向相反。嘌呤受體通道(P2XR)被細胞外核苷酸(如 ATP)開啟。
一般來說,G 蛋白門控離子通道是位於細胞質膜中的特定離子通道,這些通道被相關蛋白直接啟用。G 蛋白也稱為鳥苷酸結合蛋白,是三個亞基的異三聚體:α-、β- 和 γ- 亞基。α-亞基 (Gα) 通常將 G 蛋白結合到 G 蛋白偶聯受體。這種受體蛋白有一個大的細胞外結合結構域,它會結合其各自的配體,例如神經遞質和激素。一旦配體與其受體結合,就會發生構象變化。G 蛋白中的這種構象變化導致 Gα 結合 GTP。這使得 G 蛋白髮生另一種構象變化,導致 βγ-複合體 (Gβγ) 與 Gα 分離。[21] 此時,Gα 和 Gβγ 都處於活躍狀態,可以繼續訊號轉導途徑。G 蛋白門控離子通道主要存在於中樞神經系統神經元和心房肌細胞中,並影響鉀 (K+)、鈣 (Ca2+)、鈉 (Na+) 和氯 (Cl-) 跨質膜的流動。[22]

離子等帶電粒子在半透膜附近有時不能均勻分佈在膜的兩側。[23] 通常,這是因為不同的帶電物質無法穿過膜,從而產生不均勻的電荷。[24] 例如,血漿中的大陰離子蛋白不能滲透到毛細血管壁。由於小陽離子被吸引,但沒有與蛋白質結合,因此小陰離子將比小陽離子更容易地穿過毛細血管壁遠離陰離子蛋白。
能斯特方程用於計算帶電荷為 z 的離子跨膜的電位。該電位使用細胞內外離子的濃度來確定。
對於一價陽離子,z= 1

細胞記憶體在的不參與電活動的負電荷,就是靜息電位。[25] 由於鉀離子也是平衡電位最負的離子,通常靜息電位不會比鉀離子平衡電位更負。所有細胞,包括神經元,都有靜息電位。但在神經元和肌肉纖維中,靜息電位非常重要,因為所有電活動都是從這個靜息電位變化而來的。靜息電位可以用戈德曼-霍奇金-卡茨電壓方程來計算,該方程使用離子的濃度來計算平衡電位,包括每個離子種類的相對通透性或電導。
戈德曼-霍奇金-卡茨電壓方程適用於 一價正離子種和 負離子
如果我們考慮將兩個 溶液隔開的膜,則會導致以下結果
- = 膜電位(以伏特表示,相當於每庫侖的焦耳)
- = 該離子的滲透性(以米每秒錶示)
- = 該離子的細胞外濃度(以摩爾每立方米表示,與其他SI單位相匹配)
- = 該離子的細胞內濃度(以摩爾每立方米表示)
- = 理想氣體常數(每開爾文每摩爾的焦耳)
- = 開爾文溫度
- = 法拉第常數(每摩爾的庫侖)
梯度電位
[edit | edit source]梯度電位是膜電位變化,是由配體門控離子通道蛋白個體作用的總和引起的,並且隨著時間和空間而減小。它們通常不涉及電壓門控鈉和鉀通道。[26]

梯度電位主要有三種類型
- 感受器電位是感覺感受器的跨膜電位差。[27] 它們是由轉導過程(將能量刺激轉化為電勢)產生的。它們可能是由機械門控通道或配體門控通道的開啟引起的。
- 突觸後電位是神經元化學突觸的突觸後末端的膜電位變化。突觸後電位是梯度電位,不應與動作電位混淆,儘管它們會引發或抑制動作電位[28]。它們是由配體門控通道的啟用引起的。去極化稱為興奮性突觸後電位(EPSP)。超極化稱為抑制性突觸後電位(IPSP)。突觸後電位的離子基礎被認為是神經傳遞。
- 終板電位是運動終板的化學誘導的電位變化,運動終板是肌肉細胞膜的一部分,位於神經肌肉接頭處神經纖維末端的對面。[29]。它們是由配體門控通道的啟用引起的。
動作電位
[edit | edit source]
在生理學中,動作電位是指興奮細胞(如神經細胞(神經元)、肌肉細胞、內分泌細胞等)膜電位在短時間內(約千分之一秒)的逆轉。[30]。在神經元中,動作電位發生在神經元將資訊從胞體傳送到軸突時。在其他型別的細胞中,它們啟用細胞內過程。例如,在肌肉細胞中,動作電位產生所有運動所需的收縮。在胰腺的β細胞中,它們誘導胰島素的釋放。[31]神經元中的動作電位也被稱為“神經衝動”或“尖峰”,神經元產生的動作電位的時間序列被稱為“尖峰序列”。一個發射動作電位的“神經元”通常被稱為“放電”[32]。
動作電位是由嵌入細胞質膜中的特定電壓門控離子通道產生的。[33] 當膜電位接近細胞的靜息電位時,這些通道是關閉的,但神經遞質或感覺受體細胞對細胞的刺激會部分開啟膜中通道形狀的蛋白質分子。鈉離子擴散到細胞中,使該部分膜的極化方向更靠近負極。如果這種區域性電位達到稱為閾電位的臨界狀態(約為 -60 mV),則鈉通道將完全開啟。鈉離子迅速湧入細胞,使細胞迅速去極化,形成約 +55 mV 的動作電位。動作電位的下降階段是由於鈉通道關閉和鉀通道開啟,鉀通道使細胞以鉀離子形式釋放的電荷量大約等於細胞離開的階段。因此,蛋白質轉運分子將鈉離子泵出細胞,並將鉀離子泵入細胞。這恢復了原始的離子濃度,膜準備迎接新的動作電位。
生物磁學
[edit | edit source]生物磁學是生物體產生的磁場現象;它是生物電磁學的子集。它研究生物組織中出現的電、電磁和磁現象。[34]。
麥克斯韋方程
[edit | edit source]麥克斯韋方程描述了電荷和電流如何產生電場和磁場。因此,當存在生物電場時,也總是存在生物磁場,反之亦然(麥克斯韋,1865)。
| 名稱 | 微分方程 | 積分形式 |
|---|---|---|
| 高斯電定律 | ||
| 高斯磁定律 (磁單極子的不存在) |
||
| 法拉第電磁感應定律 (麥克斯韋-法拉第方程) |
||
| 安培定律 (麥克斯韋修正) |
其中
- 是電場(伏特每米)。
- 是磁場強度(安培每米)。
- 是電位移場(庫侖每平方米)。
- 是磁通密度,也稱為磁感應強度(特斯拉,或韋伯每平方米)。
- 是自由電荷密度。它不包括材料中束縛的偶極電荷。(庫侖每立方米)。
- 是自由電流密度。它不包括材料中束縛的極化或磁化電流。(安培每平方米)。
- 是表面積A的微分向量元素,具有非常小的幅度和垂直於表面S的方向(平方米)。
- 是由表面S包圍的體積V的微分元素(立方米)。
- 是路徑長度的微分向量元素,該元素與包圍表面c的輪廓C相切(米)。
- 是上面定義的線元素的瞬時速度(用於移動電路)(米每秒)。
- 是散度運算元(SI 單位:每米 1),
- 是旋度運算元(SI 單位:每米 1)。
表. 場的測量[34]
| 生物電 | 生物電磁學(生物磁學) | 生物磁學 |
|---|---|---|
| 神經細胞 | ||
| 腦電圖 (EEG) | 腦磁圖 (MEG) | |
| 神經電圖 (ENG) | 神經磁圖 (MNG) | |
| 視網膜電圖 (ERG) | 視網膜磁圖 (MRG) | |
| 肌肉細胞 | ||
| 心電圖 (ECG) | 心磁圖 (MCG) | |
| 肌電圖 (EMG) | 肌磁圖 (MMG) | |
| 其他組織 | ||
| 眼電圖 (EOG) | 眼磁圖 (MOG) | |
| 眼震電圖 (ENG) | 眼震磁圖 (MNG) | |
| 肺磁圖 | ||
| 肝磁圖 |
體積導體模型是心磁圖 (MCG)、心電圖 (ECG)、腦電圖 (EEG) 和腦磁圖 (MEG) 中源分析的基礎。生物電磁學中的體積傳導,可以定義為電場或磁場從電初級電流源透過生物組織向測量感測器傳輸。體積導體是指連續的導電介質。大腦、腦膜、顱骨和頭皮構成了一個體積導體,透過該導體可以測量離子流動產生的電流。

例如,在心電圖 (ECG) 中,可以在體表放置電極並測量心臟電位,因為身體充當心臟電流的導體。在靜息極化狀態下,正極和負極電極之間不存在電位差(即等電位 - 平坦的紅線)。在心室內部,當組織的左側發生去極化(表示 SA 節的放電)時,去極化波開始在心室中擴散。在此期間,某些部分在外部暫時保持為正(極化),而某些部分為負(去極化);因此,電荷分離會在兩個電極之間產生電位差。當去極化波向正電極移動時,按照慣例,會記錄正電壓(向上偏轉)。當一半的部分去極化時,電壓達到其最大正值。一旦整個心室質量去極化(所有細胞在外部為負),就不再存在電位差,電壓與極化狀態相同。當復極化發生時,首先從左側開始(SA 節區域),然後穿過心室,心室表面將再次出現正負電荷,但這一次,負電荷將最靠近正電極。復極化波橫掃心室,遠離負電極並朝向正電極,按照慣例,會導致負電壓(心室向上偏轉,根據部分不同)。最後,當所有細胞都復極化時,測量的電壓差將再次與初始階段相同,直到出現另一波去極化。

人體被認為是一個電阻性的、分段均勻的和線性的體積導體。大多陣列織是各向同性的。然而,肌肉是強各向異性的,腦組織也是各向異性的。
各種組織的電阻率
| 組織 | 電阻率 () | 參考 |
|---|---|---|
| 膀胱 | 4.41 | Matthew Christensen,2010[35] |
| 血液 | 1.6 | Geddes 和 Sadler,1973[36] |
| 骨骼 | 12400 | Matthew Christensen,2010[35] |
| 骨骼 | 25 | Geddes 和 Sadler,1973[36] |
| 骨骼(縱向) | 177 | Rush 和 Driscoll,1969[37] |
| 骨骼(周向) | 15 | Saha 和 Williams,1992[37] |
| 大腦(灰質) | 2.2 | Rush 和 Driscoll,1969[37] |
| 大腦(白質) | 6.8 | Barber 和 Brown,1984[38] |
| 大腦(平均) | 5.8 | Barber 和 Brown,1984[38] |
| 乳房 | 3.39 | Matthew Christensen,2010[35] |
| 脂肪 | 21.7 | Rush、Abildskov 和 McFee,1963[39] |
| 心臟 | 1.75 | Matthew Christensen,2010[35] |
| 腎臟 | 2.11 | Matthew Christensen,2010[35] |
| 肝臟 | 3.42 | Matthew Christensen,2010[35] |
| 肺部 | 1.57 | Matthew Christensen,2010[35] |
| 心肌(縱向) | 2.5 | Rush、Abildskov 和 McFee,1963 [39] |
| 心肌(橫向) | 5.6 | Rush、Abildskov 和 McFee,1963 [39] |
| 骨骼肌(縱向) | 1.9 | Epstein 和 Foster,1982[40] |
| 骨骼肌(橫向) | 13.2 | Epstein 和 Foster,1982[40] |
主要型別的電極是
- 簡單的固體導體,例如導電圓盤和針頭(單針或陣列,通常除針尖外都絕緣),
- 印刷電路板上的導電圖案,除針尖外也絕緣,以及
- 充滿電解質的空心管,例如充滿氯化鉀溶液或其他電解質溶液的玻璃吸管,用於細胞外或細胞內記錄。
主要樣品製備包括
- 活生物體,
- 切除組織(急性或培養),
- 從切除組織中分離的細胞(急性或培養),
- 人工培養的細胞或組織,或
- 上述混合物。

光學電生理技術的發明是為了克服經典技術的侷限性。在經典技術中,只能在一定體積的組織內大約一個點觀察電活動。經典技術需要對分散式現象進行單點化。人們對生物電活動的時空分佈的興趣促使人們開發了能夠響應其電或化學環境而發出光的分子。例如,電壓敏感染料和熒光蛋白。
透過灌注、注射或基因表達方式施用一種或多種此類化合物,可以觀察和記錄電活動分佈。根據光學儀器和計算機軟體的發展,三維分子水平的實驗成為可能。
透過電壓鉗位技術,可以瞭解動作電位在軸突上傳播時隨電壓和時間變化的機制。實驗者將細胞電位“鉗位”在選定的值上。換句話說,就是測量在任何給定的電壓下,有多少離子電流穿過細胞膜。這很重要,因為神經元膜上的許多離子通道是電壓門控離子通道,只有當膜電壓在一定範圍內時才會開啟。從這些實驗中獲得的資料透過動作電位的數學重建得到了驗證。 [41]


膜片鉗技術是電壓鉗位技術的一種專門版本。膜片鉗微電極是一種開口端直徑相對較大(直徑約為一微米)、表面拋光而不是尖銳的微電極。 [42] [43]
該膜片微電極壓在細胞表面,並透過微電極施加輕微的吸力,將一小塊細胞膜(“膜片”)吸入其尖端。吸力使微電極與細胞膜形成一個緊密的密封,電阻達到幾十吉歐姆。這種結構被稱為“細胞連線”模式,對於研究膜片中離子通道的活動非常有用。
有多種膜片鉗結構,用於不同的實驗觀察。如果施加更大的吸力,電極尖端的少量膜片可能會被移除,使電極密封到細胞的其餘部分。這種“全細胞”模式提供了非常穩定的細胞內記錄。缺點是,由於細胞的細胞內液與記錄電極內的溶液混合,因此一些細胞內液成分可能會被稀釋。
“穿孔膜片”技術試圖將這些問題降到最低。它不是使用吸力,而是使用膜片上的小孔,並加入少量抗真菌或抗生素藥物,如兩性黴素 B、制黴菌素或短桿菌肽。當抗生素分子擴散到膜片中時,它們會在膜上形成小孔,使離子能夠自由地穿過這些孔。問題是,它需要很長時間才能讓抗生素擴散到細胞中。而且電阻可能更高,膜片可能會被抗生素破壞。
這項技術是由埃爾溫·內爾和伯特·薩克曼開發的,他們獲得了 1991 年的諾貝爾獎。[44]
直到 20 世紀 70 年代後期,使用兩個微電極來控制神經和肌肉細胞中的電壓已成為測量膜電流的一種成熟方法。但是,雙電極電壓鉗位技術在兩個應用領域遇到了侷限性。首先,當第二個電極穿透小細胞時,會導致損傷。其次,在體內製備中,細胞通常是看不見的。如果電壓鉗位用單個電極實現,這兩個問題都可以解決。[45]
單電極電壓鉗位是一種特殊的電路鉗位裝置,其中單個微電極用於測量膜電壓,並傳遞控制電壓水平所需的電流。快速的電子開關將微電極的連線在這兩種功能之間進行切換。
自 1990 年以來,平面膜片鉗系統開始在研究實驗室和公司中取代人工膜片鉗。 [46]在傳統的膜片鉗技術中,膜片微電極使用顯微操作器在光學控制下移動到細胞上。微電極與細胞之間的相對運動應避免,以保持細胞-微電極連線的完整性。在平面膜片結構中,細胞透過吸力放置 - 細胞和孔之間的相對運動可以在密封后排除。不需要防振臺。晶片通常由矽、玻璃、PDMS、聚醯亞胺製成。自動化膜片鉗系統通常更復雜,也更昂貴,但具有並行和免手動操作的優勢,包括在短時間內獲得大量資料。
- ↑ a b Reginald H. Garrett;Charles M. Grisham (2008). Biochemistry. Boston: Brooks Cole; 4th Ed. ISBN 10- 0495109355.
{{cite book}}: Check|isbn=value: length (help)CS1 maint: multiple names: authors list (link) - ↑ Stein, W. D. (1967). 細胞膜分子運動. 紐約: 學術出版社.
{{cite book}}: 檢查日期值:|year=(幫助) - ↑ Mathews C. K.; Van Holde, K.E; Ahern, K.G (2003). 生物化學 (第 3 版). ISBN 84-7829-053-2.
- ↑ a b Cusslera, E.; Arisa, R.; Bhown, A. (1989). "關於促進擴散的限制". 膜科學雜誌. 2–3: 149–164.
{{cite journal}}: 忽略文字“DOI:10.1016/S0376-7388(00)85094-2” (幫助)CS1 maint: 多個名稱:作者列表 (連結) 無效的<ref>標記;名稱“tm4”定義了多次,但內容不同 - ↑ Guyton, Arthur C.; Hall, John E. (2006). "醫學生理學教科書", Elsevier.
- ↑ Physiologyweb,講義筆記
- ↑ Crane, Robert K.; Miller, D.; Bihler, I. (1961). "腸道糖類運輸可能機制的限制". 在 Kleinzeller, A.; Kotyk, A. (ed.). 膜轉運和代謝。1960 年 8 月 22 日至 27 日在布拉格舉行的研討會論文集. 布拉格: 捷克科學院. pp. 439–449.
{{cite book}}: CS1 maint: 多個名稱:編輯列表 (連結) - ↑ 維基百科,離子通道
- ↑ Hille, Bertil (2001) [1984]. 可興奮膜的離子通道 (第 3 版). 馬薩諸塞州桑德蘭: Sinauer Associates, Inc. p. 5. ISBN 0-87893-321-2.
- ↑ Hille, Bertil (1984). 可興奮膜的離子通道.
- ↑ Purves, (2001). "第 4 章:通道和轉運蛋白". 在 Dale Purves, George J. Augustine, David Fitzpatrick, Lawrence. C. Katz, Anthony-Samuel LaMantia, James O. McNamara, S. Mark Williams, 編輯 (ed.). 神經科學 (第 2 版). Sinauer Associates Inc. ISBN 0-87893-741-2.
{{cite book}}:|editor=有通用名稱 (幫助)CS1 maint: 多餘的標點符號 (連結) CS1 maint: 多個名稱:編輯列表 (連結) - ↑ Hille B, Catterall, WA (1999). "第 6 章:電興奮性和離子通道". 在 George J Siegel, Bernard W Agranoff, R. W Albers, Stephen K Fisher 和 Michael D Uhler (ed.). 神經化學基礎:分子、細胞和醫學方面. 費城: Lippincott-Raven. ISBN 0-397-51820-X.
{{cite book}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ Camerino DC, Tricarico D, Desaphy JF (2007 年 4 月). "離子通道藥理學". 神經治療學. 4 (2): 184–98. doi:10.1016/j.nurt.2007.01.013. PMID 17395128.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (連結) - ↑ Verkman AS, Galietta LJ (2009 年 2 月). "氯離子通道作為藥物靶點". Nat Rev Drug Discov. 8 (2): 153–71. doi:10.1038/nrd2780. PMC 3601949. PMID 19153558.
- ↑ Camerino DC, Desaphy JF, Tricarico D, Pierno S, Liantonio A (2008). "離子通道疾病的治療方法". Adv. Genet. 遺傳學進展. 64: 81–145. doi:10.1016/S0065-2660(08)00804-3. ISBN 978-0-12-374621-4. PMID 19161833.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Yu FH, Catterall WA (2003). "電壓門控鈉通道家族概述". Genome Biol. 4 (3): 207. doi:10.1186/gb-2003-4-3-207. PMC 153452. PMID 12620097.
- ↑ Template:DorlandsDict
- ↑ Purves, Dale, George J. Augustine, David Fitzpatrick, William C. Hall, Anthony-Samuel LaMantia, James O. McNamara, and Leonard E. White (2008). 神經科學。 第 4 版. Sinauer Associates. pp. 156–7. ISBN 978-0-87893-697-7.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Hille B (2001) 可興奮膜的離子通道,第 3 版。 Sinauer Associates,桑德蘭,馬薩諸塞州。
- ↑ Cascio M (2004). "甘氨酸受體和相關菸鹼類受體的結構和功能". J. Biol. Chem. 279 (19): 19383–6. doi:10.1074/jbc.R300035200. PMID 15023997.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2007). 生物化學 (第 6 版). 舊金山: W.H. Freeman. ISBN 0-7167-8724-5.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Koyrakh L, Luján R, Colón J, Karschin C, Kurachi Y, Karschin A, Wickman K (2005 年 12 月). "神經元 G 蛋白門控鉀通道的分子和細胞多樣性". J. Neurosci. 25 (49): 11468–78. doi:10.1523/JNEUROSCI.3484-05.2005. PMID 16339040.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ http://www.cartage.org.lb/en/themes/Reference/dictionary/Biologie/G/13.html,於 2006 年 8 月 28 日檢索
- ↑ 吉布斯-唐南平衡...,D.C. Mikulecky,於 2006 年 8 月 28 日檢索
- ↑ 一個 示例 用於證明 K+ 對靜息電位重要性的電生理實驗。 靜息電位對 K+ 胞外濃度的依賴性如 Dale Purves、George J. Augustine、David Fitzpatrick、Lawrence C. Katz、Anthony-Samuel LaMantia、James O. McNamara、S. Mark Williams 在其第二版 神經科學 的圖 2.6 中所示。 桑德蘭 (馬薩諸塞州):Sinauer Associates, Inc.;2001。
- ↑ Hille 2001,pp. 169–200. “第 6 章。 快速化學突觸的配體門控通道。”
- ↑ Hille,Bertil (2001). “第 8 章。 感官轉導和可興奮細胞。”. 可興奮膜的離子通道 (第 3 版). 桑德蘭,馬薩諸塞州:Sinauer. pp. 237–268. ISBN 0-87893-321-2.
{{cite book}}: 無效|ref=harv(幫助) - ↑ 維基百科,突觸後電位
- ↑ 不列顛百科全書,終板電位 (EPP)
- ↑ 不列顛百科全書,動作電位
- ↑ MacDonald PE, Rorsman P (2006 年 2 月). "胰腺 β 細胞的振盪、細胞間耦合和胰島素分泌". PLoS Biol. 4 (2): e49. doi:10.1371/journal.pbio.0040049. PMC 1363709. PMID 16464129.
- ↑ 維基百科,動作電位
- ↑ Barnett MW, Larkman PM (2007 年 6 月). "動作電位". Pract Neurol. 7 (3): 192–7. PMID 17515599.
- ↑ a b 生物電磁學 - 生物電場和生物磁場的原理和應用,牛津大學出版社,紐約,1995 年。
- ↑ a b c d e f g 馬修·克里斯滕森,WO2010126827 A2,2010 年 11 月 4 日
- ↑ a b Geddes LA, Baker LE (1967):生物材料的比電阻 - 生物醫學工程和生理學家資料彙編。Med. Biol. Eng. 5: 271-93
- ↑ a b c Rush S, Driscoll DA (1969):腦電圖電極靈敏度 - 相互性的應用。IEEE Trans. Biomed. Eng. BME-16:(1) 15-22. 無效的
<ref>標籤;名稱“Rush”在不同內容中定義多次 - ↑ a b Barber DC, Brown BH (1984):應用電位層析成像。J. Phys. E.: Sci. Instrum. 17: 723-33.
- ↑ a b c Rush S, Abildskov JA, McFee R (1963):人體組織在低頻下的電阻率。迴圈 22:(1) 40-50.
- ↑ a b Epstein BR, Foster KR (1983):各向異性作為骨骼肌的介電特性。Med. & Biol. Eng. & Comput. 21:(1) 51-5.
- ↑ Cole K.S. (1955) 離子、電位和神經衝動。在 Shedlovsky, T (編輯) 生物學和醫學中的電化學。紐約,Wiley。第 121-140 頁
- ↑ Hamill OP, Marty A, Neher E, Sakmann B, Sigworth FJ. (1981). "改進的膜片鉗技術,用於從細胞和無細胞膜片中進行高解析度電流記錄". Pflügers Archiv European Journal of Physiology. 391 (2): 85–100. doi:10.1007/BF00656997. PMID 6270629.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (link) - ↑ Tanzi S, Østergaard PF, Matteucci M, Christiansen TL, Cech J, Marie R, Taboryski RJ (2012). "使用多級幹法蝕刻、電鍍和模塑工藝製造組合尺度奈米流體和微流體聚合物系統". Journal of Micromechanics and Microengineering. 22 (11): 115008. Bibcode:2012JMiMi..22k5008T. doi:10.1088/0960-1317/22/11/115008.
{{cite journal}}: CS1 maint: 多個名稱:作者列表 (link) - ↑ 1991 年諾貝爾生理學或醫學獎
- ↑ 神經元電生理學和生物物理學實驗室技術指南 (1993)
- ↑ http://www.nanion.de/pdf/PlanarPatchClamping.pdf












![{\displaystyle E={\frac {RT}{zF}}\ln {\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}=2.303{\frac {RT}{zF}}\log _{10}{\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d6f087a94da0f33a7735fa18ca8408bbca442cf)
![{\displaystyle E=-60mV\ln {\frac {[{\text{ion outside cell}}]}{[{\text{ion inside cell}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bac658923af68e11720fa4ba0e6edafc93898bcb)


![{\displaystyle E_{m}={\frac {RT}{F}}\ln {\left({\frac {\sum _{i}^{N}P_{M_{i}^{+}}[M_{i}^{+}]_{\mathrm {out} }+\sum _{j}^{M}P_{A_{j}^{-}}[A_{j}^{-}]_{\mathrm {in} }}{\sum _{i}^{N}P_{M_{i}^{+}}[M_{i}^{+}]_{\mathrm {in} }+\sum _{j}^{M}P_{A_{j}^{-}}[A_{j}^{-}]_{\mathrm {out} }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4168067dcf31b41af9beddcc7e9a3beba72aab8c)

![{\displaystyle E_{m,\mathrm {K} _{x}\mathrm {Na} _{1-x}\mathrm {Cl} }={\frac {RT}{F}}\ln {\left({\frac {P_{Na^{+}}[Na^{+}]_{\mathrm {out} }+P_{K^{+}}[K^{+}]_{\mathrm {out} }+P_{Cl^{-}}[Cl^{-}]_{\mathrm {in} }}{P_{Na^{+}}[Na^{+}]_{\mathrm {in} }+P_{K^{+}}[K^{+}]_{\mathrm {in} }+P_{Cl^{-}}[Cl^{-}]_{\mathrm {out} }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2504511122b4215bf6fa6aef42441b3da96cec09)


![{\displaystyle [ion]_{\mathrm {out} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5d2e7fe4863a9c797f60607f91baeab4391607b)
![{\displaystyle [ion]_{\mathrm {in} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/23ebffa4ae9cdb7523b8a4dd8e1752a6380b22e3)