高中化學/原子大小
在元素週期表中,有許多物理性質並不像以前定義的那樣“相似”,而是更像趨勢。這意味著,當您沿著一組元素或一個週期移動時,您將看到這些性質的趨勢變化。我們將討論三個特定的週期趨勢。本章的第一課專門研究元素週期表中原子大小的趨勢。接下來的兩節課將討論電離能和電子親和能。這些趨勢都可以用原子的電子構型來理解。
觀察到的原子大小的實際趨勢與三個因素有關。這些因素是
- 原子核中質子的數量(稱為核電荷)。
- 容納電子的能級數量(以及外層能級中電子的數量)。
- 原子核與其最外層電子之間容納的電子數量(稱為遮蔽效應)。
- 定義原子半徑。
- 說明原子大小的邊界問題。
- 描述測量原子大小的方法。
- 定義遮蔽效應。
- 描述決定原子大小趨勢的因素。
- 描述原子大小在族和週期中的總體趨勢。
- 描述元素週期表中各行原子半徑的趨勢。
- 描述原子半徑趨勢如何適用於過渡金屬。
- 使用總體趨勢預測原子的相對大小。
- 使用有效核電荷的概念來解釋為什麼主族元素的原子半徑在元素週期表中向下移動一個族時會增加
- 由於 f 軌道的複雜結構和 f 電子對的遮蔽效果差,導致鑭系收縮現象。
原子電子雲佔據的空間區域通常被認為是電子的機率分佈,因此,電子雲沒有明確的“外邊緣”。原子大小的定義有幾種不同的方式,這些不同的定義通常會產生一些原子大小測量值的變化。
由於從原子核到電子雲最外邊緣測量原子大小非常困難,化學家使用其他方法來獲得一致的原子大小測量值。化學家定義原子大小的一種方法是使用原子半徑。原子半徑是指雙原子分子(雙原子分子是指由兩個原子組成的分子,同核分子是指兩個原子都是相同的元素)中心之間的距離的一半。下圖表示原子大小定義的視覺化表示。
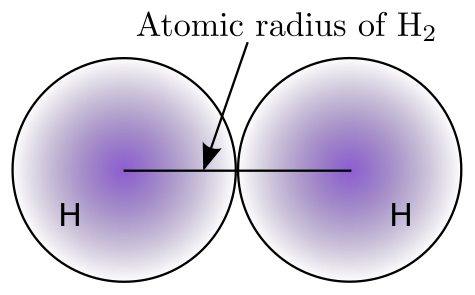
我們如何測量原子的尺寸?盧瑟福因其用α粒子轟擊金箔的實驗而聞名。盧瑟福在1911年首次進行的金箔實驗,在這一單元中對我們特別重要,因為它第一次為科學提供了原子大小的近似測量值。他利用 1900 年代初期的技術,能夠定量地確定原子核的近似尺寸為 4×10−12 cm。原子的尺寸略大,直徑約為 2×10−8 cm。
現在讓我們從一個族或族(從上到下)來看原子半徑或原子的尺寸。例如,讓我們看一下第 1 族金屬。這個族(以及所有其他主族)中的每個原子在外層能級中具有與該族中所有其他原子相同的電子數。元素週期表中的每一行(週期)表示另一個新增的能級。當我們第一次學習主能級時,我們瞭解到每個新的能級都比之前的能級更大。能級 2 比能級 1 大,能級 3 比能級 2 大,等等。因此,當我們從元素週期表中的一週期向下移動到另一週期時,每個連續的週期表示添加了更大的能級。很明顯,當我們從元素族向下移動時,每個新原子都添加了一個能級,因此會更大。

影響原子大小的另一個因素是遮蔽效應。原子核中的質子由於靜電荷相反,會吸引外層能級中的價電子。這種吸引力的強度取決於電荷的大小、電荷之間的距離,以及原子核和價電子之間的電子數。核心電子遮蔽價電子免受原子核的影響。核心電子的存在削弱了原子核和價電子之間的吸引力。這種吸引力的減弱稱為遮蔽效應。遮蔽的程度取決於原子核和價電子之間的電子數。原子核對價電子的吸引力越強,當吸引力強時,價電子層可以收縮得更緊密,而當吸引力減弱時,價電子層不會收縮得那麼緊密。遮蔽作用越強,價電子層可以擴充套件得越遠。
| 元素 | 質子數 | 電子構型 | 能級數 |
|---|---|---|---|
| Li | 3 | [Ne]2s1 | 2 |
| Na | 11 | [He]3s1 | 3 |
| K | 19 | [Ar]4s1 | 4 |
| Rb | 37 | [Kr] 5s1 | 5 |
| Cs | 55 | [Xe]6s1 | 6 |
例如,如果您正在觀察鈉元素,它的電子構型為
- Na: 1s22s22p63s1
外層能級為n = 3,有一個價電子,但這個單個價電子與具有 11 個質子的原子核之間的吸引力被另外 10 個內部(或核心)電子遮蔽了。
當我們將鈉原子與銫原子進行比較時,我們注意到質子數和被電子佔據的能級數都在增加。原子核和外層電子之間還有更多的電子,從而遮蔽了原子核的吸引力。
- Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1
因此,最外層的電子 6s1 被非常鬆散地束縛。換句話說,由於遮蔽作用,原子核對這個 6s1 電子的控制力比它對 3s1 電子的控制力弱。所有這一切的結果是原子的大小會更大。表 10.2 給出了第 1 族金屬的原子半徑值,以及一個視覺化表示,以更好地瞭解元素週期表中一個族中原子大小的變化(原子半徑的測量單位為皮米 [pm] 或 1×10−12 米)。
| 元素 | 原子半徑 | 視覺 |
|---|---|---|
| Li | 123 pm | 
|
| Na | 157 pm | 
|
| K | 203 pm | 
|
| Rb | 216 pm | 
|
| Cs | 235 pm | 
|
對於第 1 族金屬而言,元素週期表中所有族或家族都是如此。當您沿元素週期表中的一個族向下移動時,原子的尺寸會增加。例如,鹵族中最大的原子是溴和碘(因為砈具有放射性,並且僅存在很短時間,所以我們將它排除在討論之外)。
|
示例問題 以下哪一個更大?解釋。
解決方案:
|
如前所述,對於主族金屬而言,電子構型中的最外層能級由週期數表示。因此,鎂元素 (Z = 12) 位於週期 3,第 2 族。據此,我們可以說有 3 個能級,最外層能級中有 2 個電子。讓我們看一下鎂的電子構型。
- Mg: 1s22s22p63s2
從鎂移動到鍶,鍶位於週期 5 的第 2 族。這意味著最外層能級中有兩個電子。鍶的電子也佔據了五個能級。
- Sr: 11s22s22p63s23p64s23d104p65s2
您可以想象,隨著能級數的增加,原子的尺寸也會增加。電子雲中能級數的增加佔據了更多的空間。
因此,元素週期表中一個族或家族內的趨勢是,原子尺寸隨著能級數的增加而增加。下面的元素週期表顯示了原子大小在族中的趨勢。箭頭表示增加的方向。

為了確定週期的趨勢,我們需要觀察質子數(**核電荷**)、能級數和遮蔽效應。對於元素週期表中的一行,原子序數仍然增加(正如它在族中所做的那樣),因此質子數會增加。當我們檢查第二週期的能級時,我們發現最外層的能級在電子數增加時不會發生變化。在第二週期中,每個額外的電子都進入第二能級。所以能級數*不會增加*。當我們從左到右穿過一個週期時,最外層能級中的電子數增加*但它仍然是同一個最外層能級*。表 10.3 顯示了第二週期元素的電子構型。
| 元素 | 質子數 | 電子構型 |
|---|---|---|
| 鋰 (Li) | 3 | 1s22s1 |
| 鈹 (Be) | 4 | 1s22s2 |
| 硼 (B) | 5 | 1s22s22p1 |
| 碳 (C) | 6 | 1s22s22p2 |
| 氮 (N) | 7 | 1s22s22p3 |
| 氧 (O) | 8 | 1s22s22p4 |
| 氟 (F) | 9 | 1s22s22p5 |
觀察第二週期元素,質子數從鋰(3 個質子)增加到氟(9 個質子)。因此,核電荷在週期中增加。同時,被電子佔據的能級數*保持不變*。最外層能級中的電子數從左到右沿著一個週期增加,但這將如何影響半徑?我們知道,第二行中的每一種元素在其內層能級中都有兩個電子(2 個核心電子)。核心電子遮蔽了外層電子免受原子核電荷的影響。對於鋰,有兩個核心電子和一個價電子,因此這兩個核心電子將遮蔽那個價電子。在鈹中,有 4 個質子被 1s2 電子遮蔽。隨著質子數增加吸引著外層電子,而核心電子的遮蔽作用相同,*價電子被拉得更靠近原子核,使原子變小*。
在第 17 族中,該族中的第一個元素是氟。對於氟,有 9 個質子和 9 個電子。電子構型是 1s22s22p5。然而,與鋰和鈹一樣,核心電子仍然相同,即 1s2 電子。由於質子更多,因此核電荷增加。隨著核電荷的增加,質子和外層能級之間的拉力也增加,將外層電子拉向原子核。遮蔽原子核的量沒有增加,因為核心電子的數量保持不變(本週期為 1s2)。最終結果是,原子尺寸在橫跨該行時*減小*。在表 10.4 中,顯示了從鋰開始到氟結束的行中原子半徑的值,以及一個視覺表示來理解元素週期表中族中尺寸變化。
| 元素 | 原子半徑 | 視覺 |
|---|---|---|
| Li | 123 pm | 
|
| Be | 111 pm | 
|
| B | 86 pm | 
|
| C | 77 pm | 
|
| N | 74 pm | 
|
| O | 73 pm | 
|
| F | 72 pm | 
|
讓我們將這個新趨勢新增到元素週期表中。看下面我們新的“週期趨勢表”的圖表。在圖表中你會注意到,週期的趨勢箭頭顯示原子半徑從右到左增加,這與從左到右減小相同。

考慮到關於原子尺寸的所有資訊,你會認識到元素週期表中最大的原子位於最左邊和最底部,即鍅,#87,而最小的原子位於最右邊和最頂部,即氦,#2。
在族中向下移動時原子變大的事實可能正是你在閱讀本節之前所期望的,但原子在週期中向右移動時變小的這一事實很可能是一個巨大的驚喜。確保你理解這個趨勢及其原因。
對於過渡元素,趨勢不那麼有規律
[edit | edit source]元素週期表中原子半徑的一般趨勢與下面圖表中發現的趨勢相似。原子半徑最小的元素位於右上角;原子半徑最大的元素位於左下角。

到目前為止,我們只研究了主族金屬。讓我們看看我們的三個因素,並看看這些因素如何符合過渡金屬系列。觀察過渡金屬的第一行,即 3d 行,表 10.5 顯示了該行中 10 個元素中每個元素的質子數。質子數正在增加,因此核電荷正在增加。
| 元素 | 質子數 | 電子構型 |
|---|---|---|
| 鈧 (Sc) | 21 | [Ar]3d14s2 |
| 鈦 (Ti) | 22 | [Ar]3d24s2 |
| 釩 (V) | 23 | [Ar]3d34s2 |
| 鉻 (Cr) | 24 | [Ar]3d54s1 |
| 錳 (Mn) | 25 | [Ar]3d54s2 |
| 鐵 (Fe) | 26 | [Ar]3d64s2 |
| 鈷 (Co) | 27 | [Ar]3d74s2 |
| 鎳 (Ni) | 28 | [Ar]3d84s2 |
| 銅 (Cu) | 29 | [Ar]3d104s1 |
| 鋅 (Zn) | 30 | [Ar]3d104s2 |
電子數量正在增加,但以一種特殊的方式增加。我們知道,隨著電子數量在橫跨一個週期時增加,這些電子對原子核的吸引力也更大。但是,對於d電子,存在一些額外的**電子-電子排斥**。看一下表 10.5,注意鉻的非尋常電子構型。
在鉻中,一個 4s 電子被提升以半填充 3d 亞層,電子-電子排斥力較小,原子尺寸也較小。該行的後半部分正好相反。表 10.6 顯示了過渡金屬的第一行及其尺寸。
| 元素 | 原子半徑 |
|---|---|
| 鈧 (Sc) | 164 pm |
| 鈦 (Ti) | 147 pm |
| 釩 (V) | 135 pm |
| 鉻 (Cr) | 129 pm |
| 錳 (Mn) | 137 pm |
| 鐵 (Fe) | 126 pm |
| 鈷 (Co) | 125 pm |
| 鎳 (Ni) | 125 pm |
| 銅 (Cu) | 128 pm |
| 鋅 (Zn) | 137 pm |
我們可以看到,3d 過渡金屬中的趨勢不像主族元素那樣有規律。
課程總結
[edit | edit source]- 原子尺寸是指從原子核到價電子所在的價電子層之間的距離。
- 原子尺寸很難測量,因為它沒有明確的邊界。圍繞原子核的電子存在於電子雲中。你可以預測電子的存在機率,但不能預測其確切位置。
- 原子尺寸是間接確定的。
- 原子半徑是定義原子尺寸的一種更明確、更可測量的量。它是同核雙原子分子中兩個原子中心之間的距離。
- 盧瑟福透過他的金箔實驗為確定原子的大小做出了貢獻。
- 有三個因素有助於預測元素週期表中的趨勢:原子核中的質子數、電子層數和遮蔽效應。
- 由於三個因素都增加,原子尺寸在任何族中從上到下增加。(隨著能級數的增加,尺寸必須增加。)
- 橫跨一個週期(從左到右),質子數增加,因此核電荷增加。(橫跨一個週期,電子能級數保持不變,但這些能級內的電子數增加。因此電子被拉得更靠近原子核。)
- 遮蔽相對恆定,因為核心電子保持不變。
- 元素週期表中的趨勢是,當您從左到右穿過元素週期表時,原子半徑減小。對於過渡金屬,這種趨勢不那麼有規律,因為其他因素起作用。
複習題
[edit | edit source]- 為什麼原子尺寸被認為是“沒有明確的邊界”?
- 原子尺寸是如何測量的?
- (a) 使用分光光度計
- (b) 使用微型尺(稱為奈米尺)
- (c) 間接
- (d) 直接
- 畫出碘分子原子半徑的視覺表示。
- 以下哪一個更小?
- (a) In 或 Ga
- (b) K 或 Cs
- (c) Te 或 Po
- 用你自己的話說解釋為什麼碘比溴大。
- 哪些三個因素決定了族中原子尺寸的趨勢?
- 哪些族傾向於表現出這種趨勢?
- 以下哪一個具有最大的原子半徑?
- (a) Si
- (b) C
- (c) Sn
- (d) Pb
- 以下哪一個具有最小的原子半徑?
- (a) 2s2
- (b) 4s24p3
- (c) 2s22p4
- (d) 4s2
- 按原子半徑遞增的順序排列以下元素:Tl、B、Ga、Al、In。
- 按原子半徑遞增的順序排列以下元素:Ge、Sn、C。
- 以下哪一個更大?
- (a) Rb 或 Sn
- (b) Ca 或 As
- 按原子半徑遞增的順序排列以下元素:Mg、Cl、S、Na。
- 描述元素週期表中行的原子尺寸趨勢。
- 繪製元素週期表的視覺表示,描述原子尺寸的趨勢。
- 以下哪一個具有最大的原子半徑?
- (a) Sr
- (b) Sn
- (c) Rb
- (d) In
- 以下哪一個具有最小的原子半徑?
- (a) K
- (b) Kr
- (c) Ga
- (d) Ge
- 按原子半徑遞增的順序排列以下元素:In、Ca、Mg、Sb、Xe。
- 按原子半徑遞減的順序排列以下元素:Al、Ge、Sr、Bi、Cs。
- 瞭解行的趨勢,你預計原子獲得一個電子後對原子半徑的影響是什麼?用一個例子來解釋。
- 瞭解行的趨勢,你預計原子失去一個電子後對原子半徑的影響是什麼?用一個例子來解釋。
詞彙
[edit | edit source]- 原子半徑
- 同核分子中兩個原子核心的距離的一半。
- 原子大小
- 原子尺寸是指從原子核到價電子所在的價電子層之間的距離。
- 電子-電子排斥
- 由於電子具有相同的電荷而產生的分離。
- 核電荷
- 原子核中質子的數量。
- 遮蔽效應
- 原子中的內層電子會干擾原子核對最外層電子的吸引。
本資料改編自可在此處找到的原始 CK-12 書籍。本作品根據知識共享署名-相同方式共享 3.0 美國許可釋出。
